以秀丽隐杆线虫为模型的玛咖功效评价
王丽萍, 张丽梅, 侯思远, 徐 佳, 隋天卓, 张瑞宁, 王琪菲, 王立成
(1. 吉林大学 生命科学学院, 长春 130012; 2. 新时代健康产业(集团)有限公司, 北京102206; 3. 吉林大学 化学学院, 长春 130012)
玛咖(Maca)又名玛卡, 属于十字花科一年生草本植物. 叶子椭圆, 根茎肥厚, 下胚轴与根融合, 形成一个粗糙倒梨形的块根[1]. 玛咖的药用价值及营养成分随生长环境的不同而不同. 玛咖作为一种纯天然食品, 富含大量营养素, 其下胚轴部分可作为药物或食物, 具有“药食同源”的双重功效. 玛咖干根内含丰富的矿物质, 并含丰富的维生素C、 维生素B族(B1,B2,B5,B6,B12)、 维生素A、 维生素E、 碳水化合物、 不饱和脂肪酸、 亚油酸和亚麻酸、 蛋白质和纤维等[2]. 玛咖中的氨基酸与锌、 铁、 牛磺酸等成份可改善人体生理机能, 并提高人体免疫力[3-5]. 玛咖中天然活性成份以生物碱类物质和芥子油苷为主[6-8], 芥子油苷的分解产物异硫氰酸苄酯、 甾醇、 多酚也是生物活性物质, 应用广泛[9-10]. 下丘脑和脑垂体是玛咖中生物碱的主要作用靶点, 玛卡烯、 玛卡酰胺对改善性功能、 提高精子数量有显著功效, 对睾丸、 卵巢具有调节作用, 通过平衡机体荷尔蒙水平进一步稳定内分泌系统[11]. 此外, 玛咖可改善因压力导致的忧虑症和神经衰弱.
秀丽隐杆线虫(Caenorhabditiselegans, 线虫)是典型的抗氧化、 抗衰老研究模型, 其成虫多为自我繁殖的雌雄同体, 20 ℃平均寿命为18~20 d. 幼虫期线虫是衡量药物对发育影响的关键时期; 成虫期线虫常用于评估药物毒性以及基因表达的研究[12]. 线虫寿命、 产卵量、 吞咽率及运动能力是衡量线虫正常生理活动的关键指标, 也是评估待筛选药物毒性作用的关键指标. 线虫体内存在过氧化现象, 在生理表型上会随时间的推移表现出不同程度的衰老表型, 如移动程度缓慢, 身体肥大臃肿, 泄殖腔堵塞, 不能正常排卵、 生殖, 咽部收缩程度降低, 进食量减少, 体表表皮老化, 色素沉着等现象, 预示线虫进入衰老期, 机体内自由基稳态失衡. 因此, 线虫是初步筛选抗衰老药物的首选模型[13].
本文以玛咖为原料, 通过水提法进行提取、 纯化, 以模式生物秀丽隐杆线虫的典型抗氧化指标为标准, 研究玛咖水提物的抗氧化作用功效.
1 材料与方法
1.1 仪 器
电子分析天平(BT25S型, 德国Sartorius公司); 数显恒温水浴锅(HH-4型, 上海比朗仪器有限公司); 高压灭菌锅(日本SANYO公司); 电热鼓风干燥箱(南京实验仪器厂); 高速低温离心机(Centrifuge 58-10R型, 德国Eppendorf公司); 数控超声清洗仪(KQ300DE型, 昆山市超声仪器有限公司); 冻干机(ALPHA2-4型, 德国CHIST公司); 制冰机(SIM-R124型, 日本SANYO公司); 生化培养箱(SHP-160型, 上海三发科技仪器有限公司); 超净工作台(SW-CJ-1FD型, 苏州净化设备有限公司); 光学显微镜(上海精密科学仪器有限公司); 手动移液器(德国Eppendorf公司); 冰箱(BCD-139GY型, 韩国三星/中国海尔公司).
1.2 材 料
缺陷型大肠杆菌(EscherichiacoliOP50); 野生型秀丽隐杆线虫(BristolN2)购自美国Caenorhabditis Genetics Center; 玛咖购自新时代健康产业(集团)有限公司.
1.3 试 剂
胰蛋白胨、 酵母提取物(英国OXOID公司); 无水乙醇、 氯化钙、 氯化钠、 硫酸镁、 磷酸氢二钠、 磷酸二氢钾(分析纯, 北京化工厂); 体积分数为30%的过氧化氢(北京化工厂); 氯化钾、 碳酸氢钠、 琼脂粉(北京鼎国昌盛生物公司); 胆固醇(分析纯, 上海化学试剂公司); 次氯酸钠溶液(天津南开化工厂); 油红O(大连美仑生物技术有限公司).
1.4 方 法
1.4.1 玛咖活性成分提取 将粒径小于60目的玛咖粉末溶于碳酸氢钠溶液, 进行脱油处理后, 置于恒温干燥箱进行干燥脱水. 先称取3.0 g玛咖干粉溶于50 mL水溶液, 搅拌混匀, 再转移至37 ℃恒温培养箱于300 r/min震荡24 h. 将固液混合溶液置于高速冷冻离心机, 于4 000 r/min离心8 min, 取上清液; 提高转速, 再次离心以降低上清液中杂质含量, 于8 000 r/min离心30 min, 取上清液. 将上清液置于广口皿中-80 ℃冰箱冷冻48 h. 待冷冻完全后转移至预冷的冻干机内冻干. 用E.coliOP50菌液(OD600=0.4~0.6)稀释玛咖水提物干粉至终质量浓度为1,2 mg/mL(现用现配); 相同质量浓度E.coliOP50为对照组.
1.4.2 线虫生理指标评估实验 线虫实验均采用同期化的L4期秀丽隐杆线虫, 同期化的卵开始记为0 d, 给药当天根据线虫年龄标记. 待线虫由卵成长至L4期, 进行给药处理, 在正常培养条件下(非压力诱导条件), 线虫在长有E.coliOP50菌膜的线虫培养基(NGM)表面培养, 培养条件为20 ℃恒温孵育. 实验过程中每天转移线虫至新鲜的培养基中, 观察线虫的状态, 记录存活、 死亡及丢失数量, 观察线虫生长状态. 统计结果重复3次以上, 用Prism GraphPad5软件分析.
1) 线虫的生理指标评估. 线虫寿命实验: 每个实验组50只线虫, 每天转移线虫至新鲜的培养基中, 观察线虫的状态, 记录存活、 死亡及丢失数量, 观察线虫生长状态至全部死亡; 线虫产卵量实验: 每个实验组5只线虫, 统计线虫每日产卵数量至线虫不再产卵; 线虫吞咽能力实验: 每个实验组5只线虫, 统计每只线虫每分钟咽部的收缩次数至线虫生命晚期; 线虫运动能力实验: 每个实验组70只线虫, 每天转移线虫至新鲜的培养基中, 观察线虫的运动状态, 将其移动表现划分为具有正常的运动能力, 仅在触碰时有应激运动, 仅在挑虫器触碰条件下有轻微头部运动和死亡4个运动等级[14].
2) 线虫体外热激氧化压力评估. 实验同期化的L4期线虫给药3 d后, 转移至新鲜培养基中; 平板密封, 于35 ℃热激; 每小时均计数统计存活率, 以响应触碰的线虫数与线虫总数的比值表征. 其中爬到侧壁上脱水而死的记为丢失, 不参与统计. 实验重复3次, 每次每组30只线虫.
3) 线虫油红O脂肪染色. 将同期化的对照组和给药组线虫在20 ℃恒温培养箱中培养; 从虫龄第4天起, 收集线虫进行样品固定和染色; 用体积分数为1%的多聚甲醛固定线虫; 先于-80 ℃冰箱冷冻15 min后, 再于43 ℃水浴中迅速解冻; 用M9缓冲溶液(buffer)洗去甲醛; 加入体积分数为60%的异丙醇, 使线虫脱水, 15 min后洗去异丙醇溶液; 加入体积分数为60%的油红O染色30 min; 用M9 buffer反复冲洗6次; 用含体积分数为0.01% Tween的磷酸盐缓冲液(PBS)进行脱色处理; 将线虫转移至NGM平皿表面, 随机挑取15~20只线虫用于脂肪染色观察; 体积分数为2%的琼脂制片, 显微镜下观察并拍照.
1.5 数据统计
实验数据采用Prism GraphPad5软件进行统计分析, Kaplan-Meier方法生成存活曲线. 显著性检验采用Log-rank (Mantel-Cox) Test分析计算, **P<0.01, 表示显著差异; ***P<0.001, 表示极显著差异.
2 结果与分析
2.1 线虫的生理指标评估

图1 玛咖水提物对线虫寿命的影响Fig.1 Effects of water extracts of Maca on lifespan C.elegans
2.1.1 线虫寿命实验 线虫寿命的测定是评价线虫生理状态最直观、 最具参考价值的指标之一, 是衡量线虫生长状态、 外界药物毒性评估的重要参考依据. 本文选用野生型N2线虫进行寿命测定实验, 对照组为OP50组, 梯度给药组为1,2 mg/mL的玛咖水提物, 结果如图1所示. 不同质量浓度玛咖水提物对线虫寿命的影响列于表1. 由图1和表1可见, 不同质量浓度玛咖水提物均可延长线虫的寿命, 其中2 mg/mL玛咖寿命延长效果最显著, 平均寿命提高27.3%. 这种寿命延长作用与对照组相比差异显著, 但并未呈良好的剂量依赖性.

表1 不同质量浓度玛咖水提物对线虫寿命的影响
2.1.2 线虫产卵量实验 线虫产卵量的高低是衡量线虫繁殖能力的参考依据, 也是对其营养、 身体状况进行评价的标准. 图2为1,2 mg/mL玛咖水提物对线虫产卵量的影响. 由图2可见, 玛咖水提物喂食组线虫产卵量呈先增多、 后降低的趋势, 与对照组趋势相同, 其中2 mg/mL组产卵量相对最高. 表2为玛咖水提物喂食线虫日产卵量统计分析结果. 由表2可见, 玛咖高浓度组高于低浓度组和对照组的产卵量, 较对照组平均产卵量增长12.72%, 而1 mg/mL玛咖较对照组平均产卵量增长9.79%. 可见玛咖水提物对线虫产卵量的影响存在浓度依赖性, 且具有一定的促产卵作用.
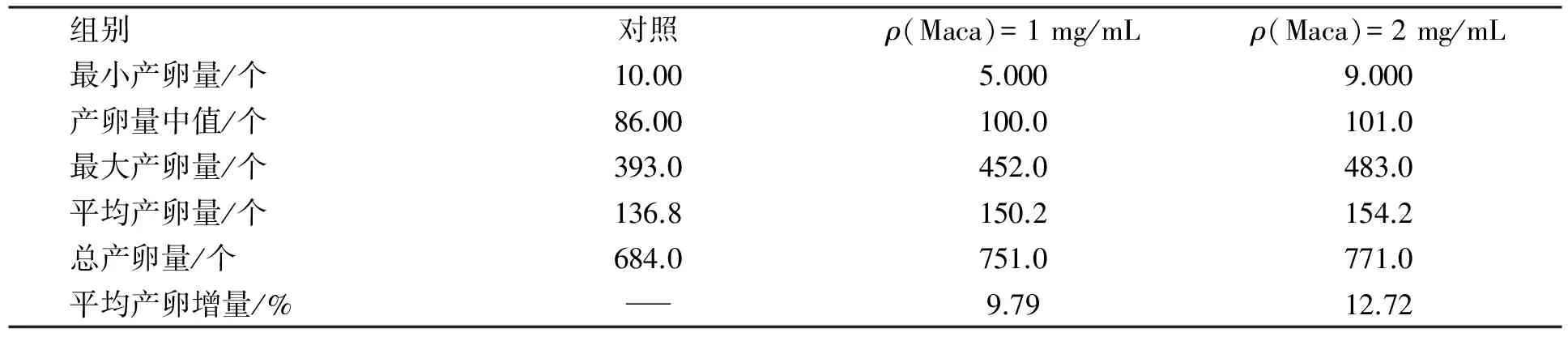
表2 玛咖水提物喂食线虫日产卵量统计分析
2.1.3 线虫吞咽能力实验 线虫吞咽能力是线虫对药物摄取情况的监控, 是判断线虫寿命、 产卵等指标是否由摄入能量不足而导致“热量限制”引起的. 年轻的成虫平均每分钟抽吸250~300次, 随着年龄增长逐渐减慢. 图3为1,2 mg/mL玛咖水提物喂食线虫1~5 d的吞咽率统计结果. 由图3可见, 玛咖水提物喂食组线虫与对照组的吞咽率相比差异较小, 表明玛咖对线虫生理指标的影响不是由热量限制导致的, 而是由药物作用所致.
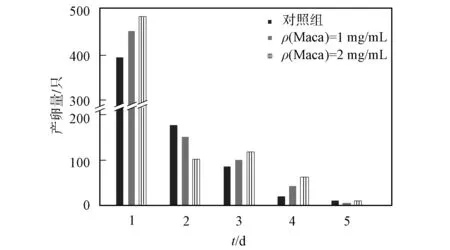
图2 玛咖水提物对线虫产卵量的影响Fig.2 Effects of water extracts of Maca on egg production of C.elegans

图3 玛咖水提物对线虫吞咽率的影响Fig.3 Effects of water extracts of Maca on swallowing rate of C.elegans
2.1.4 线虫运动能力实验 由于外界药物对线虫刺激的状态不同, 因此对线虫运动存在一定影响. 对线虫运动能力评估, 可直观体现线虫处于生命周期的具体时期, 使线虫衰老进程更直观. 图4为不同质量浓度玛咖水提物喂食线虫1~3 d的运动能力统计结果. 由图4可见, 玛咖喂食组线虫2 mg/mL组对线虫运动能力影响较小, 优于对照组.
2.2 线虫热激实验
线虫热激实验是通过给线虫体外热刺激, 诱导线虫体内的应激抵抗反应, 使线虫体内的应激蛋白、 抗热、 耐热蛋白过表达, 从而提高自身耐受能力. 线虫热激实验可直观衡量在药物保护作用下线虫抵抗不良热环境的能力, 并衡量药物对热刺激导致体内自由基大量产生的保护作用. 图5为不同质量浓度玛咖水提物喂食线虫抗热激能力诱导的统计结果. 水提物通过Log-rank (Mantel-Cox) Test分析计算表明, 喂食组与对照组无显著差异(P>0.05).

a. 对照组; b. ρ(Maca)=1 mg/mL组;c. ρ(Maca)=2 mg/mL组.图4 不同质量浓度玛咖水提物对线虫运动能力的影响Fig.4 Effects of different mass concentrations of water extracts of Maca on motor ability of C.elegans

图5 玛咖水提物对热激氧化压力下线虫的保护作用Fig.5 Protective effects of water extracts of Maca on C.elegans under hot-oxidative stress
2.3 线虫油红O染色实验
线虫个体微小, 全身透明, 通过油红O染色法对线虫进行脂肪染色, 可评价线虫体内脂肪累积效果及脂代谢效果. 图6为不同质量浓度的玛咖水提物对线虫脂肪堆积的影响. 由图6可见, 喂食玛咖水提物的线虫其油红O脂肪染色程度较浅. 图7为油红O染色线虫脂肪的统计结果. 由图7可见, 在相同实验条件下, 玛咖水提物对线虫有一定的降脂作用.

图6 玛咖水提物对线虫脂肪堆积的影响Fig.6 Effects of water extracts of Maca on fat accumulation of C.elegans

a. 对照组; b. ρ(Maca)=1 mg/mL组; c. ρ(Maca)=2 mg/mL组.图7 油红O染色线虫脂肪的统计结果Fig.7 Statistical results of oil red O staining for fat of C.elegans
综上, 本文以天然植物玛咖为原料, 经水提工艺提取, 以秀丽隐杆线虫为模型研究了玛咖的作用功效. 通过对线虫寿命、 产卵量、 吞咽能力、 运动能力评估, 确定玛咖水提物存在显著延长线虫寿命的作用, 数据具有统计学意义, 且玛咖对线虫毒性作用较低, 不影响线虫的正常生理功能和生命活动. 本文结果可为玛咖在医疗保健领域的进一步开发应用提供重要参考价值及新思路.
[1] 许敏, 徐丽, 宋晖, 等. 玛咖的研究进展 [J]. 食品安全质量检测学报, 2015, 6(7): 2775-2782. (XU Min, XU Li, SONG Hui, et al. Research Advances on Maca [J]. Journal of Food Safety and Quality, 2015, 6(7): 2775-2782.)
[2] Smolinska B, Szczodrowska A, Leszczynska J. Protein Changes inLepidiumsativumL.Exposed to Hg during Soil Phytoremediation [J]. Int J Phytoremediation, 2017, 19(8): 765-773.
[3] Smolinska B, Leszczynska J. Photosynthetic Pigments and Peroxidase Activity ofLepidiumsativum, L.during Assisted Hg Phytoextraction [J]. Environmental Science & Pollution Research, 2017, 24: 1-10.
[4] Emhofer L, Himmelsbach M, Buchberger W, et al. HPLC-MS Analysis of the Parent Drugs and Their Metabolites in Extracts from Cress (Lepidiumsativum) Grown Hydroponically in Water Containing Four Non-steroidal Anti-inflammatory Drugs [J]. Journal of Chromatography A, 2017, 1491: 137-144.
[5] 沈维治, 邹宇晓, 林光月, 等. 玛咖抗疲劳作用及活性组分研究 [J]. 食品与生物技术学报, 2014, 33(7): 721-726. (SHEN Weizhi, ZOU Yuxiao, LIN Guangyue, et al. Bioactive Constituents and Anti-fatigue EffectsinvivoofLepidiummeyenii(Maca) [J]. Journal of Food Science and Biotechnology, 2014, 33(7): 721-726.)
[6] 艾中, 程爱芳, 孟际勇, 等. 国产玛咖芥子油苷的组分分析和含量测定 [J]. 食品科技, 2012, 37(4): 182-186. (AI Zhong, CHENG Aifang, MENG Jiyong, et al. Analysis of Chemical Components and Content of Glucosinolate from Domestic Maca [J]. Food Science and Technology, 2012, 37(4): 182-186.)
[7] WANG Sijian, SHI Pingping, QU Lu, et al. Bioactive Constituents Obtained from the Seeds ofLepidiumapetalumWilld [J]. Molecules, 2017, 22(4): 1-11.
[8] ZHOU Yanyan, PENG Li, Brantner A, et al. Chemical Profiling Analysis of Maca Using UHPLC-ESI-Orbitrap MS Coupled with UHPLC-ESI-QqQ MS and the Neuroprotective Study on Its Active Ingredients [J]. Scientific Reports, 2017, 7: 44660.
[9] 杨晓飞. 玛咖有效成分提取工艺设计 [D]. 济南: 山东师范大学, 2015. (YANG Xiaofei. The Design of Extraction Process of Active Ingredients in Maca [D]. Jinan: Shandong Normal University, 2015.)
[10] 蒋寒林. 外来物种玛咖主要化学成分研究 [D]. 广州: 华南理工大学, 2014. (JIANG Hanlin. Study on the Chemical Compositions in Alien Species of Maca [D]. Guangzhou: South China University of Technology, 2014.)
[11] 杜萍, 杨敏, 朱艳琴, 等. 云南玛咖中功能性成分的分析研究 [J]. 食品工业科技, 2016, 37(16): 71-75. (DU Ping, YANG Min, ZHU Yanqin, et al. Analysis of the Functional Constituent in Maca (Lepdiummeyenii) from Yunnan [J]. Science and Technology of Food Industry, 2016, 37(16): 71-75.)
[12] 郭佑铭. 以秀丽隐杆线虫为模型的铃兰毒甙抗衰老研究 [D]. 长春: 吉林大学, 2014. (GUO Youming. Study on the Anti-aging Molecular Mechanisms of Convallatoxin inCaenorhabditiselegans[D]. Changchun: Jilin University, 2014.)
[13] WEN Hui, GAO Xinghua, QIN Jianhua. Probing the Anti-aging Role of Polydatin inCaenorhabditiseleganson a Chip [J]. Integr Biol (Camb), 2014, 6(1): 35-43.
[14] 徐佳. 碳点作为荧光探针在线虫中应用研究 [D]. 长春: 吉林大学, 2016. (XU Jia. Study on the Application of Carbon Dots as Fluorescent Probes inC.elegans[D]. Changchun: Jilin University, 2016.)

