幽门螺杆菌在慢性阻塞性肺疾病发生及发展过程中的作用
刘静叶
浙江省舟山医院,浙江 舟山 316100
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是一种以持续气流受限为主要临床特征的慢性气道炎症性疾病,具有较高的发病率和致残率。COPD病情发展可导致患者肺功能进行性恶化甚至死亡。但由于目前COPD的许多关键发病机制尚未完全明确,当前治疗药物仍难以有效延缓COPD患者肺功能下降而改善其预后[1]。研究表明,COPD的发展和预后与免疫功能水平密切相关[2]。而微生物感染对宿主肺的免疫稳态起关键作用[3-4]。幽门螺杆菌(Helicobacterpylori,H.pylori)感染是慢性胃炎、消化性溃疡、胃组织淋巴瘤及胃癌等多种消化道疾病的重要致病因素。近年来有研究发现,COPD患者具有较高的H.pylori感染率,因此推测H.pylori感染可能与COPD的发病机理有关[5-6]。现有的相关研究多以探讨H.pylori与COPD的关系为主,本研究在此基础上分析了H.pylori感染对COPD患者免疫功能的影响,旨在进一步探讨H.pylori在COPD发生及发展中的作用。
1 对象与方法
1.1一般资料 选择2015年2月至2016年12月我院收治的COPD患者85例作为研究对象(COPD组),其中男性56例,女性29例;年龄48~83岁,平均年龄(61.1±10.3)岁。COPD诊断标准参照中华医学会2013年修订的《慢性阻塞性肺疾病诊治指南》[7],均经肺功能检查明确气流受限,且半年内未曾应用支气管舒张剂、激素及茶碱等药物治疗。排除合并肝肾功能不全、心脏病、变态反应性疾病、肿瘤等,并经胸部X线检查排除支气管扩张、肺结核、弥漫性泛细支气管炎、肺癌等其他肺部疾病;同时排除消化性溃疡、消化道出血、胃癌等胃肠道疾病。根据第1秒用力呼气容积占预计值百分比(FEV1%预计值)对85例COPD患者进行严重程度分级,其中Ⅰ级(FEV1%预计值≥80%)23例,Ⅱ级(50%≤FEV1%预计值<80%)34例,Ⅲ级(30%≤FEV1%预计值<50%)18例,Ⅳ级(FEV1%预计值<30%)10例。另选同期体检健康的志愿者85例作为对照组,其中男性50例,女性35例;年龄45~78岁,平均年龄(59.6±9.7)岁;均无呼吸系统疾病和消化性溃疡史。COPD组与对照组的一般资料差异无统计学意义(P>0.05)。

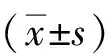
2 结 果
2.1两组患者H.pylori阳性率及血清抗Hp-IgG水平比较 COPD组患者血清抗Hp-IgG水平为(18.30±5.25)u/mL,对照组为(11.21±4.80)u/mL,二者差异有统计学意义(t=9.1890,P=0.0000)。COPD组确认感染H.pylori54例(63.53%),对照组确认感染H.pylori33例(38.82%),COPD组的H.pylori阳性率明显高于对照组(χ2=10.3822,P=0.0013)。
2.2血清抗Hp-IgG水平与COPD严重程度的相关性 不同COPD分级之间的抗Hp-IgG水平(F=47.8082,P=0.0000)和FEV1%预计值(F= 421.3811,P=0.0000)差异均有统计学意义。分级越高,抗Hp-IgG水平越高,FEV1%预计值越低(见表2);相关性分析结果显示,FEV1%预计值与血清抗Hp-IgG水平呈负相关(r=-0.733,P=0.0000)(见图1)。

表2 不同COPD分级间患者FEV1%预计值及抗Hp-IgG水平比较
注:a:与Ⅰ级相比,t=12.5824、29.8956、64.3561、3.7722、6.8674、11.9017,P<0.05;b:与Ⅱ级相比,t=13.9993、20.6516、3.4114、7.7770,P<0.05;c:与Ⅲ级相比,t=7.8741、3.8628,P<0.05。

图1 COPD患者FEV1%预计值与血清抗Hp-IgG水平散点图



表3 不同H.pylori感染情况COPD患者间免疫功能比较

图2 不同H.pylori感染情况COPD患者T细胞亚群流式图
3 讨 论
3.1COPD的危害及防治意义 COPD是呼吸系统的常见病和多发病,严重危害人类健康,并影响患者的生命质量,给患者及其家庭和社会带来沉重的经济负担。目前COPD的治疗以改善症状为主,对于急性加重期患者肺功能进行性恶化的延缓效果有限,导致病情较重患者的病死率居高不下[8]。因此,了解COPD的发病机制及其潜在的危险因素对于COPD的早期防治具有重要意义。

表4 H.pylori根除治疗前后COPD患者免疫功能变化

图3 H.pylori根除治疗前后COPD患者T细胞亚群流式图
3.2H.pylori感染与COPD发生及发展的关系 COPD的发病主要与肺内感染、氧化应激、肺组织蛋白酶—抗蛋白酶失衡及自主神经功能失调等机制有关[9]。“多点击”假说认为多种炎症刺激在COPD的发病过程中起重要作用[10]。而H.pylori与胃肠外多种疾病之间的联系正是以系统炎性介质的激活及/或诱导自身免疫反应为特征[11]。H.pylori血清学检测阳性者,尤其是细胞毒素相关基因A(CagA)-Hp阳性者,变态反应性疾病的发生率较低,但COPD及其他慢性支气管疾病的发病率明显增加[12]。本研究结果显示,COPD患者的血清抗Hp-IgG水平及阳性率明显高于健康者,提示H.pylori感染与COPD的发生有关。因COPD患者长期处于慢性缺氧和CO2潴留状态,导致其胃黏膜缺氧性受损,利于H.pylori定植感染;另外COPD的治疗药物如激素、茶碱等也可对胃黏膜造成损伤,为H.pylori感染创造了条件[13-14]。本研究中,不同严重程度的COPD患者之间,FEV1%预计值越低,血清抗Hp-IgG水平越高,FEV1%预计值与血清抗Hp-IgG水平为负相关关系,说明H.pylori感染与COPD的病情发展密切相关。
3.3COPD发展及预后与患者免疫功能的关系 COPD的发展及预后与患者的肺功能有关。而研究表明,免疫功能障碍可导致COPD患者病情加重,肺功能降低;经免疫干预后,患者的病情及生活质量明显改善[15-16]。提示免疫功能状态对COPD发展及预后的评估具有一定的临床意义。为进一步探讨H.pylori在COPD病理过程中的作用,本研究就H.pylori感染对COPD患者免疫功能的影响进行了分析。研究结果显示,与无H.pylori感染的(抗Hp-IgG阴性)COPD患者比,合并H.pylori感染的COPD患者的外周血T淋巴细胞亚群改变明显,血清免疫球蛋白水平显著降低,机体免疫功能均下降;经H.pylori根除治疗后,各项免疫指标均明显改善,说明H.pylori感染可能通过影响机体免疫稳态,促进COPD病情进展。H.pylori参与COPD病理过程的可能机制[13,17-18]:由于呼吸道与消化道毗邻,感染H.pylori后胃黏膜屏障功能受损,诱发局部炎症,释放的炎症因子通过血液循环进入肺组织,引起支气管肺上皮细胞损伤,导致支气管黏膜的慢性非特异性炎症反应;多种炎症介质刺激可诱导T淋巴细胞免疫与体液免疫发生紊乱,免疫力下降,从而进一步诱导COPD进行性加重。
综上所述,H.pylori感染可导致宿主免疫功能下降,在促进COPD的发生和发展中具有重要作用。当COPD患者伴有消化不良等胃肠功能紊乱症状时应考虑H.pylori感染的可能性,明确H.pylori感染后,在COPD常规治疗的基础上给予H.pylori根除治疗可有效改善患者免疫功能,有利于肺功能改善,从而延缓病情进展。
[1] CHEN Xueang, LI Suyun, WANG Minghang, et al. Research progress on prognosis factors of acute exacerbation chronic obstructive pulmonary disease[J]. Chin Arch Tradit Chin Med, 2017, 35(4): 799-802. (in Chinese)
陈学昂, 李素云, 王明航, 等. 慢性阻塞性肺疾病急性加重期预后影响因素的研究进展[J]. 中华中医药学刊, 2017, 35(4): 799-802.
[2]WANG Haiyan, GAO Zhongying, CHEN Shaojun, et al. Effect of reinforcing lung and removing blood stasis method on the quality of life and pulmonary function in patients with stable chronic obstructive pulmonary disease[J]. Beijing J Trad Chin Med, 2015, 34(12): 939-942. (in Chinese)
王海燕, 高忠英, 陈少军, 等. 补肺化瘀法对慢性阻塞性肺疾病稳定期患者生活质量及肺功能的影响[J]. 北京中医药, 2015, 34(12): 939-942.
[3]石春卫, 陈毅秋, 胡静涛, 等. 肠道微生物群对宿主免疫系统发育和功能的调节[J]. 中国免疫学杂志, 2016, 32(10): 1536-1540.
[4]HUANG Huijuan, ZHONG Xiaoning. Chronic obstructive pulmonary disease and autoimmunity[J]. Int J Respir, 2010, 30(19): 1165-1168. (in Chinese)
黄惠娟, 钟小宁. 慢性阻塞性肺疾病与自身免疫[J]. 国际呼吸杂志, 2010, 30(19): 1165-1168.
[5]蔡树冰. 幽门螺杆菌感染与慢性阻塞性肺疾病的相关性[J]. 广东医学, 2016, 37(s1): 117-118.
[6]HOU Junrong, CHI Liying. Analysis of infection status ofHelicobacterpyloriand risk with COPD[J]. J Hainan Med Univ, 2014, 20(08): 1064-1066+1070. (in Chinese)
侯俊荣, 池丽英. 慢性阻塞性肺病幽门螺杆菌感染状况及其致病危险性分析[J]. 海南医学院学报, 2014, 20(8): 1064-1066+1070.
[7]中华医学会呼吸病学分会慢性阻塞性肺疾病学组. 慢性阻塞性肺疾病诊治指南(2013年修订版)[J]. 中华结核和呼吸杂志, 2013, 36(4): 484-491.
[8]杨华. 慢性阻塞性肺疾病的免疫治疗研究进展[J]. 山东医药, 2014, 54(45): 104-106.
[9]Malhotra R, Olsson H. Immunology, genetics and microbiota in the COPD pathophysiology: Potential scope for patient stratification[J]. Expert Rev Respir Med, 2015, 9(2): 153-159.
[10] Pavord ID, Birring SS, Berry M, et al. Multiple inflammatory hits and the pathogenesis of severe airway disease[J]. Eur Respirat J, 2006, 27(5): 884-888.
[11] Roubaud Baudron C, Franceschi F, Salles N, et al. Extragastric diseases andHelicobacterpylori[J]. Helicobacter, 2013, 18(s1): 44.
[12] Sze MA, Chen YW, Tam S, et al. The relationship betweenHelicobacterpyloriseropositivity and COPD[J]. Thorax, 2015, 50(3): 544-545.
[13] YU Tian, HU Ling, CHEN Xia, et al. The Relationship between HP Infection and COPD[J]. Sichuan Med J, 2015, 36(2): 195-198. (in Chinese)
余阗, 胡玲, 陈霞, 等. 幽门螺杆菌感染与慢性阻塞性肺疾病关系探讨[J]. 四川医学, 2015, 36(2): 195-198.
[14] ZHANG Weihong, YANG Hongjuan, LIU Zhuola. Explore the relationship ofHelicobacterpyloriinfection and chronic obstructive pulmonary disease[J]. Int J Respir, 2014, 34(9): 652-654. (in Chinese)
张卫红, 杨红娟, 刘卓拉. 幽门螺杆菌感染与慢性阻塞性肺疾病关系的研究[J]. 国际呼吸杂志, 2014, 34(9): 652-654.
[15] CHEN Changzhi, SHAO Youhe, QIN Jiameng, et al. Relationship between the expression of immune globulin and lung function in patients with chronic obstruc-tive pulmonary disease[J]. J Clinl Pulm Med, 2015, 20(8): 1404-1406. (in Chinese)
陈昌枝, 邵有和, 覃家盟, 等. 慢性阻塞性肺疾病患者免疫球蛋白的表达及与肺功能的关系[J]. 临床肺科杂志, 2015, 20(8): 1404-1406.
[16] GAN Lixing, WANG Jian. Influence of immunological intervention on immunological functions and QOL in acute exacerbation period of patients with COPD[J]. J Clin Med Pract, 2015, 19(9): 35-37. (in Chinese)
甘丽杏, 王健. 免疫干预对慢性阻塞性肺疾病患者急性加重期免疫功能及生活质量的影响[J]. 实用临床医药杂志, 2015, 19(9): 35-37.
[17] Hollander WJD, Holster IL, Duijts L, et al. 16 MaternalHelicobacterpylori, colonization is not associated with asthma symptoms, airway inflammation and airway resistance in their children until the age of 6 years: The generation R study[J]. Gastroenterology, 2013, 144(5): S5.
[18] 郭式敦, 蒋庆贺. 慢性阻塞性肺疾病的发病机制及治疗-COPD的炎症机制[J]. 山东医药, 2010, 50(27): 106-107.

