小反刍兽疫检测技术研究进展
李园丽, 李 林, 樊晓旭, 吴晓东, 王志亮, 潘树德
(1.沈阳农业大学 畜牧兽医学院, 辽宁 沈阳 110866 ;2.中国动物卫生与流行病学中心 国家外来动物疫病研究中心, 山东 青岛 266032)
小反刍兽疫(Peste des petits ruminants,PPR)是由小反刍兽疫病毒(Peste des petits ruminants virus,PPRV)引起的一种急性病毒性传染病,主要感染山羊和绵羊。 该病一年四季均可发生,易感羊群的发病率和死亡率最高可达90%以上。 PPR 于1942 年首次报道以来[1],在非洲的大部分国家,中东、南亚以及包括中国在内的部分亚洲国家都形成地方性流行,直接制约着养羊业发展和羊肉的有效供给,对食品安全和人类健康构成严重威胁。 世界动物卫生组织(OIE)将其列为法定报告的疫病,各国无疫状态需经OIE 官方认证。 我国农业部将其列为一类动物疫病,《国家中长期动物疫病防治规划(2012—2020 年)》将其列为重点防范的13 种外来动物疫病之一。 在早期的实验室诊断中,主要依靠琼脂凝胶免疫扩散(AGID)、对流免疫电泳(CIE)和免疫捕获ELISA 等常规技术,这些技术大多费时费力,灵敏度不高,不能特异性的鉴别诊断PPR。 随着技术的不断进步,PCR、Real-time PCR、重组酶聚合酶技术(Recombinase polymerase amplification,RPA)和多种ELISA 方法等高灵敏度、高特异性和高通量的检测技术不断应用于PPR 的检测,为该病的控制和消灭提供了有利条件。
1 病毒的分离培养
病毒的分离培养通常采集病畜的眼结膜、鼻腔、口腔及回肠、直肠黏膜等部位的分泌物棉拭子,或者采集血液标本,也可剖检采集淋巴结、扁桃腺、脾、肺、大肠等组织块,然后用原代绵羊或者山羊胎肾细胞、新生羊睾丸细胞或非洲绿猴肾(Vero)细胞对病毒进行分离培养。 PPRV 接种细胞后的5 ~6 d会产生细胞病变(CPE),其特点是出现多核细胞,有的出现核内包涵体,部分细胞形成空泡[2]。 2006 年Sreenivasa 等研究发现,利用E -B 病毒改造过的狨猴B 淋巴细胞衍生系MarmosetB95a 细胞更利于PPRV 的繁殖和分离。 随后由猴源CV1 细胞改造的CHS-20 细胞系也被开发出来,能够高效分离病原样品中的PPRV,能稳定表达山羊SLAM 蛋白[3]。使用该方法鉴定比较准确,但费时费力、操作繁琐,需要专业的细胞培养设备,不能作为常规的诊断方法。
2 病毒抗原检测
在早期的PPRV 临床诊断和剖检过程中,琼脂凝胶免疫扩散(AGID)和对流免疫电泳(CIE)被广泛应用。 AGID 操作简单,其成本低,不需要昂贵的仪器,对实验环境要求不高,24 h 内可获得结果,在野外和一般的实验室均能操作。 CIE 是最快的病毒抗原检测方法,与AGID 相比较,CIE 明显提高了诊断速度,并且具有较高的敏感性,可作为PPRV 临床检测的筛选试验方法。 但CIE 特异性较差,不能有效区分牛瘟病毒(RPV)和PPRV[4]。
当PPRV 抗原含量较低时,上述两种方法不易将抗原检测出来,而且所需时间相对较长。 因此需要更灵敏的方法所替代。
基于N 蛋白的单克隆抗体建立的免疫捕获ELISA 具有较高的灵敏性和特异性,在室温存放一周的感染细胞上清液中的N 蛋白仍能被检测出来[5]。 该方法能够有效检测PPRV,适合田间样品的常规检测。 同样是基于N 蛋白单克隆抗体建立的夹心ELISA(s-ELISA)检测方法,也具有较高的灵敏性和特异性,与Vero 细胞病毒分离相比,s -ELISA 具有更高的灵敏性(71. 9%比65. 2%;P <0.05)。 与免疫捕获ELISA 相比,这种s -ELISA 的灵敏度和特异性分别为88.9%和92.8%,比较适用于田间检测[6]。
此外,基于抗PPRV 的M 蛋白和N 蛋白的单克隆抗体建立的斑点ELISA(dot -ELISA),10 min 即可用肉眼直接观察检测结果。 与s -ELISA 方法相比,该方法的灵敏性和特异性分别为82. 5% 和91%[7]。 该方法在大规模的野外或现场流行病学调查过程中,能够高效的筛选出可能感染PPRV 的临床样品。
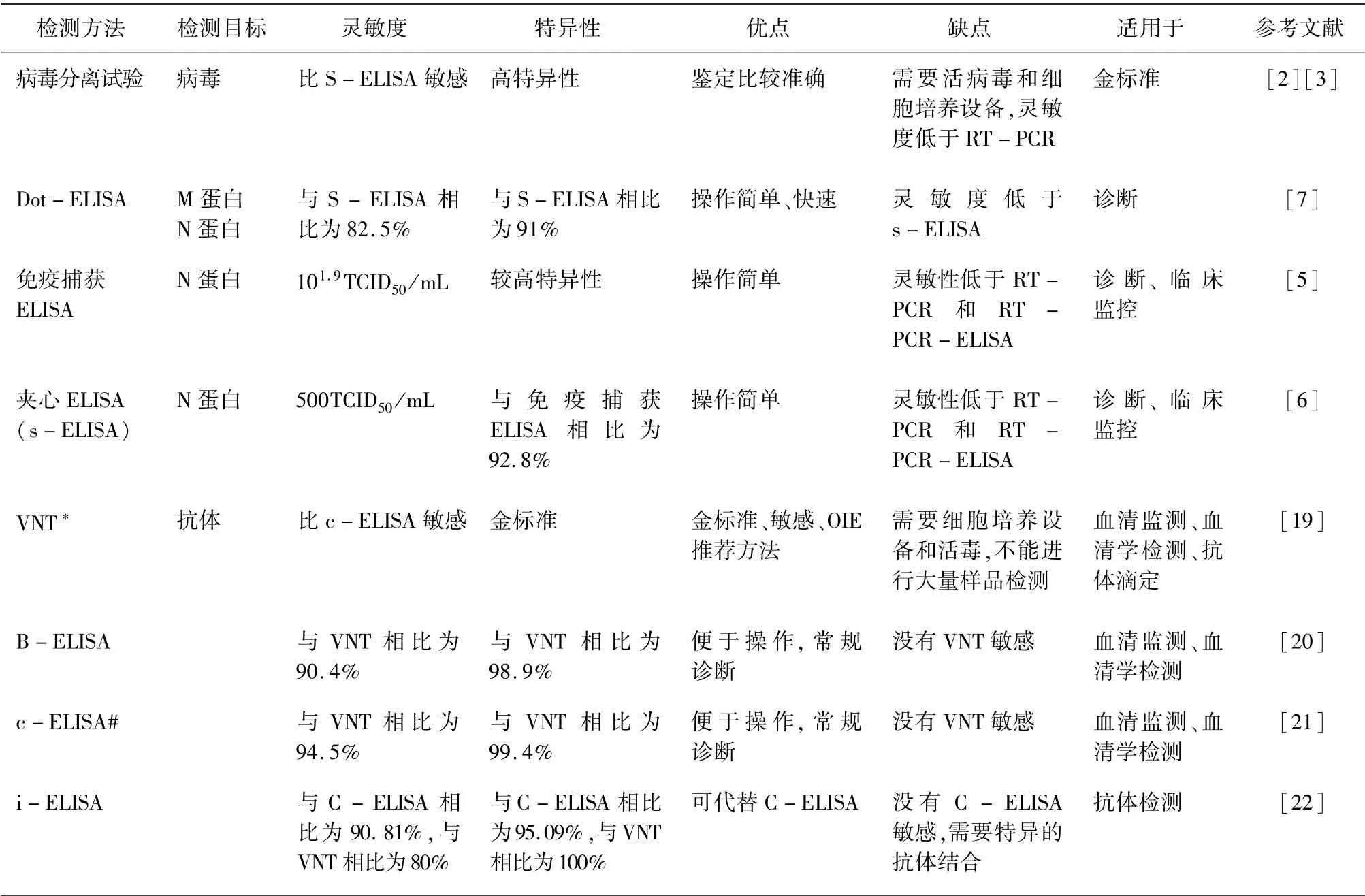
表1 PPRV 抗原和抗体检测方法
3 病毒核酸检测
随着分子生物学技术的发展,建立了一系列针对病毒核酸进行检测的方法(表2)。 这些方法简便快捷,具有较高的灵敏度和特异性,能够进行高通量检测,其中以RT-PCR 方法应用最为广泛。
3.1 RT -PCR 和实时荧光RT -PCR Forsyth 等针对PPRV 的F 基因首次建立了RT -PCR 的检测方法[8]。 随后,针对N 基因建立的RT -PCR 方法是常规病毒滴定法的1 000 倍[9]。 但该方法属于两步法RT-PCR,逆转录和PCR 反应分别在不同的管子中进行,在样品转移过程中易造成污染而呈现假阳性。 随后,对两步法RT -PCR 进行改进,建立了更精准的一步法多重RT -PCR[10]。 利用单管同时扩增,当样品为PPRV 阳性时可同时扩增出N 基因上的一个337 bp 片段和M 基因上的一个191 bp 片段,当RPV 为阳性时只能扩增出N 基因的337 bp片段,由于片段的差异,可以通过1.5%琼脂凝胶电泳或酶切进行区分。 该方法可检测到100 fg 的PPRVRNA。 与夹心ELISA 相比,一步法多重RT -PCR 能够在临床样品中对PPRV 和RPV 进行快速鉴别诊断,提高了检测灵敏度,降低了假阳性。 与两步法RT-PCR 相比,一步法所有反应都在单管内完成,从而简化了操作步骤,减少了污染。
无论是一步RT-PCR 还是两步RT-PCR 的灵敏度和特异性都较高,而且所需时间也相对较短,但是其工作量较大,PCR 产物需经凝胶电泳拍照,存在较高污染的可能性等缺点,不适合PPR 的高通量检测。 近年来,随着分子生物学的发展,针对PPRV 的N 基因和M 基因设计的SYBR Green 和TaqMan 探针建立了Real time RT -PCR[11-13]。 该方法可以在一个封闭的系统中完成病毒RNA 的反转录、扩增和分析的过程,避免了普通RT -PCR 的污染问题。 该方法不仅可以进行病毒的定性分析,还可以对模板RNA 进行定量,具有高度的敏感性和特异性。 其自动化程度较高,提高了检测效率。 实时荧光RT-PCR 具有较高的特异性、灵敏度、可重复性和扩增效率,在常规检测中广泛应用。
3.2 RT-PCR-ELISA RT-PCR-ELISA 是将RT-PCR 和夹心ELISA 相结合,基于PPRV 的N 基因建立的检测方法[14]。 该方法先通过RT -PCR 产生一个用地高辛标记的336 bp 扩增产物,然后再用ELISA 方法进行检测扩增产物。 该方法可检测PPRV的早期和晚期病毒,比传统的琼脂糖凝胶电泳分析的RT-PCR 方法灵敏10 000 倍。 在临床试验中,该方法与传统的夹心ELISA 方法相比,阳性率分别为66.2%和48.6%,同时可以鉴别诊断PPRV 和RPV。
3.3 RT-LAMP 基于PPRV 的M 基因和N 基因建立了RT -LIMP 检测方法[15-16]。 该方法在恒温条件下,通过BstDNA 聚合酶、反转录酶和6 条特异性引物的作用进行目的核酸片段的大量扩增。 该方法的灵敏性比普通RT - PCR 高10 倍,与荧光RT-PCR 的灵敏度相当。 其特异性较高,只能特异性的检测目的病毒,与其他同属的病毒或类似病毒无交叉反应。 该方法的耗费低,不需要昂贵的仪器设备,反应迅速,其反应结果易于观察,由于在检测前加入荧光指示试剂,检测结果可以直接用肉眼判断。 可以满足现场检测的需求,具有较高的实际应用价值。 但其实验设计复杂,读取结果主观性强。
3.4 纳米金标记核酸探针 针对PPRV 的N 基因的高度保守区设计两条特异寡核苷酸探针建立了纳米金检测方法[17]。 一条探针5′端修饰生物素,另一条探针3′端修饰巯基。 巯基化的探针通过Au-S键连接到纳米金颗粒上。 靶核酸两端分别与两条探针结合,形成“生物素化探针-靶核酸-纳米金探针”复合物,该复合物通过生物素-亲和素系统,固定在固相载体上,最后银染放大信号。 通过肉眼观察法、光镜观察法、分光光度法分析银染灰度,从而间接测定靶核酸的量。 初步检测PPRV 核酸最低浓度达10 fmol/L,所需时间约为1.5 h。 该方法灵敏度高、操作简单,可以为临床检测PPRV 核酸提供实验数据和技术支持。
3.5 重组酶聚合酶扩增(RPA) 利用PPRV 的N基因建立了Real -time RT -RPA 和LFS RT -RPA检测方法[18]。 Real -time RT -RPA 在40 ℃条件下,可检出的最低浓度为100 拷贝,检测时间不超过7 min;LFS RT -RPA 在39 ℃条件下25 min 内,可检出的最低浓度为150 拷贝。 两种方法的特异性较强,与羊痘、口蹄疫和羊口疮病毒均无交叉反应,其灵敏性与RT-PCR 相当。 RPA 相对现有的检测技术操作简单、不易污染、便携、快速、灵敏性和特异性强,有望应用于床旁和现场检测。

表2 PPRV 核酸检测方法
4 病毒抗体检测
PPRV 的抗原和核酸检测已经被广泛应用于疫情检测和日常监测。 但是,大多数的抗原和核酸检测方法只能应用于疾病感染后4 ~17 d,而且还要小心运输和保存抗原及核酸样品。 与之相对比,抗体检测(表1)可在易感动物感染PPRV 或接种疫苗产生抗体后的很长时间里持续的检测(至少在接种后的3 年内)。 在病毒检测中,病毒中和试验(VNT)依旧是金标准,是国际贸易中指定的PPRV 检测方法[19]。 VNT 灵敏度高、特异性强,但其耗费时间较长,一般需要10 ~12 d,最短也要7 d才能得到结果,劳动强度大,很难实现大规模样品的检测。
Saliki 等利用2 个抗H 基因的特异性单克隆抗体(MAb)建立了阻断ELISA(b - ELISA)[20]。 b -ELISA 相对于VNT 的敏感性和特异性分别为90.4%和98.9%,两种检测方法的总体复合系数(n=253)为0.91。 b -ELISA 和终点滴定VNT 的相关系数较高(n =57),两种方法的相关性较高(R2≥0.98)。 b-ELISA 和VNT 的灵敏性和特异性接近但更简便快捷,可以替代VNT 用于羊群免疫状态的评估和流行病学检测。 Libeau 等从大量培养的昆虫细胞表达PPR N 蛋白的重组杆状病毒中获取了重组N 蛋白,建立了竞争ELISA(c -ELISA)[21]。c- ELISA 和VNT 的滴度表现出很好的相关性(R2≥0.94)。 与VNT 相比,c -ELISA 的敏感性和特异性分别为94.5%和99.4%。 该方法相对于传统的VNT,更加的方便快捷,可以进行大批量检测。被世界动物卫生组织(OIE)指定为PPR 标准检测方法之一。 Ismail 等从大量培养的昆虫细胞和幼虫表达PPR N 蛋白的重组杆状病毒中获取了重组N 蛋白,建立了间接ELISA(i -ELISA)。 该方法相对于c - ELISA 的特异性和灵敏度分别为95. 09% 和90.81%,达到VNT 的100%和80%[22]。 在应用血清学方法进行流行病学调查时,i -ELISA 可以有效的替代c-ELISA。
5 小结
OIE 出版的《陆生动物诊断试验和疫苗手册》中第2.7.10 章列出了当前可用于PPR 的诊断方法类型,并给出了每种方法的适用范围。 根据检测目的不同,给出了推荐方法、适用方法和可用方法。群体或个体无感染推荐使用病毒中和方法,竞争ELISA 也适用;临床病例确诊推荐使用普通RT -PCR、Real -time PCR 和免疫捕获ELISA 3 种检测方法,适用病毒分离,可用琼脂凝胶免疫扩散和对流免疫电泳进行检测;流行率的监测推荐使用竞争ELISA 和病毒中和进行检测;个体或群体接种疫苗后的免疫状况推荐使用竞争ELISA 和病毒中和检测方法,可用琼脂凝胶免疫扩散检测。 并不是所有推荐方法和适用方法都经过了正式的标准化和验证,它们日常的性质和已被广泛使用而无可疑结果的事实,使得这些方法可被接受。 可用方法是指在某种情况下可以使用,但其成本、可靠性或其他因素限制其应用。
综上所述,具有快速、特异、灵敏和高通量等特性的RT -PCR、荧光RT -PCR 以及多种ELISA 等检测技术将成为PPR 的常用检测方法。 另外,实验操作相对简单、耗时短、无需昂贵的仪器、可应用于野外和现场快速检测的技术(如RPA)也将得到广泛应用,这些技术将会为PPR 的监测和防控提供技术支持。

