城市污水厂MCR-1基因及其携带菌的污染
马 奔,黄雅梦,王若楠,王新宇,曹振华,张 媛,张青云,徐炳乾,袁青彬 (南京工业大学环境科学与工程学院,江苏 南京 211816)
近年来,随着医疗和养殖等行业的快速发展,抗生素的滥用也愈加普遍.我国抗生素生产与使用数量均居世界前列,抗生素的滥用和污染相当严重.据统计我国抗生素人均消费达138g/a,远高于欧美发达国家,养殖业也长期存在抗生素滥用现象[1].抗生素的过量使用导致环境中细菌抗药性快速产生和发展,多种抗性基因在我国很多河流、沉积物、饮用水甚至空气中被检出[2-5].其易传播、难消除的特点可能产生严峻的生态环境风险,也成为水处理过程中新的难题.石娜等研究发现,低于 1000W 剂量的可见光+紫外辐照很难影响耐环丙沙星细菌的耐药性[6].
城市污水处理厂广泛接纳各类废水,成为环境中抗性基因及其携带菌的重要储存库.已在我国乃至世界范围内众多污水厂检出多种抗性基因[7-8].污水处理过程难以彻底去除抗性基因及其携带菌,甚至会促进抗性基因的传播和造成细菌耐受抗生素水平的增强[8-10].
2015 年底,我国学者从患者和动物体内发现了耐粘菌素细菌而受到广泛关注,粘菌素被认为是对抗多重抗性细菌的“最后一道防线”.分析发现其都携带了一种新的耐粘菌素基因 MCR-1.随后在抽检我国 5省 804头牲畜中,发现其中 21%携带MCR-1[11].目前,已有超过30个国家陆续检出该基因[12-15].MCR-1基因位于质粒,可很容易地传递到其他细菌.携带 MCR-1的大肠杆菌不仅对粘菌素具有抗性,通常还对多种其他抗生素表现耐药性.然而当前对于 MCR-1基因的研究主要集中在动物体内和临床领域,在环境中研究非常稀少.
本文以南京某城市污水处理厂为研究对象,考察了 MCR-1和 MCR-1携带菌的污染特征,包括分布特征及其影响因素,进而探索了MCR-1携带菌对粘菌素的耐药特征及其随污水处理流程的变化.本研究可为评价污水中超级抗性细菌及其基因的环境风险提供参考.
1 材料与方法
1.1 样品的采集和预处理

图1 南京市某污水厂处理工艺流程Fig.1 The treatment process of the wastewater treatment plant (WWTP) located in Nanjing
实验所取水样来自南京市浦口区某污水厂,其日处理量为 7.5×104m3,污水约 80%来源于周围居民日常生活污水,另有 20%来自工业园区工业污水.污水处理流程见图 1,主要处理单元为两套并联运行的活性污泥法(包括CAST和MSBR),然后经曝气生物流化池(ABFT)深度处理,最终出水直接排放至长江.设7个样点位,分别为沉砂出水(INF)、CAST混合液(CAST)、MSBR混合液(MSBR)、曝气生物池混合液(ABFT)、澄清池出水(ECB)、消毒出水(EFF)和剩余污泥(BIO)(如图1所示).取样于2016年2~4月进行,共取样4次,从相应取样点取约1L样品至已灭菌不透光聚乙烯塑料瓶中,然后将取样瓶放置于冰盒并在2h内运送至实验室,所有样品在12h内处理和分析.
1.2 水质分析分析项目包括进水和出水样品的化学需氧量(COD)、氨氮(NH3-N)、总氮(TN)、硝酸盐氮(NO3--N)和亚硝酸盐氮(NO2--N).测定方法参见表1.

表1 水质指标及其测定方法Table 1 Wastewater quality indexes and their detection methods
为评价常规水质指标对污水厂出水MCR-1基因丰度的影响,对样品进行常规水质指标分析.
1.3 DNA提取和定量PCR测定抗性基因浓度
样品经 0.22µm微孔滤膜过滤以富集微生物,过滤后的滤膜剪成小碎片后加入DNA提取管,采用DNA提取试剂盒(FastDNA Spin Kit for Soil,MP Biomedicals, CA, USA)进行DNA提取,提取过程参照产品说明书.提取的DNA用琼脂糖凝胶电泳(Biolab,USA)进行鉴定,将扩增产物进行纯化并连接至质粒克隆后作为抗性基因标准品.
应用LightCycler 96(ROCHE)荧光定量PCR进行定量检测.MCR-1基因信息列于表2,所采用的引物已被前人文献进行了验证[8,21],同时监测样品中16S含量以获得MCR-1的相对丰度.引物由金斯瑞生物科技有限公司合成.

表2 MCR-1和16S基因的信息以及定量PCR操作条件Table 2 Information of MCR-1and 16S rDNA and their quantitative PCR operating conditions
将含上述基因的标准质粒经10倍梯度稀释作为模板建立标准曲线.采用 20µL荧光定量PCR 反应体系, 包括模版 1µL,正向、反向引物(10µM)各0.4µL,SYBR Premix Ex Taq Ⅱ(天根生物科技公司,北京)10µL,ddH2O 8.2µL.反应程序为 95℃ 15min→(95℃ 10s→表 2中退火温度30s, 40个循环),生成溶解曲线.每个PCR反应进行3次平行测定,PCR扩增效率为88%~110%,确保标准曲线相关系数R > 99%.
测定标准曲线的同时进行样品的定量 PCR反应,体系和反应程序和相应基因的标准曲线保持一致,每个PCR反应进行3次平行测定.确保平行样品之间偏差<5%,否则应重新测定.根据样品的循环数(CT)计算其浓度.
1.4 耐粘菌素细菌浓度测定
采用平板计数法测定样品中耐粘菌素细菌浓度.首先将样品在摇床中震荡以充分混合,经 10倍连续梯度稀释.然后取 1mL若干稀释度的样品分别置于灭菌培养皿,加入含粘菌素(16mg/L)的 LB培养基(Tryptone 10g/L、Yeast Extract Powder 5g/L、NaCl 10g/L、Agar 15g/L)后充分摇荡以混合培养基和样品,待冷却凝固后放入恒温培养箱中37℃培养24h,统计菌落数在20~ 300CFU/mL的培养皿,确定耐粘菌素细菌的数目.每个梯度浓度的样品均设置3个平行样.浓度值的选取依据美国临床实验室标准化协会 2011发布的耐药性标准CLSI(2011版),取各病原菌对粘菌素具有耐药性的最低抑菌浓度(MIC)中的最大值.
1.5 MCR-1携带菌株的分离和耐药特征测定
采集的水样经过梯度稀释和多次划线分离,每个点位分离若干种菌株,将所有菌株进行 PCR扩增,筛选MCR-1携带菌,PCR引物参见表2[21],采用50µL体系,包括菌液2µL、正向、反向引物各 1µL,Taq II(Takara)20µL 和 ddH2O 18µL.反应程序为 95℃ 15min→(95℃ 10s→55℃ 30s→72℃ 30s,35个循环)→72℃ 5min.每个点位得到 7株MCR-1携带菌,将其加入20%甘油,保存于-20℃冰箱中备用.
采用牛津杯法测定MCR-1携带菌对粘菌素的耐药特征,主要操作如下:在培养皿中倒入10mL LB培养基,随后放入已灭菌的牛津杯,待冷却后取出牛津杯,将得到由牛津杯所形成的孔洞,每个菌种制作3个牛津杯平板.涂布200µL菌液后于孔洞中分别加入 7种不同浓度的粘菌素(150,200,300,400,600,700,1000mg/L),37℃恒温培养 24h后,使用游标卡尺测量形成的抑菌圈的直径,取平行实验所得抑菌圈直径的平均数,记录数据并分析.
1.6 数据分析
使用Canoco 4.5软件考察MCR-1及粘菌素耐药菌丰度与水质指标的相关性.物种数据为MCR-1及粘菌素耐药菌浓度,环境因子为监测的水质指标的浓度.首先,对物种矩阵进行除趋势(DCA)分析,得出第一排序轴长度相对较短(<4),所以选用线性模型RDA对物种组成数据与环境因子进行多元相关性分析;再采用手动选择方式,用Monte Carlo permutation test检验显著性,置换次数为 999,找出显著影响(P<0.05)的环境因子;最后用Canodraw 4.5作图,直观展示相关性结果.
2 结果与讨论
2.1 MCR-1基因的检出及空间分布特征
污水厂各点位均检出 MCR-1(图 2A),在曝气沉砂池中丰度高达 8.64×1011copies/L,而在CAST生化池和MSBR生化池中显著降低,分别为 5.89×1010和 2.93×1010copies/L,在曝气生物流化池混合液中(ABFT)浓度进一步降低为9.31×109copies/L.随后开始呈上升趋势,最终出水中浓度为 1.42×1011copies/L.污水处理工艺对MCR-1去除率为83.6%.
由于污水厂中 MCR-1研究很少,以其他抗性基因对比 MCR-1的去除效果.调研发现传统工艺对四环素抗性基因的去除率大多为30%~90%[22-23].另外Munir等[24]研究了美国 5个污水厂对四环素抗性基因和磺胺类抗性基因的去除,发现传统污水厂去除率在 2.37~ 4.56log(>99.6%),MBR 工艺去除率可达 2.57~ 7.06log(>99.7%).课题组此前针对另一城市污水厂的研究表明,污水处理工艺对 6种抗性基因的去除率(包括ampC、ereA、aacC1、sulI、tetA和vanA)平均在 2.1log(即 99.2%)[8].可发现本污水厂对MCR-1的去除效果偏低,这一方面可能是因为不同研究中污水处理工艺有所差别,另一方面也表明污水处理工艺无法良好的去除该基因,出水仍存留较高浓度.此外,剩余污泥中 MCR-1浓度远高于出水,达 2.88×1012copies/L.相似的结果也被前人证实,如 He等[25]研究发现污水处理厂中抗性基因主要存在于污泥中.这可能是因为MCR-1主要存在于胞内,而剩余污泥生物量很高.这也意味着出水中 MCR-1浓度的降低主要是由于大部分微生物转移至污泥中.

图2 不同取样点MCR-1丰度和相对丰度Fig.2 MCR-1abundance (A) and relative abundance (B)in various sampling sites
从图 2B MCR-1的相对丰度变化发现,除少数点位,MCR-1相对丰度并无显著下降,最终出水中相比进水甚至显著升高,达 6.55×10-5.进一步表明污水处理工艺不能有效控制 MCR-1.这可能有两方面原因所致.一方面MCR-1携带菌相比于一般细菌更难被去除,致使相对丰度升高;另一方面可能部分MCR-1基因以胞外的形式存在,而污水处理工艺不能对其很好的控制.对比MCR-1经出水和剩余污泥排放的总量,发现尽管污泥中MCR-1浓度更高,经出水排放的抗性基因(97.9%)远高于剩余污泥中基因总量(2.1%),这主要是由于污水处理厂出水量远大于剩余污泥量.显而易见,大量的 MCR-1将通过出水排放至长江,造成抗药性向地表水的传播;而污泥中高浓度的MCR-1抗性基因,按照目前主流的填埋或堆肥处置,均可能造成抗药性进一步传播的风险.
2.2 粘菌素耐药菌的分布特征
考察耐粘菌素细菌丰度(图3)发现,其在各处理单元中都存在,意味着可能携带 MCR-1.沉砂池(INF)中细菌浓度最高,达 3.94×105CFU/mL,这说明污水厂耐粘菌素细菌主要是源废水的输入,在CAST池与MSBR池中有所降低,但依然维持在较高水平,分别为1.62×105和1.28×105CFU/mL,曝气生物流化池(ABFT)中则显著下降为 2.02×103CFU/mL,最终出水中继续降低至 53CFU/mL;和 MCR-1分布类似,剩余污泥中细菌浓度远高于出水,达 2.04×105CFU/mL.污水处理工艺对耐粘菌素的细菌去除率高达99.98%.
耐粘菌素细菌丰度随污水处理流程逐步下降,与 MCR-1先下降后增长的趋势不相吻合,可能是因为并非所有MCR-1携带菌都是可培养的.事实上,据文献报道,环境中90%以上的细菌均为不可培养[26].另外,MCR-1基因可能不全存在于胞内,有相当一部分基因游离于细胞外,这从两者很低的相关性(R=0.06142)也可得到证实.
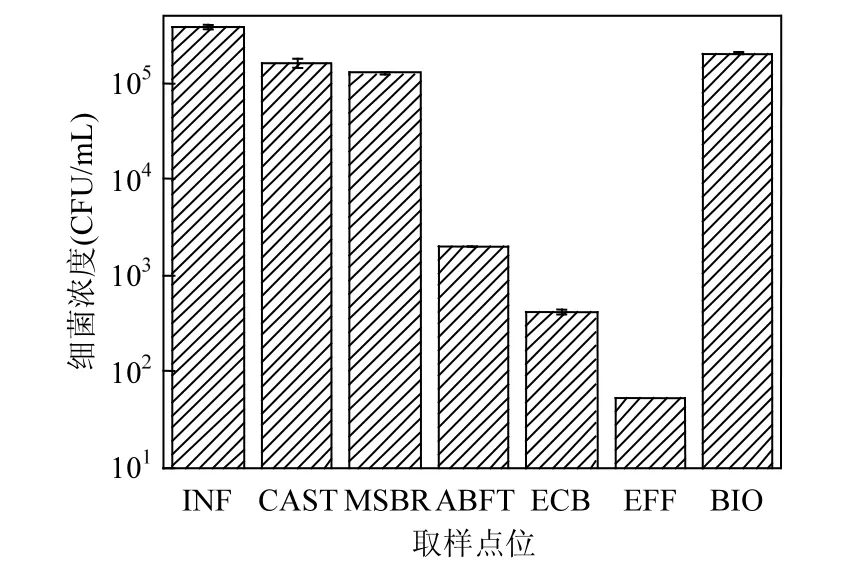
图3 不同取样点耐粘菌素细菌的丰度Fig.3 Abundance of colistin resistant bacteria in various sampling sites
2.3 MCR-1分布特征与水质指标的相关性
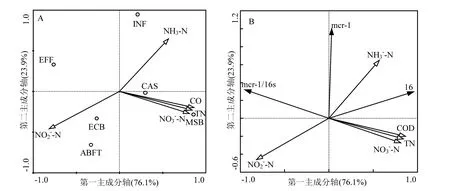
图4 MCR-1绝对丰度和相对丰度以及 16SrDNA丰度受水质指标的影响的RDA分析Fig.4 The RDA analysis about the abundance and relative abundance of MCR-1and the abundance of 16S rDNA in functions of wastewater quality parameters
对水质指标的监测(图 4A)发现,进水和MSBR池中氨氮浓度较高,分别为 4.6mg/L和4.2mg/L.而 MSBR池中 COD和总氮分别高达1958.2mg/L和 281.9mg/L.曝气生物流化池混合液和澄清池出水及最终出水中亚硝酸盐氮含量较高,分别为2.6、2.8和2.8mg/L.
从图4B中可知MCR-1与氨氮丰度呈正相关,即氨氮含量越高会导致出水中 MCR-1含量升高,而和其他指标间几乎不相关.氨氮随处理流程呈逐渐降低的趋势,这可能表明 MCR-1携带菌对氨氮需求较为明显,比如硝化细菌等.另外,16S rDNA和硝酸盐氮、COD、氨氮、总氮均呈正相关.表明城市污水中细菌以好氧有机物降解菌为主,表现为污染物浓度越高,细菌含量越多.相比之下,MCR-1相对丰度与亚硝酸盐氮和氨氮几乎不相关,而与硝酸盐氮、COD、总氮呈负相关,意味着 MCR-1携带菌可能很多是自养细菌.上述相关性分析表明在以好氧有机物降解菌为主的污水处理厂MCR-1携带菌并非优势菌种,强化氨氮的去除可能有利于MCR-1的去除.
2.4 MCR-1携带菌的耐药特征
污水厂不同点位MCR-1携带菌抑菌圈随抗生素浓度变化如图5所示.可以发现,沉砂池出水、澄清池出水、消毒出水和剩余污泥中大多数细菌随粘菌素浓度的提高抑菌圈直径增大,表明对高浓度抗生素的耐受能力下降,而CAST混合液、MSBR混合液和 ABFT混合液中大部分细菌能耐受相当高浓度的抗生素,抑菌圈直径并不随抗生素浓度提高而变化,意味着耐高浓度粘菌素能力较强.
由图6中各点位MCR-1携带菌抑菌圈直径平均值发现,进水中细菌耐粘菌素能力较弱,在300mg/L粘菌素浓度下,抑菌圈直径可达1.039cm,而CAST池、MSBR池和ABFT池中细菌耐粘菌素能力显著提高,抑菌圈直径缩小至 0.843cm,至出水中抑菌圈直径为0.821cm,其耐粘菌素能力显著高于进水.表明尽管MCR-1及粘菌素耐药菌丰度随处理流程降低,但污水处理工艺使剩余的MCR-1携带菌耐粘菌素能力显著提高,耐药性风险反而增强.相比之下,剩余污泥中细菌耐药能力最低,抑菌圈直径达0.97cm.


图5 不同点位MCR-1携带菌抑菌圈直径随粘菌素浓度的变化Fig.5 The inhibition zone diameter of MCR-1hosting bacteria isolated from various sampling sites in function of the colistin concentration

图6 各点位MCR-1携带菌抑菌圈直径平均值随粘菌素浓度的变化Fig.6 The average inhibition zone diameter of MCR-1hosting bacteria isolated from various sampling sites in function of the colistin concentration
CAST池、MSBR池和曝气生物流化池(ABFT)为生物处理的主要单元,曝气使得反应池内混合条件良好,同时水中存在大量微生物,提供了丰富的 MCR-1潜在受体,可能造成了基因的广泛转移,从而极大提高了细菌携带抗性基因的概率.另外,污泥中细菌耐药能力较低,可能表明污泥沉淀过程“选择性地”沉淀了耐药性能较低的细菌而保留少数耐药性能较高的细菌.这可能是由于不同的MCR-1携带菌在形态结构或吸附性能等方面的差异造成,这种差异也侧面反映了MCR-1在不同细菌中的传播能力,即出水中MCR-1携带菌传播能力更强.无论如何,研究结果表明出水和剩余污泥中MCR-1都具有显著的生态环境风险,出水中 MCR-1携带菌数量较少而耐药性能和传播能力很强,污泥中耐药性能变弱但浓度大大提高.
3 结论
污水处理工艺对MCR-1及粘菌素耐药菌的去除率分别为83.6%和99.98%,但出水中MCR-1浓度仍达 1.42×1011copies/L,剩余污泥中 MCR-1浓度达2.88×1012copies/L,且处理后MCR-1相对丰度提高.出水是污水厂 MCR-1的主要排放方式,占总排放量的97.9%.MCR-1丰度与氨氮浓度呈正相关,与其他水质指标无明显相关,而MCR-1相对丰度与COD、总氮和硝酸盐含量呈负相关.曝气池(CAST、MSBR)和曝气生物流化池(ABFT)中 MCR-1携带菌可耐受较高浓度粘菌素,且污水处理使出水中 MCR-1携带菌耐粘菌素能力显著提高,存在较高的生态环境风险.
参考文献:
[1]佟 娟,魏源送.污水处理厂削减耐药菌与抗性基因的研究进展[J]. 环境科学学报, 2012,32(11):2650-2659.
[2]Shi P, Jia S, Zhang X X, et al. Metagenomic insights into chlorination effects on microbial antibiotic resistance in drinking water [J]. Water Research, 2013,47(1):111-120.
[3]魏 红,王嘉玮,杨小雨,等.渭河关中段表层水中抗生素污染特征与风险 [J]. 中国环境科学, 2017,37(6):2255-2262.
[4]Jiang X B, Shi L. Distribution of tetracycline and trimethoprim/sulfamethoxazole resistance genes in aerobic bacteria isolated from cooked meat products in Guangzhou, China [J]. Food Control, 2013,30(1):30-34.
[5]Pal C, Bengtsson-Palme J, Kristiansson E, et al. The structure and diversity of human, animal and environmental resistomes [J].Microbiome, 2016,4(1):54.
[6]石 娜,孙迎雪,齐 菲,等.二级出水中环丙沙星耐药菌光辐照灭活研究 [J]. 中国环境科学, 2017,37(7):2599-2606.
[7]Zhang X X, Zhang T, Occurrence, Abundance,and Diversity of Tetracycline Resistance Genes in 15Sewage Treatment Plants across China and Other Global Locations [J]. Environmental Science & Technology, 2011,45(7):2598-2604.
[8]Yuan Q B, Guo M T, Yang J. Monitoring and assessing the impact of wastewater treatment on release of both antibiotic-resistant bacteria and their typical genes in a Chinese municipal wastewater treatment plant [J]. Environmental Science: Processes& Impacts, 2014,16(8):1930-1937.
[9]任 佳,姚 宏,刘苗苗,等.厌氧和好氧处理过程中四环素抗药基因的丰度 [J]. 中国环境科学, 2016,36(1):268-275.
[10]Guo M T, Yuan Q B, Yang J. Insights into the amplification of bacterial resistance to erythromycin in activated sludge [J].Chemosphere, 2015,136:79-85.
[11]Liu Y Y, Wang Y, Walsh T R, et al. Emergence of plasmidmediated colistin resistance mechanism MCR-1in animals and human beings in China: a microbiological and molecular biological study. National Risk Assessment Laboratory for Antimicrobial Resistance of Microorganisms in Animals [J].Lancet Infectious Diseases, 2016,16(2):161-168.
[12]Zhi C, Lv L, Yu LF, Doi Y, et al. Dissemination of the mcr-1colistin resistance gene [J]. Lancet Infectious Diseases, 2016,16(3):292-293.
[13]Arcilla M S, van Hattem J M, Matamoros S, et al. Dissemination of the mcr-1colistin resistance gene [J]. Lancet Infectious Diseases, 2016,16(2):147-149.
[14]Veldman K, van Essen-Zandbergen A, Rapallini M, et al.Location of colistin resistance gene mcr-1in Enterobacteriaceae from livestock and meat [J]. Journal of Antimicrobial Chemotherapy, 2016,71(2):2340-2342.
[15]The White House Office of the Press Secretary. FACT SHEET:Obama Administration Releases National Action Plan to Com bat Antibiotic-Resistant, Bacteria, [EB/OL]. https://www.whitehouse.gov/the-press-office/2015/03/27/fact-sheet-obama-administratio nreleases-national-action-plan-combat-ant.
[16]GB 11914-1989 水质化学需氧量的测定 [S].
[17]HJ 535-2009 水质氨氮的测定 [S].
[18]GB11894-89 水质总氮的测定 [S].
[19]HJ/T346-2007 水质硝酸盐氮的测定 [S].
[20]GB 7493-1987 水质亚硝酸盐氮的测定 [S].
[21]Bontron S, oirel L, Nordmann P. Real-time PCR for detection of plasmid-mediated polymyxin resistance (mcr-1) from cultured bacteria and stools [J]. Journal of Antimicrobial Chemotherapy,2016,71(8):2318-2320.
[22]Matos M, Pereira M A, Parpot P, et al. Influence of tetracycline on the microbial community composition and activity of nitrifying biofilms [J]. Chemosphere.2014,117(8):295-302.
[23]Dan A, Yang Y, Dai Y N, et al. Removal of antibiotics from sewage plant effluent by a natural biological aerated filter and the influencing factors [J]. Ecological Science, 2012,31(3):289-294.
[24]Munir M, Wong K, Xagoraraki I. Release of antibiotic resistant bacteria and genes in the effluent and biosolids of five wastewater utilities in Michigan [J]. Water Research, 2011,45(2):681-693.
[25]He J B, Hu A Y, Chen M, et al. Studies on the pollution levels of antibiotic resistance genes in Jiulong River estuary and wastewater treatment plants in Xiamen [J]. Microbiology, 2012,39(5):683-695.
[26]Riesenfeld C S, Goodman R M, Handelsman J. Uncultured soil bacteria are a reservoir of new antibiotic resistance genes [J].Environmental Microbiology, 2004,6(9):981-989.

