宁南山区人工林草对土壤真菌群落的影响
张树萌,黄懿梅,倪银霞,钟祺琪 (西北农林科技大学资源环境学院,农业部西北植物营养与农业环境重点实验室,陕西 杨凌 712100)
土壤真菌是土壤中的分解者,能够分解土壤中的有机物,为植物提供养分,尤其是土壤中植物残体的降解,主要靠真菌[1];部分土壤真菌在提高植物抗逆性,维持植物正常生长方面发挥巨大作用[2-4],对土壤环境乃至整个生态系统都会产生重要影响.植被恢复是指运用生态学原理通过保护现有植被、封山育林或营造人工林、灌、草植被,修复或重建被毁坏或被破坏的森林和其他自然生态系统,恢复其生物多样性及其生态系统功能[5].可见,植被恢复是通过林草措施防止土壤侵蚀、生态退化的水土保持措施之一.研究发现树种对土壤真菌的分类多样性有较大影响,不同的树种选择不同的土壤真菌群落表达植物有机质降解中涉及的不同基因[1].而不同的植被恢复模式涉及到自然封育或人工栽培的不同植被或植物,因此,研究不同植被恢复模式下,土壤真菌的群落组成与多样性特征,对于植被恢复模式的选择和生态效应的评价具有重要的理论和实践意义.
目前,对于植被恢复中土壤真菌多样性的研究主要集中在丛枝菌根真菌(AM)的组成[6]、恢复过程的群落组成和多样性变化等[7-8].而对黄土高原植被恢复中真菌的研究,大多采用 PLFA法研究了真菌的数量,普遍认为植被恢复可提高土壤真菌的数量[9-11],能够指示土层变化[12].这些研究受方法的局限,都不能全面真实地反映植被恢复过程中土壤真菌的群落组成和多样性特征,更不能说明不同的植被或植物对土壤真菌群落组成和优势物种的影响.目前,高通量测序以其反应快、通量高、基因信息覆盖度高等特点[13-15],己经成为微生物研究领域的重要技术,并己运用到土壤真菌研究领域[16-18].而在黄土高原,只有Wang等[19]和肖礼等[20]利用高通量测序技术研究了保护性耕作和梯田种植类型的真菌群落组成.关于人工恢复的林草对土壤真菌的群落组成和多样性的影响还不清楚.
因此,本研究拟采用Miseq高通量测序技术,以宁南山区自然恢复的天然草地(长芒草)为参照,研究人工草地(苜蓿)、人工林地(柠条)表层土壤中真菌群落的群落组成和多样性特征,并结合土壤的理化性质,揭示人工恢复林草对土壤真菌群落组成的影响及可能的原因,为丰富植被恢复土壤微生物多样性知识,促进黄土高原生态恢复中植被的优选和生态效应的评价提供理论依据.
1 材料与方法
1.1 研究区概况
研究区位于宁夏回族自治区固原市河川乡上黄村(东经 106°26′~106°30′,北纬 35°59′~36°3′,海拔 1534~1822m),属泾河水系支流小川河中游.该区气候属于半干旱中温带向暖温带过渡季风气候,年均气温7.1℃,年均降水量420mm,干燥度1.5~2.0,雨季从7月开始持续到10月,8月的降雨量占降水总量的24 %,多年平均蒸发量1400mm,无霜期140d;土壤类型主要是黄土母质上发育的淡黑垆土和黄绵土.主要植被类型有人工灌木林地(优势种为柠条),天然草地(优势种为长芒草)和人工草地(优势种为苜蓿)等.
1.2 样品采集
于2015年7月植物生长最旺盛季节在当地选择坡向一致的3种典型植被类型:天然草地(长芒草(SB))、人工灌木林地(柠条(CK))和人工草地(苜蓿(MS))作为研究样地,样地的基本信息见表1.在每个样地(面积平均约为3000m2)中各设置3个样方(20m×20m)作为 3个野外重复,样方之间的距离约为 100m,每个样方按照“S”布点法采集0~20cm土样5个并混合,挑出石块、根系等杂物,用灭菌锡箔纸取部分新鲜土样保存于液氮罐中,送回实验室后保存在-80℃冰箱中用于 DNA提取,其余土壤样品用塑封袋带回实验室,风干过筛 用于测定土壤基本理化性质.

表1 不同植被类型下土壤样地的基本信息Table 1 Description of sampling sites under different vegetation types
1.3 土壤基本理化性质分析
分别测定土壤的pH值、含水率(SW)、有机碳(SOC)、全氮(TN)、硝态氮(NO3--N)和铵态氮(NH4+-N)均按照常规方法进行[21].溶解性有机碳(DOC)[22]及微生物量碳(MBC)[23],测定方法按照标准方法进行,每个理化性质设置3个重复.
1.4 土壤 DNA的提取
土壤真菌 ITS区基因测序由上海美吉公司进行.使用上海美吉公司提供的 DNA试剂盒(Omega Bio-tek,Inc,Doravilla,GA,USA)进行基因组DNA的提取,完成DNA提取后利用1%琼脂糖凝胶电泳检测抽提的基因组DNA.
1.5 PCR扩增与Miseq高通量测序
对真菌ITS区基因片段进行PCR扩增,引物为 0817F(5’-CTTGGTCATTTAGAGGAAGTAA-3’)和 1196R(5’-TCTGGACCTGGTGAGTTTCC-3’).PCR过程中采用的DNA聚合酶为:TransStart FastPfu DNA Polymerase;PCR仪采用 ABI GeneAmp® 9700型.
PCR 反应采用 20µL 体系:5×FastPfu Buffer,4µL;2.5mM dNTPs, 2µL; Forward Primer(5µL),0.8µL; Reverse Primer(5µL), 0.8µL; FastPfu Polymerase, 0.4µL; Template DNA, 10ng;补充ddH2O至20µL.PCR反应条件为:95℃预变性30min;接下来进行 35个循环,包括 95℃变性 30s,55℃退火30s,72℃延伸45s;循环结束后72℃延伸10min.
全部样本按照正式实验条件进行,每个样本 3个重复,将同一样本的PCR产物混合后用2%琼脂糖凝胶电泳检测,使用AxyPrepDNA凝胶回收试剂盒(AXYGEN公司)切胶回收PCR产物, Tris_HCl洗脱; 2%琼脂糖电泳检测.参照电泳初步定量结果,将PCR产物用QuantiFluor™ -ST蓝色荧光定量系统(Promega公司)进行检测定量,之后按照每个样本的测序量要求,进行相应比例的混合.随后构建Miseq文库,进行上机测序.然后对测序后得到的序列进行优化,将优化后的非重复序列按照97%相似性进行OTU聚类,与真菌Unite数据库进行比对,获得物种注释,最后进行多样性分析.
1.6 数据分析
土壤微生物的 Chao1、ACE指数可以反应菌群的丰度,Shannon、Simpson指数可以反映微生物的多样性,其计算公式如下[24]:

式中:Schao为估计的OUT数目;Sobs为实际观测到的 OUT数目;n1为只含有一条序列的 OUT数目;n2为只含有两条序列的OUT数目;ni为含有i条序列的 OUT数目;N为所有序列数;Srare为含“abund”序列或者少于“abund”的 OUT数目;abund为“优势”OUT的阈值,默认为10.
实验中所有数据均采用 Excel 2016和SPSS 20.0进行处理和统计.各指标均采用平均值和标准偏差来表示.单因素方差分析、多重比较采用Duncan法.作图采用 OriginPro 2016软件.Canoco5.0软件对土壤真菌群落结构进行排序,并分析土壤理化性质对土壤各真菌的影响.
2 结果分析
2.1 人工林草与天然草地土壤理化性质特征
3种植被下土壤的理化性质如表 2所示.不同植被间的土壤pH值、含水率(SW)、全氮(TN)和微生物量碳(MBC)均无显著差异.土壤有机碳(SOC)含量表现为 SB显著高于 CK,二者又显著高于MS(P<0.05).土壤硝态氮(NO3--N)和铵态氮(NH4+-N)均表现为CK显著高于SB和MS.土壤溶解性有机碳(DOC)表现为SB和CK显著高于MS.人工种植柠条可显著提高土壤中硝态氮和铵态氮的含量,也有利于土壤保水.

表2 三种植被类型下土壤的基本理化性质Table 2 Soilbasic physical and chemical properties under different vegetation types
2.2 人工林草与天然草地土壤真菌群落多样性特征
表3为3种植被类型下土壤真菌多样性数据,可以看出:3种不同植被类型下的土壤真菌覆盖率均超过 99.9%,表明该测序结果能够表示土壤中真菌的真实存在情况.在 97%的相似水平下对OTU进行生物信息统计分析,获得土壤真菌OTUs数目 110~117,分属于 27个门,44个纲,70个目,91个科,108个属,113个种.
Chao1指数和 Ace指数表示土壤微生物的丰度,Chao指数和Ace指数越大微生物的丰富度越大.Shannon指数和 Simpson指数能够反映土壤微生物的多样性,Shannon指数越高表示微生物的多样性越高,Simpson指数越高表示微生物的多样性越低.土壤真菌的多样性指数在不同植被类型之间均无显著性差异,但是, Ace、Chao1和Shannon指数均表现为MS> SB >CK,Simpson指数表现为 CK>SB>MS,说明土壤的真菌丰度和多样性在MS地最高,CK地最低,而SB处于二者中间.

表3 3种植被类型下土壤真菌序列统计及多样性指数Table 3 Sequence statistics and diversity indexes of soil fungi under different vegetation types
2.3 人工林草与天然草地土壤真菌群落结构组成特征
2.3.1 3种样地土壤真菌门水平群落组成特征高通量测序结果共获得真菌菌门27个.如图1所示,3种样地土壤真菌主要由:子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、球囊菌门(Glomeromycota)、分类不明确门(Unclassified)组成,且每种菌门在 3种样地中的相对丰度均无显著差异.子囊菌门的相对丰度最大,变化范围为42%~84%,丰度均值 71.8%,表现为 MS>SB>CK,MS比SB高出6.6%,CK比SB低19.1%.担子菌门(Basidiomycota)的相对丰度次之,变化范围为7%~29%,丰度均值15.2%,表现为CK>SB>MS,CK比SB高出12.2%,MS比SB低6.0%.球囊菌门占总丰度的 1.0%~7.5%,丰度均值 4.2%,表现为SB>MS>CK,SB分别高于MS和CK0.7%和1.1%.同时在所有植被类型中,子囊菌门、担子菌门两者的丰度总和均占总丰度的 80%以上;分类不明确门的丰度占总丰度的0.8%~ 7.9%.

图1 3种样地门水平下土壤真菌群落组成Fig.1 Composition of fungi communityat a phylum level
MS和SB土壤中真菌的优势菌门为子囊菌门,其丰度占总丰度的82.55%和75.98%.CK土壤真菌的优势菌门为子囊菌门和担子菌门,丰度分别为56.90%和25.29%.
2.3.2 3种样地土壤真菌纲水平群落组成特征 如图2所示,高通量测序结果得到真菌菌纲44个,其中的优势菌纲有:粪壳菌纲(Sordariomycetes)、座囊菌纲(Dothideomycetes)、伞菌纲(Agaricomycetes)、盘菌纲(Pezizomycetes)、散囊菌纲(Eurotiomycetes)、球囊菌纲(Glomeromycetes)、银耳纲(Tremellomycetes)、分类不明确纲(Unclassified).粪壳菌纲的相对丰度最高,可以占全部真菌纲的 19%~35%,丰度均值 27.9%;其次为座囊菌纲,变化范围为 16~26%,丰度均值 23.1%.盘菌纲在 SB的相对丰度为17.8%,且显著高于CK.虽然其余菌纲在3种植被中的相对丰度均无显著差异,但伞菌纲在 CK中的丰度明显高于MS.粪壳菌纲、座囊菌纲和银耳纲在 MS植被土壤中的丰度最大,分别为:34.42%、26.79%和 1.59%.伞菌纲、分类不明确纲和其他纲(Others)在CK土壤中的丰度最大,分别为:23.62%、9.44%和8.18%.盘菌纲、散囊菌纲和球囊菌纲在 SB土壤中丰度最大,分别为:17.84%、6.09%和4.53%.同时在3种植被的土壤中,粪壳菌纲、座囊菌纲、伞菌纲和盘菌纲的丰度总和超过70%.SB中的座囊菌纲和分类不明确纲的相对丰度分别低于 CK和 MS 10.0%,10.5%和4.0%,3.6%.

图2 3种样地纲水平下土壤真菌群落组成Fig.2 Composition of fungi community at a class level
2.3.3 3种样地土壤真菌属水平相对丰度分布 选取丰度排名为前35的真菌属,根据每个样地各属的丰度均值,对各植被类型之间真菌相对丰度进行聚类分析,得到 Heatmap热图(图 4).由图中可以看出,CK、MS、SB分别有10,14,11个属的相对丰度较高,说明了不同植被类型下土壤真菌属的相对丰度存在差异.MS和SB的相似度较高,先聚为一类.可能是由于与CK相比,MS和SB类型同属草地,群落内物种相似度较高,真菌 属的类群较为相似.
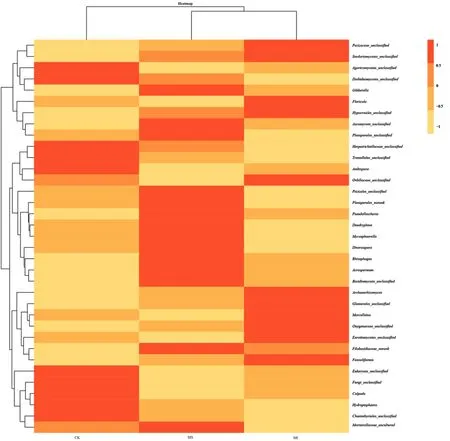
图3 3种样地真菌属水平相对丰度热图Fig.3 Heatmapdiagram of relative abundance of fungi ata genus level
在前35个真菌属中,有18个真菌属为分类不明确属(Unclassified).在CK土壤中,丰度较高的已知真菌属主要有:两性球囊霉属(Ambispora)、肾形虫属(Colpoda)、水球壳属(Hydropisphaera),其中优势度最高的属为肾形虫属,相对丰度为 2.64%.在 MS土壤中,丰度较高的已知真菌属主要有:扁棒壳属(Acrospermum)、支链孢属(Dendryphion)、多孢囊霉属(Diversispora)、赤霉属(Gibberella)、球腔菌属(Mycosphaerella)、假埃希氏菌属(Pseudallescheria)和根内球囊霉属(Rhizophagus)等,其中优势度最高的属为赤霉属,相对丰度为16.32%.在 SB 土壤中,丰度较高的已知真菌属主要有:Archaeorhizomyces、叶生壳属(Floricola)、管柄囊霉属(Funneliformis)、Marcelleina,其中优势度最高的属为叶生壳属,相对丰度为 6.29%.总体来看,赤霉属是 3种植被类型土壤中优势度最大的真菌属,相对丰度均值为12.87%.除此之外,3种植被土壤真菌属相对丰度均值超过 1%的还有肾形虫属、水球壳属、叶生壳属、管柄囊霉属和Marcelleina.
2.4 土壤理化性质与土壤真菌群落分布的关系
由于3个样地中已知的真菌优势菌门只有3种,而优势菌属又在 10种以上,所以选择真菌优势菌纲与环境因子进行 RDA分析,有利于更好地寻找真菌与环境因子的相关性规律.对 3种植被的土壤真菌优势菌纲与环境变量(土壤理化性质)进行RDA分析如图4所示.优势真菌纲射线与环境变量线段之间的夹角余弦值代表两者的相关性大小,夹角越小相关性越大,各环境变量线段的长短表示其对真菌纲分布所起作用的大小.在图4中,土壤水分(SW)和土壤碳、氮含量对真菌分布的影响均较大.粪壳菌纲、座囊菌纲、球囊菌纲、与土壤全氮(TN)呈正相关,与其它理化性质呈负相关;盘菌纲和散囊菌纲与土壤全氮(TN)、土壤溶解性有机碳(DOC)、土壤微生物量碳(MBC)和土壤有机碳(SOC)呈正相关,与土壤pH值、土壤水分(SW)、土壤硝态氮(NO3--N)和铵态氮(NH4+-N)呈负相关;银耳纲和分类不明确纲与土壤 pH值、土壤水分(SW)、土壤硝态氮(NO3--N)和铵态氮(NH4+-N)呈正相关,与土壤全氮(TN)、土壤溶解性有机碳(DOC)、土壤微生物量碳(MBC)和土壤有机碳(SOC)呈负相关;伞菌纲与土壤全氮(TN)呈负相关,与其它理化性质呈正相关.
3 讨论
3.1 植被类型对土壤真菌群落组成及其丰度的影响
在本研究中,3种植被类型土壤中丰度最大的真菌菌门为子囊菌门丰度为:42%~84%,丰度最大的真菌菌纲为粪壳菌纲丰度为 19%~35%,其次为座囊菌纲丰度为 16~26%.这与黄河三角洲盐碱地土壤真菌的优势门和纲相一致[25],可能是由于两种土壤的 pH值都为碱性,真菌的生长环境较为相似.但不同的是在本研究中检测到的毛霉亚门真菌(Mucoromycotina)较少,这可能是由于土壤类型和气候条件等原因造成的.子囊菌门也是湖南杉木人工林土壤[26]和老挝热带草地土壤[27]的主要真菌门类,说明子囊菌门真菌在多种类型土壤中作为优势菌门存在,且在偏酸性土壤中也能大量存在(pH 值:4.3~5.4).本研究和已有的研究都发现不同植被类型下土壤真菌菌门和菌纲的组成有一定的相似性,但是真菌菌门和菌纲的相对丰度有差异,可能与不同的植物群落产生不同的根系残体及分泌物,从而对土壤真菌群落组成产生不同的影响有关[28-29].
从土壤真菌属水平的相对丰度热图中可以看出,赤霉属是宁南山区土壤的优势菌属,大多数赤霉属的真菌都可产生生物活性物质(多酮类化合物、萜类化合物等)或植物毒素(镰刀菌酸、串珠镰刀菌素等),从而引起植物的病害,如水稻恶苗病、马铃薯干腐病和玉米穗腐病[30].除此之外还发现其它致病菌属:扁棒壳属、支链孢属、球腔菌属和假埃希氏菌属.假埃希氏菌属作为一类特殊的致病菌可以引起人类呼吸系统的疾病[31].本研究还测定出了多种 AM 真菌如:多孢囊霉属、根内球囊霉属、两性球囊霉属和管柄囊霉属等.除此之外还发现了叶生壳属,这个属目前仅包含一个菌种Floricola striata[32],可产生多种对三联苯衍生物,这些物质可以通过破坏细胞膜发挥杀菌的作用[33].但是其在土壤中所发挥的作用,还有待进一步的研究.

图4 土壤理化性质与真菌门水平下的RDA分析Fig.4 The RDA of soil parameters and fungi phyla
从真菌多样性指数的结果可以看出,无论是真菌丰度还是多样性,均表现为苜蓿土壤最高,且苜蓿土壤的子囊菌门真菌的相对丰度也最高.这可能是由于与其它两种样地相比,苜蓿作为优质牧草具有生长更快、产量更高的特点,能够固定大量大气中的 CO2,增加土壤腐殖质和有机质含量[34];同时作为豆科植物,苜蓿能与根瘤菌形成共生关系固氮,所以苜蓿能为子囊菌的生长繁殖提供良好的条件.子囊菌门真菌以腐生菌居多,能够分解土壤有机质[26],相较于担子菌门真菌,其拥有更快的进化速率[35],所以子囊菌门在苜蓿土壤的优势度最大.本研究还发现包括赤霉属在内的上述所有的致病菌属均表现为在苜蓿土壤中的相对丰度最大,说明苜蓿积累了大量的致病菌,可能是由于人工种植苜蓿改变了原有地区的植被类型和多样性造成的.肾形虫属作为土壤当中的原生动物,对于土壤环境十分敏感,可以作为生态恢复过程中的指示生物来评价土壤环境质量[36-37],其在苜蓿土壤中最少,可能是由于土壤中致病菌增加造成的.相关研究表明,随着种植年限的增加,苜蓿产量会呈现先增加后减小的趋势[38-39],除了受到养分和水分等限制因素外,也可能与土壤中的致病菌随种植年限的增加而不断积累有关.
柠条土壤中真菌数量大于天然草地,但真菌多样性小于天然草地.这可能是因为柠条与苜蓿一样同属豆科植物,可通过固氮为真菌提供必需的养分,增加了真菌的数量,但是柠条作为灌木,改变了当地原有的植被类型,降低了土壤真菌的多样性.本研究还发现在柠条土壤中,担子菌门真菌的丰度所占比例明显上升,可能是由于能够降解木质素的真菌多属于担子菌门[40],而柠条作为灌木,属于木本植物,其木质素含量比草本植物更高[41],更有利于担子菌门真菌的生长繁殖.另外,3种类型的植被土壤中肾形虫属的相对丰度在柠条土壤中最大,说明柠条土壤质量较好,有利于原生动物的生长.
在本研究中,土壤球囊菌纲真菌的相对丰度在天然草地中最大,苜蓿次之,柠条最小,AM真菌是属于球囊菌门,球囊菌纲的一类真菌,这些真菌可以与植物形成共生关系,在促进植物的生长,提高植物的抗逆性,改善土壤环境等方面有着重要的作用,是土壤中的有益真菌[42].天然草地土壤中的AM 真菌的相对丰度最大,可能是因为长芒草作为当地物种,与AM真菌具有更好的共生关系,有利于其生长;而进行人工恢复会使人工植被占据了优势地位而导致区域植物多样性的降低,不利于土壤中AM真菌的增加.另外,也可能与植物的类型有关,苜蓿和天然草地同属于草本,所以AM 真菌的丰度相对较高,而柠条为灌木,所以AM真菌的相对丰度较低.
3.2 影响土壤真菌群落组成和多样性特征的土壤环境因素.
本研究的RDA分析表明土壤水分(SW)、土壤有机碳(TOC)和全氮(TN)为影响真菌群落组成的最主要因素,土壤 pH值的影响最小.这与对关中平原 5a保护性耕作土壤[19]、中国北方黑土[43]、南极西部土壤[44]和大兴安岭松林土壤[45]的研究结果相似.而与天水小陇山红豆杉林土壤[46]和挪威北部群岛土壤[47]中,pH 值是影响土壤真菌的最主要因素不同.也与土壤碱解氮是黄河三角洲盐碱地土壤中,影响土壤真菌的最主要因素不同[48-49].这可能是由于不同研究区影响真菌群落组成的主要环境因子不同[50].土壤 pH值对土壤真菌群落产生影响的原因可能是由于pH值会对土壤中化合物的形态产生影响,进而影响土壤微生物对营养元素的摄取.有研究表明,不同真菌种类对于土壤 pH值的适应范围不同,适合腐生真菌生活的pH值范围为7~8,而适合菌根真菌生存的pH值范围为5~6[51].子囊菌门真菌大多数为腐生菌[26],本研究中各土壤 pH 值均在 7~8之间,这可能是子囊菌门为研究区土壤优势菌门的一个原因.陈丹梅[52]的研究表明,水稻土壤在长期淹水的条件下真菌的多样性降低,优势种群明显.王杰等[53]对大兴安岭草原暗栗钙土的研究也表明,水分添加有利于微生物对养分的利用.可见,不同的土壤中微生物对水分的反应不同,宁南山区气候较为干旱,水分是土壤真菌生长繁殖必需的物质,也是影响土壤真菌群落组成的重要因素.土壤全氮(TN)也是影响土壤中真菌分布的主要环境因子,可能是由于土壤氮素是土壤微生物必需的营养元素之一,对微生物的生长、发育、繁殖起着重要的作用.但是土壤全氮(TN)与担子菌门下的伞菌纲和银耳纲呈负相关,可能是由于氮元素能够抑制某些担子菌门真菌胞外分解酶和⋅OH 基团的产生,使担子菌门真菌分解木质素的能力降低[54],因此土壤中氮含量较多高会限制担子菌门真菌对木质素的利用,进而抑制其生长.土壤有机碳(SOC)是影响土壤真菌群落结构的重要因子,与秸秆还田可显著增加真菌的数量及多样性[55-56]的结论相同,因为秸秆主要由木质素、纤维素和多糖等含碳物质组成,秸秆还田可增加土壤碳含量,而本研究中的林草枯落物和分泌物也能够增加土壤中的有机碳,有机碳是腐生性真菌的能源物质,所以对真菌的影响较大.
4 结论
4.1 3种植被下土壤优势真菌的分布特征为:子囊菌门和担子菌门分别在苜蓿地和柠条地的相对丰度最大;粪壳菌纲和座囊菌纲均在苜蓿地的相对丰度最大,伞菌纲和盘菌纲分别在柠条和长芒草地的相对丰度最大.在丰度排名前35的属中,功能已知的真菌属包括:5种致病菌属,4种 AM真菌属和1种原生动物属.
4.2 苜蓿土壤的真菌丰度和多样性最高,子囊菌门真菌和致病菌属也最多;种植柠条有利于担子菌门真菌和原生动物属的生长;天然草地中AM 真菌的丰度最高.人工林草恢复的优势菌群和群落组成不同于天然植被,减少了AM真菌的丰度,增大了致病菌属的丰度.总体上,在本研究区,人工林草对土壤真菌群落组成和多样性有较明显的影响.
4.3 RDA 分析表明,土壤水分(SW)、有机碳(TOC)和全氮(TN)是影响宁南山区土壤真菌群落结构及其丰度的主要理化因子.
参考文献:
[1]Barbi F, Prudent E, Vallon L, et al. Tree species select diverse soil fungal communities expressing different sets of lignocellulolytic enzyme-encoding genes [J]. Soil Biology and Biochemistry, 2016,100:149-159.
[2]Filion M, St-Arnaud M, Fortin J A. Direct interaction between the arbuscular mycorrhizal fungus Glomus intraradices and different rhizosphere microorganisms [J]. New Phytologist, 1999,141(3):525-533.
[3]Mukerji K G. Concepts in Mycorrhizal Research [M]. New Delhi:Springer Netherlands, 1996:385.
[4]Smith K P, Goodman R M. Host variation for interactions with beneficial plant-associated microbes [J]. Annual Review of Phytopathology, 1999,37:473-491.
[5]胡婵娟,郭 雷.植被恢复的生态效应研究进展 [J]. 生态环境学报, 2012,1(9):1640-1646.
[6]何跃军,吴春玉,何丙辉,等.喀斯特不同植被恢复阶段土壤 AMF组成及多样性研究 [J]. 水土保持学报, 2016,30(5):305-309.
[7]周文萍,向 丹,胡亚军,等.长期围封对不同放牧强度下草地植物和 AM 真菌群落恢复的影响 [J]. 生态学报, 2013,33(11):3383-3393.
[8]李登武,薛 玲,张万红.黄土丘陵沟壑区丛枝菌根真菌多样性及其分布 [J]. 林业科学, 2011,47(7):116-122.
[9]胡婵娟,郭 雷,刘国华.黄土丘陵沟壑区不同植被恢复格局下土壤微生物群落结构 [J]. 生态学报, 2014,34(11):2986-2995.
[10]余 旋,刘 旭,刘金良,等.黄土高原丘陵区沙棘人工林土壤微生物群落演变特征研究 [J]. 西北林学院学报, 2015,30(5):1-6.
[11]刘海燕,魏天兴,王 仙.黄土丘陵区人工林土壤微生物PLFA标记多样性分析 [J]. 北京林业大学学报, 2016,38(1):28-35.
[12]Huang Y M, Michel K, An S S, et al. Changes in microbialcommunity structure with depth and time in a chronosequence of restored grassland soils on the Loess Plateau in northwest China[J]. Journal of Plant Nutrition and Soil Science, 2011,174(5):765-774.
[13]张文力.高通量测序数据分析现状与挑战 [J]. 集成技术,2012,1(3):20-24.
[14]贺纪正,袁超磊,沈菊培,等.土壤宏基因组学研究方法与进展[J]. 土壤学报, 2012,49(1):155-164.
[15]刘 洋,曾全超,黄懿梅.基于454高通量测序的黄土高原不同乔木林土壤细菌群落特征 [J]. 中国环境科学, 2016,36(11):3487-3494.
[16]王艳云,姜爱霞,郭笃发.黄河三角洲土壤真菌群落结构对盐生植被演替的响应 [J]. 环境科学学报, 2016,36(11):4146-4152.
[17]汪其同,高明宇,刘梦玲,等.基于高通量测序的杨树人工林根际土壤真菌群落结构 [J]. 应用生态学报, 2017,28(4):1-9.
[18]高微微,康 颖,卢 宏,等.城市森林不同林型下土壤基本理化特性及土壤真菌多样性 [J]. 东北林业大学学报, 2016,44(3):89-94.
[19]Wang Z, Chen Q, Liu L, et al. Responses of soil fungi to 5-year conservation tillage treatments in the drylands of northern China[J]. Applied Soil Ecology, 2016,101:132-140.
[20]肖 礼,黄懿梅,赵俊峰,等.土壤真菌组成对黄土高原梯田种植类型的响应 [J]. 中国环境科学, 2017,37(8):3151-3158.
[21]鲍士旦.土壤农化分析 [M]. 南京:农业出版社, 2000:495.
[22]Jones D L, Willett V B. Experimental evaluation of methods to quantify dissolved organic nitrogen (DON) and dissolved organic carbon (DOC) in soil [J]. Soil Biology and Biochemistry, 2006,38(5):991-999.
[23]Wu J, Joergensen R G, Pommerening B, et al. Measurement of soil microbial biomass C by fumigation-extraction-An automated procedure [J]. Soil Biology and Biochemistry, 1990,22(8):1167-1169.
[24]王圣洁,刘君昂,何苑皞,等.基于焦磷酸测序的杉木人工林微型土壤动物多样性 [J]. 应用生态学报, 2014,25(6):1661-1668.
[25]王艳云,郭笃发.黄河三角洲盐碱地土壤真菌多样性 [J]. 北方园艺, 2016,18:185-189.
[26]何苑皞,周国英,王圣洁,等.杉木人工林土壤真菌遗传多样性[J]. 生态学报, 2014,34(10):2725-2736.
[27]Lienhard P, Terrat S,Prévost-Bouré N C, et al. Pyrosequencing evidences the impact of cropping on soil bacterial and fungal diversity in Laos tropical grassland [J]. Agronomy for Sustainable Development, 2014,34(2):525-533.
[28]Degrune F, Dufrêne M, Colinet G, et al. A novel sub-phylum method discriminates better the impact of crop management on soil microbial community [J]. Agronomy for Sustainable Development, 2015,35(3):1157-1166.
[29]Silva A P D, Babujia L C, Franchini J C, et al. Soil structure and its influence on microbial biomass in different soil and crop management systems [J]. Soil and Tillage Research, 2014,142(1):42-53.
[30]Desjardins A E. Gibberella from A (venaceae) to Z (eae) [J].Annual Review of Phytopathology, 2003,41(1):177-198.
[31]Ann E W M D. Pseudallescheria: An underdiagnosed fungus? [J].Diagnostic Cytopathology, 2001,25(3):153-157.
[32]金 静.渤海、黄海海域山东沿岸海洋木生真菌的分类研究[D]. 山东:山东农业大学, 2004.
[33]Li W, Gao W, Zhang M, et al. p-Terphenyl Derivatives from the Endolichenic FungusFloricola striata [J]. Journal of Natural Products. 2016,79(9):2188-2194.
[34]苏永中,刘文杰,杨 荣,等.河西走廊中段绿洲退化土地退耕种植苜蓿的固碳效应 [J]. 生态学报, 2009,29(12):6385-6391.
[35]王海英,郭守玉,黄满荣,等.子囊菌较担子菌具有更快的进化速率和更高的物种多样性 [J]. 中国科学:生命科学, 2010,40(8):731-737.
[36]禹娟红.甘肃定西华家岭土壤纤毛虫群落对生态恢复的响应[D]. 兰州:西北师范大学, 2009.
[37]吴东辉,尹文英,阎日青.植被恢复方式对重度退化草原土壤跳虫群落的影响 [J]. 中国环境科学, 2008,28(5):466-470.
[38]罗珠珠,牛伊宁,李玲玲,等.陇中黄土高原不同种植年限苜蓿草地土壤水分及产量响应 [J]. 草业学报, 2015,24(1):31-38.
[39]邰继承,张丽妍,杨恒山.种植年限对紫花苜蓿栽培草地草产量及土壤氮、磷、钾含量的影响 [J]. 草业科学, 2009,26(12):82-86.
[40]于淑玲.腐生真菌在有机质分解过程中的作用研究进展 [J].河北师范大学学报(自然科学版), 2003,27(5):519-522.
[41]陈慧泉,龚运淮,方 舟.天然高分子物质的利用现状和前景(Ⅰ)-纤维素、木质素和淀粉 [J]. 云南化工, 1996,1:41-46.
[42]李 岩,焦 惠,徐丽娟,等.AM 真菌群落结构与功能研究进展[J]. 生态学报, 2010,30(4):1089-1096.
[43]Liu J, Sui Y, Yu Z, et al. Soil carbon content drives the biogeographical distribution of fungal communities in the black soil zone of northeast China [J]. Soil Biology and Biochemistry,2015,83:29-39.
[44]Bridge P D, Newsham K K. Soil fungal community composition at Mars Oasis, a southern maritime Antarctic site, assessed by PCR amplification and cloning [J]. Fungal Ecology, 2009,2(2):66-74.
[45]邹 莉,唐庆明,王 轶.落叶松、樟子松纯林及混交林土壤微生物的群落分布特征 [J]. 东北林业大学学报, 2010,38(11):63-64.
[46]巨天珍,陈 源,常成虎,等.天水小陇山红豆杉(Taxus chinensis(Pile.) Rehd)林土壤真菌多样性及其与生态因子的相关性 [J].环境科学研究, 2008,21(1):128-132.
[47]Zhang T, Wang N F, Liu H Y, et al. Soil pH is a Key Determinant of Soil Fungal Community Composition in the Ny-Alesund Region, Svalbard (High Arctic) [J]. Frontiers in Microbiology,2016,7(244):1-10.
[48]王艳云,郭笃发.黄河三角洲盐碱地土壤真菌多样性及其与土壤理化性质的关系 [J]. 浙江农业学报, 2016,28(11):1901-1907.
[49]裴 振,孔 强,郭笃发.盐生植被演替对土壤微生物碳源代谢活性的影响 [J]. 中国环境科学, 2017,37(1):373-380.
[50]王 芳,图力古尔.土壤真菌多样性研究进展 [J]. 菌物研究,2014,12(3):178-186.
[51]Yamanaka T. The effect of pH on the growth of saprotrophic and ectomycorrhizal ammonia fungi in vitro [J]. Mycologia. 2003,95(4):584-589.
[52]陈丹梅,袁 玲,黄建国,等.长期施肥对南方典型水稻土养分含量及真菌群落的影响 [J]. 作物学报, 2017,43(2):286-295.
[53]王 杰,李 刚,修伟明,等.贝加尔针茅草原土壤微生物功能多样性对氮素和水分添加的响应 [J]. 草业学报, 2014,23(4):343-350.
[54]Fog K. The effect of added nitrogen on the rate of decomposition of organic matter [J]. Biological Reviews, 1988,63(3):433-462.
[55]李 鹏,李永春,史加亮,等.水稻秸秆还田时间对土壤真菌群落结构的影响 [J]. 生态学报, 2017,37(13):4309-4317.
[56]辛 励,陈延玲,刘树堂,等.长期定位秸秆还田对土壤真菌群落的影响 [J]. 华北农学报, 2016,31(5):186-192.

