LED蓝光与柠檬酸对大肠杆菌的协同抗菌作用
俞建峰 - 夏晓露 - 崔政伟 - 陈 健 张楚唯 -
(1. 江南大学机械工程学院,江苏 无锡 214122;2. 江苏省食品先进制造装备技术重点实验室,江苏 无锡 214122)
随着消费者食品安全意识的不断提高,以及食品相关法律法规执行力的逐步增强,食品安全和食品质量正受到越来越多的关注。而在食品安全领域最让消费者关注的就是细菌、寄生虫和病毒这类能够引起食源性疾病的病原体[1-2]。灭菌是最有效的食品保鲜方法之一,已被广泛地应用于食品加工领域。如今,传统的热灭菌技术在食品工业中依然占主导地位,但也存在缺陷。为了克服热灭菌的局限性,目前的研究重点在于开发新的灭菌技术[3]。不同的非热灭菌技术(如超高压[4]、超声波[5]、高压脉冲电场[6]、电子束辐照[7]等)都已被证实具有良好的灭菌效果。
近来,发光二极管(LED)技术成为微生物灭活方面的研究热点。LED是一种可以在非常窄的波长光谱内发光的半导体组件。与传统的可见光源相比,其具备能耗低、耐用性高等优点。此外,由于体积较小,LED可灵活应用于现有系统[8-9]。如今,LED已广泛应用于光电、电子和医疗等领域。多项研究[10-11]表明,使用LED蓝光处理悬浮状态下食源性病原体,可使其降低多个数量级。
柠檬酸是一种动植物体内重要且常见的有机酸,安全无毒、无害,常在食品领域被作为食品添加剂和防腐剂使用[12]。柠檬酸能够降低环境的pH,使氢离子在细胞内不断累积,从而改变细胞内的渗透压,破坏内稳态,故具备抑制细菌细胞生长和繁殖的功能[13-14]。
大肠杆菌O157:H7(EscherichiacoliO157:H7)是一种常见的食源性致病菌,可产生志贺毒素,引起出血性肠炎、溶血性尿毒症综合征等[15]。疾病控制和预防中心(CDC)的报告称,每年由大肠杆菌O157:H7引起的食源性感染约有73 000 例,其中有2%~7%为严重的溶血性尿毒症综合征[16]。大肠杆菌O157:H7的食源性致病爆发主要与受污染的食物(如新鲜蔬菜、酸性饮料和肉类等)有关[17]。目前,关于LED可见光抗菌的研究方向主要有可见光波长、不同的食物基质和不同的食源性致病菌等,而针对LED蓝光辐照强度与柠檬酸质量浓度对大肠杆菌O157:H7的协同抗菌的研究尚未见报道。本试验主要研究不同辐照强度的LED蓝光以及不同质量浓度的柠檬酸与LED蓝光协同作用对大肠杆菌O157:H7抗菌效果的影响,以期为食品加工生产和食品保鲜中大肠杆菌O157:H7的灭活提供新的思路。
1 材料与方法
1.1 材料与仪器
大肠杆菌O157:H7 (EscherichiacoliO157:H7) 菌株:江南大学生物工程学院微生物实验室;
柠檬酸:分析纯,国药集团化学试剂有限公司;
平板计数琼脂培养基:1 g葡萄糖,15 g琼脂,5 g胰蛋白胨,2.5 g酵母浸出粉,pH 7.2,溶于1 000 mL去离子水中,加热煮沸溶解,锥形瓶分装,121 ℃高压蒸汽灭菌15 min;
营养肉汤培养基:10 g蛋白胨,3 g牛肉浸出粉,5 g氯化钠,pH 7.2,溶于1 000 mL去离子水中,加热煮沸溶解,锥形瓶分装,121 ℃高压蒸汽灭菌15 min;
精密电子分析天平:AR1140型,奥豪斯国际贸易(上海)有限公司;
恒温鼓风烘干干燥箱:DHG-9076A型,上海精宏实验设备有限公司;
超净工作台:SJ-CJ-2FD型,苏州苏洁净化设备有限公司;
手提式压力蒸汽灭菌锅:XFS-280型,浙江新丰医疗器械有限公司;
恒温生化培养箱:SPX-200型,上海跃进医疗器械有限公司;
蓝光LED灯:TDB-9型,深圳市我的照明灯饰有限公司。
1.2 试验方法
1.2.1 菌种的活化及悬菌液制备 将甘油管保藏的菌种从-20 ℃的冰箱中取出,放在超净工作台上,室温融化,用灭菌后的接种环取1环菌液在固体琼脂培养基上进行平板划线,于37 ℃培养箱中倒置培养24~48 h。挑取培养基上生长旺盛的单菌落,接种于液体培养基,37 ℃振荡摇床培养,连续传代培养2~3次。将初始菌液10倍系列稀释,并用平板计数琼脂培养基计数,然后计算其浓度。活化好的菌液贮存于4 ℃的冰箱中,且时间不超过10 d。
1.2.2 LED光照系统 蓝光LED灯具功率为9 W,光照直径为90 mm。在光照试验中,光源与培养皿的间距分别为4.5,5.5,6.5 cm,其对应辐照强度为141.4,85.8,26.7 mW/cm2。将安装好的LED灯具固定于灯架上,且整个LED光源放置于含有内接电源的恒温控制培养箱中,LED光照系统截面示意图见图1。

1. 悬菌液 2. 灯架 3. 散热板 4. 恒温生化培养箱 5. 蓝光LED 6. 蓝光 7. 培养皿 8. 聚四氟乙烯板
图1 LED光照系统截面示意图
Figure 1 The cross sectional diagram of the LED illumination system
1.2.3 LED蓝光对大肠杆菌O157:H7的抗菌试验 为模拟超市货架低温及室温,将试验温度设计为12,25 ℃。在超净工作台上,使用无菌去离子水,将初始大肠杆菌O157:H7菌液10倍系列稀释至107CFU/mL。而后用移液管将1 mL大肠杆菌O157:H7菌液移至9 mL的营养肉汤中,以模拟食物基质中的营养物质。将菌悬液置于LED光照系统下的无菌培养皿(D=60 mm)中。分别在12,25 ℃条件下,调节培养皿与LED光源间距分别为4.5,5.5,6.5 cm,采用LED蓝光照射8 h,同时在没有LED光照的情况下使用相同的装置进行对照试验,每间隔1 h取样一次。参照Min-Jeong Kim等[18]的方法,按式(1)计算每个细菌受到的光照剂量。
E=Pt,
(1)
式中:
E——光照剂量,J/cm2;
P——辐照强度,mW/cm2;
t——光照时间,s。
1.2.4 柠檬酸对大肠杆菌O157:H7的抗菌试验 根据GB 2760—2014《食品安全国家标准 食品添加剂使用标准》,本试验中拟定的柠檬酸质量浓度为0.2,0.5,1.0 g/kg。制备柠檬酸溶液:分别取0.2,0.5,1.0 g柠檬酸,溶解于1 000 g去离子水中,121 ℃高压蒸汽灭菌15 min;柠檬酸对大肠杆菌O157:H7生长影响试验:在超净工作台上,使用无菌去离子水,将初始大肠杆菌O157:H7菌液10倍系列稀释至107CFU/mL,然后用移液管将1 mL大肠杆菌O157:H7菌液移至9 mL的营养肉汤中,再分别加入质量浓度为0.2,0.5,1.0 g/kg的柠檬酸,空白对照组加入等量的无菌去离子水。试验悬菌液放置于无菌培养皿中,分别在温度为12,25 ℃,且无光照条件下自然生长8 h,每间隔1 h取样一次。
1.2.5 LED蓝光与柠檬酸溶液的协同抗菌试验 在超净工作台上,使用无菌去离子水,将初始大肠杆菌O157:H7菌液10倍系列稀释至107CFU/mL,然后用移液管将1 mL大肠杆菌O157:H7菌液移至9 mL的营养肉汤中,再分别加入质量浓度为0.2,0.5,1.0 g/kg的柠檬酸,空白对照组加入等量的无菌去离子水。将试验菌悬液置于LED光照系统下的无菌培养皿中,固定培养皿与LED光源的间距为5.5 cm(辐照强度为85.8 mW/cm2)。分别在12,25 ℃的条件下光照8 h,每间隔1 h取样一次。
1.2.6 菌落计数及抗菌效果的确定 在每个取样间隔,用移液管取试验菌液和对照菌液100 μL,然后用无菌去离子水10倍系列稀释所取样品,最后取200 μL稀释液于无菌培养皿中,倒入平板计数琼脂培养基。在37 ℃的恒温生化培养箱中倒置培养24~48 h,然后进行人工菌落计数。“抗菌效果”为对照组(CK)与试验组(CM)的试验结果差异。
1.2.7 统计学分析 根据3次独立试验的试验数据,计算平均值。采用SAS 8.0进行数据统计与分析,计算平均值±标准偏差及显著性分析。以试验时间为横坐标,菌落总数为纵坐标,利用Origin 8.5软件制图。
2 结果与分析
2.1 LED辐照强度对大肠杆菌O157:H7抗菌效果的影响
细菌细胞中含有光敏物质——卟啉,它们能够吸收电磁光谱中特定波长的可见光。卟啉吸收光子后转变为激发态,在从激发态转变为基态的过程中将能量释放给不能吸收光子的氧化物,促使其发生化学反应产生活性氧(ROS)。产生的活性氧包括超氧阴离子、过氧化氢、羟基自由基等,这些活性氧物质通过细胞毒性方式与各种细胞成分如脂质、蛋白质和DNA等进行反应并最终导致细胞死亡[19]。LED光照破坏细胞的机理见图2。
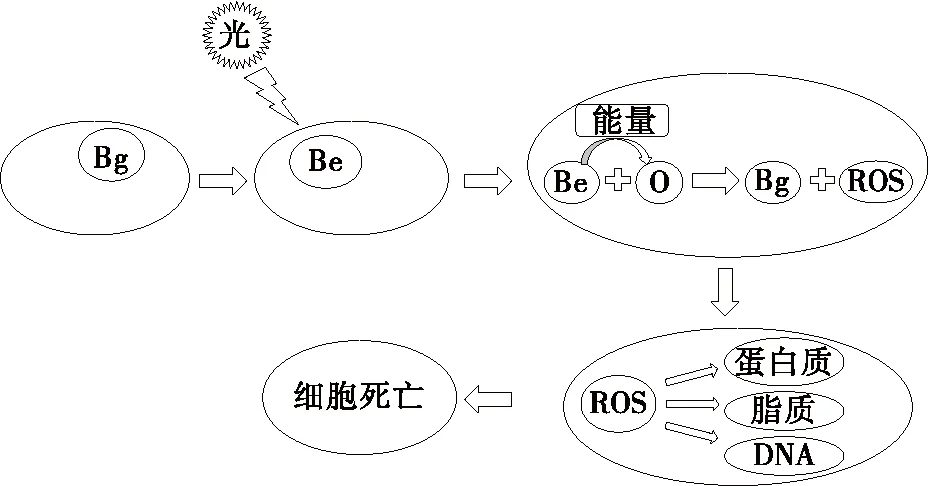
Bg. 基态卟啉 Be. 激发态卟啉 O. 氧化物 ROS. 活性氧图2 细胞光敏化破坏的机理Figure 2 Mechanism of destructive action of photosensitization in the cell
由图3可知,12 ℃时对照组中的大肠杆菌O157:H7数量变化并不明显(P>0.05)。说明在12 ℃下,大肠杆菌O157:H7的细胞活性较低,生长速率缓慢。在使用3种不同辐照强度的LED蓝光照射8 h后,大肠杆菌O157:H7的数量均呈现下降趋势(P<0.05)。辐照强度为141.4 mW/cm2的光照抗菌效果最好,曲线下降趋势最快(P<0.05),在试验8 h后,大肠杆菌O157:H7的数量相对于对照组减少了(2.60±0.19) lg CFU/mL。而在26.7,85.8 mW/cm2的辐照强度下光照8 h后大肠杆菌O157:H7 的数量相对于对照组仅减少了(1.17±0.13),(1.87±0.08) lg CFU/mL。同时可观察到,抗菌效果随着辐照强度的增加而增强。

图3 12 ℃下辐照强度对大肠杆菌O157:H7 抗菌效果的影响
Figure 3 Effects of irradiation intensity on antimicrobial activity ofEscherichiacoliO157: H7 at 12 ℃
由图4可知,25 ℃时对照组中的大肠杆菌O157:H7数量呈不断上升趋势(P<0.05),在8 h后增长至(8.16±0.16) lg CFU/mL。这表示在25 ℃下大肠杆菌O157:H7的细胞活性较强,生长速率较快。不难发现,在26.7 mW/cm2的辐照强度下光照8 h后,大肠杆菌O157:H7的数量仍然呈现上升趋势(P<0.05),与对照组相比其数量减少了(1.11±0.10) lg CFU/mL,说明在该辐照强度下,LED光照仅表现为减缓其生长速率的作用。而使用辐照强度为141.4 mW/cm2LED蓝光照射,其抑菌效果最好,在光照剂量达到4 072.3 J/cm2后,大肠杆菌O157:H7的数量相对于对照组减少了(2.82±0.10) lg CFU/mL。结合图3和图4可得出,无论温度如何,LED辐照强度对于营养肉汤中的大肠杆菌O157:H7抗菌效果均有较大的影响。但在室温下LED光照对大肠杆菌O157:H7细胞数量的控制不如低温下的明显,其原因可能是在低温环境下,细胞内抑制氧化应激反应的酶活性降低,导致活性氧无法被及时清除。另一种可能的解释是在低温条件下,细胞的细胞膜流动性减弱,从而抑制细胞的能量代谢,导致细胞对LED光照更加敏感[20]。
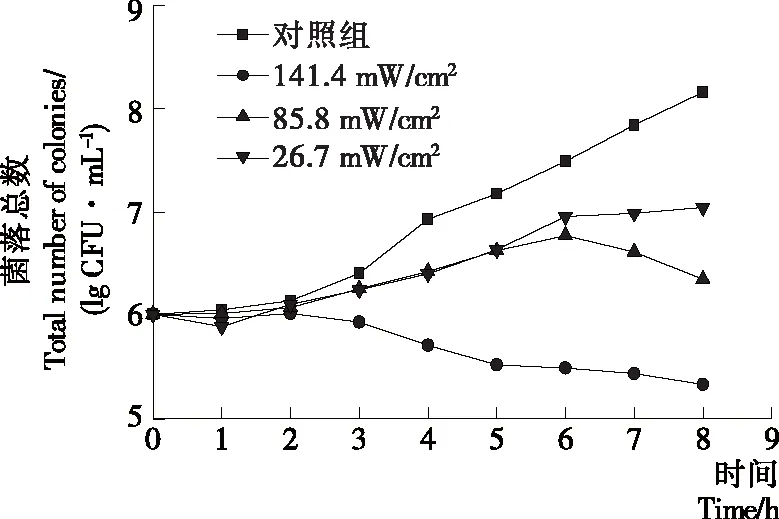
图4 25 ℃下辐照强度对大肠杆菌O157:H7 抗菌效果的影响
Figure 4 Effects of irradiation intensity on antimicrobial activity ofEscherichiacoliO157: H7 at 25 ℃
2.2 柠檬酸质量浓度对大肠杆菌O157:H7抗菌效果的影响
由图5可知,对照组中大肠杆菌O157:H7的数量变化趋势较平缓(P>0.05),培养8 h后仅增加了(0.04±0.02) lg CFU/mL。在试验组中添加质量浓度为0.2,0.5,1.0 g/kg 的柠檬酸培养8 h后,大肠杆菌O157:H7的数量与对照组相比分别减少了(0.07±0.02),(0.15±0.01),(0.24±0.03) lg CFU/mL。结果表明,在低温下,质量浓度为0.2,0.5,1.0 g/kg 的柠檬酸对于大肠杆菌O157:H7的生长影响较小。

图5 12 ℃下柠檬酸质量浓度对大肠杆菌O157:H7 抗菌效果的影响
Figure 5 Effects of the mass concentration of citric acid on on antimicrobial activity ofEscherichiacoliO157: H7 at 12 ℃
由图6可知,在室温下对照组中大肠杆菌O157:H7的数量显著增多(P<0.05),试验8 h后迅速增长至(8.16±0.05) lg CFU/mL。同一时期在添加质量浓度为0.2,0.5,1.0 g/kg 柠檬酸的试验组中,大肠杆菌O157:H7的数量分别为(7.28±0.15),(6.91±0.09),(6.37±0.09) lg CFU/mL,说明在室温下营养肉汤中的柠檬酸可延缓大肠杆菌O157:H7 的细胞生长速率。且随着柠檬酸质量浓度的提高,其对大肠杆菌O157:H7的生长抑制越明显。结合图5和图6发现,试验中添加的3种质量浓度的柠檬酸对于大肠杆菌O157:H7都有抑制作用,且在常温下的抑制效果均优于低温环境的。柠檬酸的抑菌作用主要是其能够穿过细菌的细胞膜,降低细胞内pH,还能够螯合金属离子,并破坏细胞中蛋白质以及细胞膜的合成系统。而在低温环境下,细菌的细胞膜流动性减弱,细胞代谢能量减缓,因此,与室温下相比,在低温条件下柠檬酸的抑菌效果较差。

图6 25 ℃下柠檬酸质量浓度对大肠杆菌O157:H7 抗菌效果的影响
Figure 6 Effects of the mass concentration of citric acid on on antimicrobial activity ofEscherichiacoliO157: H7 at 25 ℃
由图7可知,12 ℃时对照组光照8 h后,大肠杆菌O157:H7的数量减少至(4.18±0.04) lg CFU/mL。而添加质量浓度为0.2,0.5,1.0 g/kg柠檬酸的试验组光照8 h后,大肠杆菌O157:H7的数量均低于对照组(P<0.05),相对于对照组其数量分别减少了(1.72±0.08),(2.53±0.07),(3.30±0.14) lg CFU/mL。

图7 12 ℃下LED光照与柠檬酸对大肠杆菌O157:H7 的协同抗菌作用
Figure 7 Synergistic antimicrobial effects of LED and citric acid onEscherichiacoliO157: H7 at 12 ℃
由图8可知,25 ℃时对照组光照8 h后,大肠杆菌O157:H7的数量增加至(6.50±0.14) lg CFU/mL。而添加质量浓度为0.2,0.5,1.0 g/kg柠檬酸的试验组光照8 h后,大肠杆菌O157:H7的数量明显低于对照组(P<0.05),其数量相对于对照组分别减少了(2.40±0.19),(2.87±0.08),(3.57±0.24) lg CFU/mL。结合图7可知:无论温度如何,柠檬酸均可增强LED蓝光对于大肠杆菌O157:H7的抗菌效果,两者具有协同抗菌作用。其原因是柠檬酸可与细菌细胞壁中的Ca2+和Mg2+相结合,导致磷脂和脂蛋白的释放,使细胞壁的渗透性增加,进一步恶化细胞的状态。在LED光照期间,活性氧的主要目标是脂质和蛋白质,而柠檬酸可能通过将这些化合物暴露于活性氧中来促进LED光灭活[21]。

图8 25 ℃下LED光照与柠檬酸对大肠杆菌O157:H7 的协同抗菌作用
Figure 8 Synergistic antimicrobial effects of LED and citric acid onEscherichiacoliO157: H7 at 25 ℃
3 结论
本研究表明,LED蓝光可有效地灭活大肠杆菌O157:H7。同时食品中常用的柠檬酸,可显著提高LED蓝光对大肠杆菌O157:H7的抗菌效果。使用LED蓝光照射大肠杆菌O157:H7,当最大光照剂量为4 072.3 J/cm2时,大肠杆菌O157:H7数量能够有效减少(2~4) lg CFU/mL。而添加柠檬酸后,当最大光照剂量为2 471 J/cm2时,大肠杆菌O157:H7的数量能够减少(3~6) lg CFU/mL。因此,本研究在食品保鲜领域开辟了新方法,对于天然酸性食品如水果、蔬菜、肉类等都具有适用性。由于该方法需要的光照时间较长,因而在食品加工阶段的应用可能受到一定限制,但它有可能被用作食品的保鲜与储藏。后续研究将进一步评估该方法对其他食源性病原体的抗菌效果以及对真实食物基质的抗菌效果,因为细菌病原体的行为可能因生存环境中化合物的类型和含量的差异而发生变化。
[1] XUAN Weng, SURESH N. Ensuring food safety: Quality monitoring using microfluidics[J]. Trends in Food Science & Technology, 2017, 65: 10-22.
[2] SRIMAGAL A, RAMESH T, JATINDRA K S. Effect of light emitting diode treatment on inactivation ofEscherichiacoliin milk[J]. LWT-Food Science and Technology, 2016, 71: 378-385.
[3] LI Xiang, MOHAMMED F. A review on recent development in non-conventional food sterilization technologies[J]. Journal of Food Engineering, 2016, 182: 33-45.
[4] 孙彦琳, 苏树朋, 韩立英, 等. 高压CO2与超高压均质协同杀菌装置的研发[J]. 食品与机械, 2017, 33(1): 84-86.
[5] 黄瑞, 余小林, 胡卓炎, 等. 超声对荔枝汁中TAB的杀菌效果研究[J]. 食品与机械, 2014, 30(3): 214-217.
[6] AMIALI M, NGADI M O. Microbial decontamination of food by pulsed electric fields (PEFs) [J]. Microbial Decontamination in the Food Industry, 2012: 407-449.
[7] 张莹, 朱加进. 电子束辐照技术及其在食品工业中的应用研究[J]. 食品与机械, 2013, 29(1): 236-239.
[8] HAMAMOTO A, MORI M, TAKAHASHI A, et al. New water disinfection system using UVA light-emitting diodes[J]. Journal of Applied Microbiology, 2007, 103(6): 2 291-2 298.
[9] CRAIG D, YUK H G, GEK H K, et al. Application of light-emitting diodes in food production, postharvest preservation, and microbiological food safety[J]. Food Science & Technology, 2015, 14(6): 719-740.
[10] MITCHELL D B, NATHANIEL L R P, MARTIN D L, et al. Violet 405-nm light: a novel therapeutic agent against common pathogenic bacteria[J]. Journal of Surgical Research, 2016, 206(2): 316-324.
[11] KUMAR A, GHATE V, KIM M J, et al. Inactivation and changes in metabolic profile of selected foodborne bacteria by 460 nm LED illumination[J]. Food Microbiology, 2017, 63: 12-21.
[12] 冯志合, 卢涛. 中国柠檬酸行业概况[J]. 中国食品添加剂, 2011(3): 158-163.
[13] 陈晨, 胡文忠, 何煜波, 等. Nisin和柠檬酸对纯培养及鲜切黄瓜中单增李斯特菌的杀菌效果[J]. 食品工业科技, 2014, 35(5): 273-276.
[14] JACK A N, MAYRA M G. Comparison of multiple chemical sanitizers for reducing Salmonella andEscherichiacoliO157:H7 on spinach leaves[J]. Food Research International, 2015, 45(2): 1 123-1 128.
[15] KAHRAMAN O, LEE H, ZHANG Wei, et al. Manothermosonication (MTS) treatment of apple-carrot juice blend for inactivation ofEscherichiacoliO157:H7[J]. Ultrasonics Sonochemistry, 2017, 38(4): 820-828.
[16] GHADEER A R Y, SUAIFA N, ALHOGAIL S, et al. Paper-based magnetic nanoparticle-peptide probe for rapid and quantitative colorimetric detection ofEscherichiacoliO157:H7[J]. Biosensors and Bioelectronics, 2017, 92: 702-708.
[17] KIM J, KIM M, KIM S, et al. Sensitive detection of viableEscherichiacoliO157:H7 from foods using a luciferase-reporter phage phiV10lux[J]. International Journal of Food Microbiology, 2017, 254: 11-17.
[18] KIM M J, BANG W S, YUK H G. 405±5 nm light emitting diode illumination causes photodynamic inactivation of Salmonella spp. on fresh-cut papaya without deterioration[J]. Food Microbiology, 2017, 62: 124-132.
[19] ZIVILE L. New approach to inactivation of harmful and pathogenic microorganisms by photosensitization[J]. Food Techno-logy & Biotechnology, 2005, 43(4): 411-418.
[20] BEALES N. Adaptation of microorganisms to cold temperatures, weak acid preservatives, low pH, and osmotic stress: A review[J]. Comprehensive Reviews in Food Science & Food Safety, 2004, 3(1): 1-20.
[21] DELVES B J. The use of EDTA to enhance the efficacy of nisin towards Gram-negative bacteria[J]. International Biodeterioration & Biodegradation, 1993, 32(1/2/3): 87-97.

