Wnt/β-catenin信号通路在低氧促进骨肉瘤细胞体外增殖和侵袭中的作用
, , , ,
[陆军军医大学(第三军医大学)第一附属医院急诊科,重庆400038]
骨肉瘤(osteosarcoma,OS)是具有高度恶性的骨原发性肿瘤,多见于儿童及青少年群体,具有起病隐匿、生长速度快、肿瘤细胞过度增殖以及远处侵袭转移等特点[1-2]。虽然随着近年来医学进步,骨肉瘤的早期诊断与治疗取得了长足发展,但晚期骨肉瘤患者仍存在复发和远处转移的现象,因此深入研究骨肉瘤的异常增殖及其远处侵袭转移的分子作用机制对于预防晚期骨肉瘤的转移和扩散极为重要[3]。骨肉瘤作为实体瘤的一种,其异常增殖和快速生长会造成局部血供不足,不可避免地导致肿瘤局部缺氧微环境,进而对肿瘤细胞的凋亡、增殖、血管生成、分化、远处侵袭等生物学事件产生影响[4]。有学者指出,Wnt/β-catenin信号通路的异常激活与多种肿瘤的发生密切相关,其在骨肉瘤中也呈异常高表达[5]。但在缺氧条件下,骨肉瘤SaOS-2细胞中是否存在Wnt/β-catenin信号通路的异常激活,以及该通路对SaOS-2细胞增殖活性和侵袭转移的影响目前鲜有报道。本研究旨在通过模拟缺氧微环境,采用多种分子生物学方法来检测Wnt/β-catenin信号通路的表达水平及其对骨肉瘤细胞SaOS-2增殖和侵袭的影响。
1 材料与方法
1.1 材料
骨肉瘤SaOS-2细胞系购自武汉大学典型培养物保藏中心;TRIzol RNA提取试剂购自Takara公司;PCR引物的设计与合成均委托上海擎科生物科技公司制备完成;单克隆兔抗人β-catenin购自美国Abcam公司;辣根酶标记羊抗小鼠或抗兔IgG购自美国Santa cruz公司;Protein marker购自Thermo Fisher公司;ECL发光试剂盒购自Millipore公司;小牛血清购自GIBCO公司;RPMI-1640培养基购自HYCLONE公司;RIPA组织和细胞IP裂解液及BCA法蛋白浓度测定试剂盒均购自安徽洁洋盛生物科技公司;6孔、96孔培养板、25 cm2塑料培养瓶以及24孔Transwell小室(孔径8 μm)均购自美国Corning Costar公司;专业级缺氧环境培养箱购自于美国Thermo Fisher生物科技公司;普光倒置相差显微镜(日本Olympus公司)。
1.2 细胞培养
骨肉瘤SaOS-2细胞系在37 ℃恒温培养箱中培养,内含5%CO2,培养细胞的DMEM培养基含10%小牛血清、1%浓度青链霉素混合液。消化重悬后的细胞种于6孔板中,待细胞铺壁90%以上使用无血清培养基饥饿处理6 h后,置于低氧环境中继续培养不同时间段(8、16、24 h),最后对SaOS-2细胞进行相应指标的检测。常氧培养条件为37 ℃、5%CO2、20%O2(常氧组);低氧培养条件为37 ℃、5%CO2、1%O2(低氧组)。
1.3 CCK-8测定不同培养条件下的生长曲线
取生长状态较好的第3代骨肉瘤SaOS-2细胞系进行CCK-8实验。当细胞铺满达95%以上,使用胰酶消化后,依照2×104/mL的密度均匀种于96孔板中。常氧调剂和低氧调剂分别设置2个单独96孔板,每组设置6个复孔,分别于培养8、16、24 h后加入20 μL CCK-8试剂进行检测,37 ℃避光环境下孵育2~4 h后取出96孔板,随后使用酶标仪在450 nm波长条件下检测其吸光值(A),以时间(d)为横坐标,A为纵坐标绘制生长曲线。
1.4 RNA提取和Real-time PCR检测
使用冰上预冷PBS洗涤将处理完成的细胞洗涤3次,随后每个孔分别加入1 mL Trizol溶液,提取细胞总RNA为后续实验做准备。PCR所用引物由上海擎科生物科技公司上海分公司合成,引物序列如下:GAPDH上游引物5’-ATGGGGAAGGTGAAGGTCG-3’,下游引物5’-GGGTCATTGATGGCAACAATATC-3’;β-catenin上游引物5’-GCTGCTGTTTTGTTCCGAATGT-3’,下游引物5’-GCCATTGGCTCTGTTCTGAAGA-3’。反应条件均为:95 ℃,3 min预变性;94 ℃,30 s;48 ℃,30 s,72 ℃,1 min,扩增35个循环;72 ℃延伸10 min。
1.5 Western blot检测
将已处理好的骨肉瘤SaOS-2细胞系用PBS洗涤3次随后加入RIPA裂解液并用细胞刮刀刮下来放入1.5 mL EP管中冰上裂解30 min。随后于12 000 r/min离心10 min并将蛋白上清液冻存于-20 ℃。使用5X蛋白上样缓冲液混匀蛋白上清后于95 ℃中加热10 min,待其充分变性。上机跑电泳,随后转膜并置于5%脱脂牛奶中封闭1 h。封闭结束后使用TBST洗膜5 min×3次,随后将膜置于多克隆兔抗人的β-catenin(浓度1∶1 000)和多克隆兔抗人β-actin(浓度1∶3 000)中4 ℃孵育过夜。次日,洗膜5 min×3次后,置于辣根酶标记羊抗兔IgG中室温孵育2 h。TBST洗膜5 min×3次后,采用ECL化学发光法曝光显影。应用Quantity One软件分析条带灰度值并作统计分析。
1.6 Transwell实验检测细胞侵袭能力
将Matrigel胶(Matrigel原液与无血清培养基之比为1∶3)铺在小室上面,置于37 ℃培养箱中待用。将骨肉瘤SaOS-2细胞系在无血清DMEM培养基中饥饿处理4 h后,将其消化、重悬。上室加入无血清细胞悬液200 μL(细胞量4×105/mL),下室加入含20%FBS的DMEM高糖细胞培养基,每孔600 μL,培养箱中培养48 h。处理完成后取出小室,用PBS洗涤3次,并用湿棉签轻柔擦除上室面的细胞,随后置于4%多聚甲醛中固定20 min。取出室温下风干3~5 min,随后置于结晶紫染料中染色15 min。最后用PBS洗涤3次,并置于倒置显微镜下观察穿过微孔膜的细胞数量,并进行统计分析。
1.7 统计学方法
2 结果
2.1 低氧对骨肉瘤SaOS-2细胞系增殖的影响
对分别进行常氧培养和低氧培养的骨肉瘤SaOS-2细胞系进行细胞增殖能力检测。CCK-8结果显示,与常氧组相比,在低氧环境下培养的SaOS-2细胞系的增殖能力显著增强,而且随着低氧培养时间的延长增殖效应越显著,但至48 h增长率有所下降(图1)。

*:与常氧组比较,P<0.05
2.2 低氧对骨肉瘤细胞系侵袭的影响
Transwell侵袭实验检测结果显示,与常氧对照组相比,在低氧环境下培养24 h后的骨肉瘤SaOS-2细胞系的侵袭能力显著增强(图2)。
2.3 低氧对Wnt/β-catenin信号通路的影响
在常氧和低氧环境下培养骨肉瘤SaOS-2细胞系24 h后,分别采用RT-PCR和Western blot检测β-catenin的mRNA和蛋白表达。结果显示,与常氧组相比,低氧组SaOS-2的β-catenin mRNA和蛋白表达水平显著升高。表明低氧能够激活Wnt/β-catenin信号通路(图3)。
2.4 靶向β-catenin siRNA对Wnt/β-catenin信号通路的影响
转染β-catenin特异性siRNA及β-catenin-NC于骨肉瘤SaOS-2细胞系48 h后,分别采用RT-PCR和Western blot检测β-catenin mRNA和蛋白表达。结果显示与β-catenin NC组和空白对照组相比,β-catenin siRNA组的β-catenin明显下调(图4)。
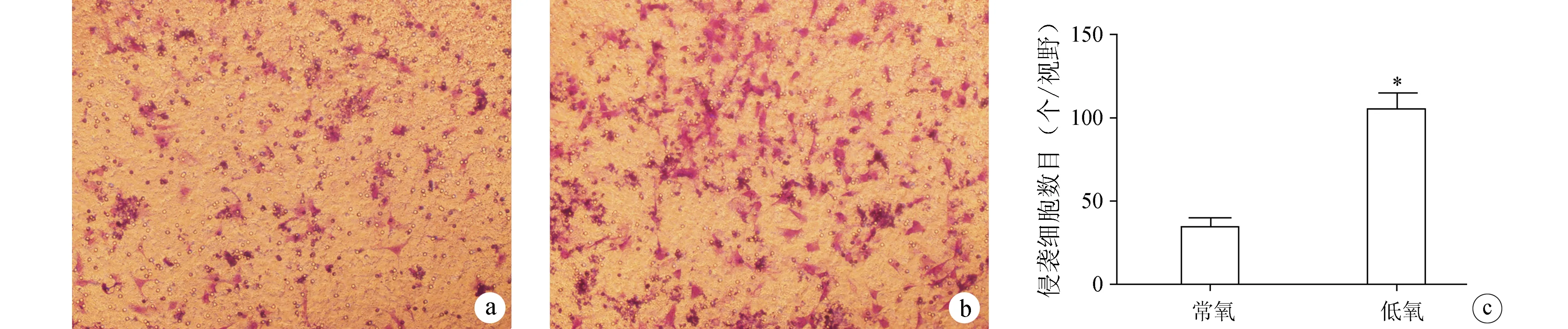
a:常氧;b:低氧;c:侵袭实验结果统计分析 *:与常氧组比较,P<0.05
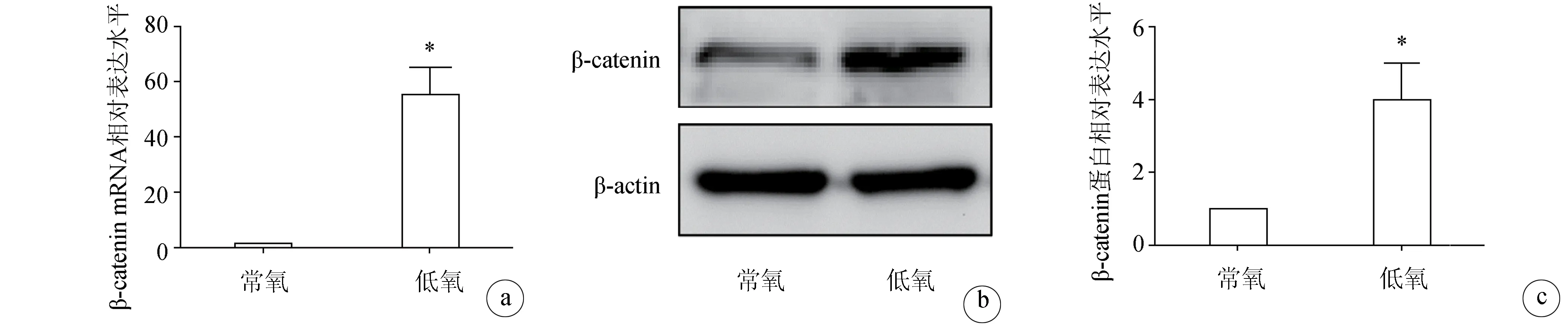
a:RT-PCR检测β-catenin mRNA表达;b:Western blot检测β-catenin蛋白表达;c:Western blot结果定量分析 *:与常氧组比较,P<0.05
图3低氧激活骨肉瘤细胞系SaOS-2的Wnt/β-catenin信号通路
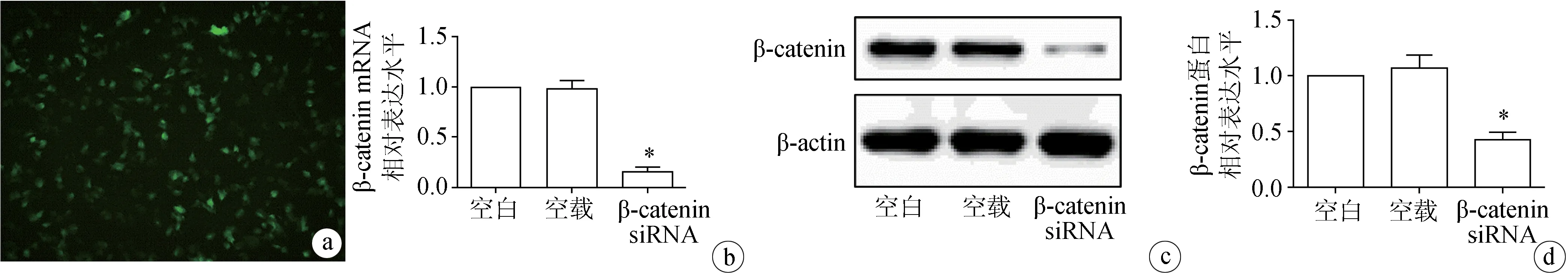
a:β-catenin si-RNA转染荧光图( ×200);b:RT-PCR检测β-catenin mRNA表达;c:Western blot检测β-catenin蛋白表达;d:Western blot结果定量分析
图4β-cateninsiRNA在骨肉瘤细胞系SaOS-2中有效沉默β-catenin
2.5 Wnt/β-catenin信号通路与低氧促进骨肉瘤细胞增殖相关
对分别进行常氧培养和低氧培养的骨肉瘤SaOS-2细胞系进行细胞增殖能力检测。CCK-8结果显示,与常氧组相比,在低氧环境下培养的SaOS-2细胞系随着培养时间的延长其增殖能力显著增强,而转染了β-catenin siRNA的细胞其增殖能力显著降低(图5)。
2.6 Wnt/β-catenin信号通路与低氧促进骨肉瘤细胞侵袭相关
在Transwell小室迁移实验中,我们发现低氧处理24 h后,与常氧对照组相比低氧转染NC处理组中SaOS-2细胞的侵袭能力显著增强,而转染β-catenin siRNA组的细胞侵袭能力被显著抑制(图6)。
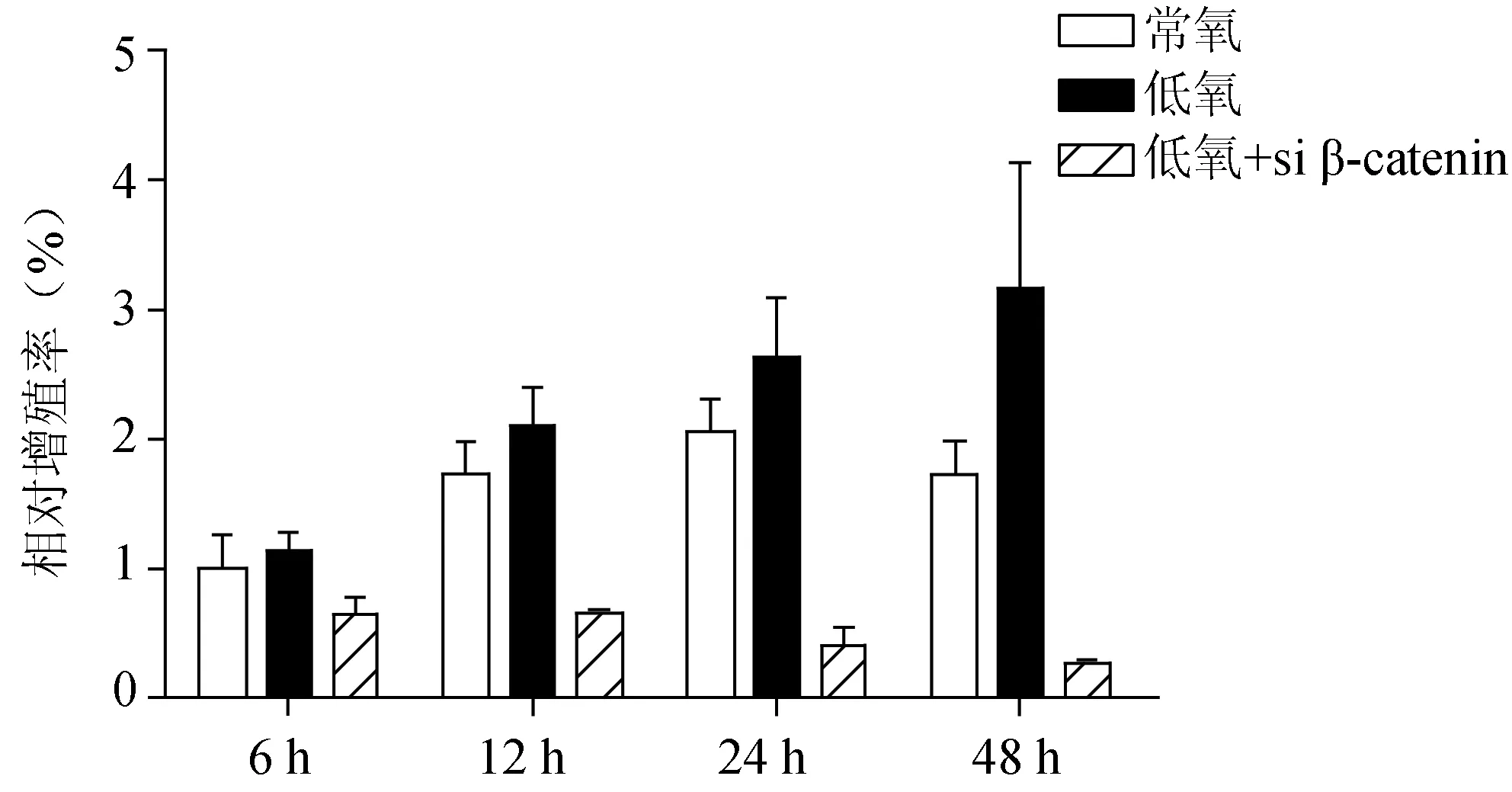
图5 靶向沉默β-catenin抑制低氧诱导的增殖

a:低氧;b:低氧+NC;c:低氧;d:低氧+β-catenin siRNA;e:侵袭实验结果统计分析;f:侵袭实验结果统计分析 *:与低氧组比较,P<0.05
图6靶向沉默β-catenin减弱低氧诱导的侵袭(结晶紫染色×200)
3 讨论
骨肉瘤是一种来源于骨髓间充质的高度恶性骨肿瘤,具有恶性程度高、局部生长迅速、易发生早期远处侵袭转移及复发等生物学特点[6-7]。骨肉瘤的发生发展是多因素、多步骤共同调控的结果,目前尚无有效治疗方法[8]。这一问题的根本原因在于80%的骨肉瘤患者在确诊时已发展到中晚期,且多已出现远处转移,其中以肺部转移最常见[9]。此外,在骨肉瘤的形成生长过程中伴随着肿瘤细胞的异常增殖,当局部肿瘤细胞的增殖速度远超过新生血管的生成速度时,最终将导致肿瘤实体中心部位缺乏足够的血液供应,形成缺血缺氧微环境[10-11]。肿瘤低氧微环境能够通过对肿瘤细胞的增殖和侵袭产生影响,从而干预肿瘤发生发展的进程[12-14]。因此,深入研究低氧微环境下骨肉瘤异常增殖以及侵袭转移的分子机制,定有效特异性防治靶点,寻求新的干预策略对提高骨肉瘤的临床疗效具有重要意义,是治疗骨肉瘤和改善临床预后的关键。
Wnt/β-catenin信号通路在生物体内细胞信息调控中发挥重要作用,其参与了细胞增殖、凋亡、胚胎发育及恶性肿瘤(包括骨肉瘤)等生物学过程[15-16]。此外,β-catenin还参与了多种不同肿瘤的发病过程,主要包括:食管癌、肝癌、胃癌以及骨肉瘤等,这些研究均显示β-catenin在这些肿瘤组织中呈现高表达[17-20]。有研究表明,在肿瘤低氧微环境下存在Wnt/β-catenin信号通路的激活,其通过调控下游靶基因对一系列诸如细胞增殖、分化、凋亡、侵袭等生物学事件进行干预,最终影响多种肿瘤的发生发展[21-24]。但是关于低氧微环境下Wnt/β-catenin信号通路在骨肉瘤发病中的作用及其分子机制目前的研究尚相对较少。
在本研究中,我们首先观察低氧微环境对骨肉瘤细胞系SaOS-2的增殖与侵袭能力的影响。结果表明,与常氧组相比,在低氧环境下培养24 h后SaOS-2的增殖速率显著高于常氧组,并伴随着侵袭能力的增强。进一步研究低氧环境下这一现象的分子机制,结果表明,在低氧环境下培养24 h后SaOS-2细胞中β-catenin表达水平显著升高,提示Wnt/β-catenin信号通路的异常激活可能参与低氧环境下骨肉瘤的异常增殖和侵袭过程。为了明确Wnt/β-catenin信号通路在其中的作用机制,我们采用β-catenin si-RNA来特异性沉默其表达,并进一步检测β-catenin沉默对细胞增殖和侵袭的影响。结果表明,靶向沉默Wnt/β-catenin信号通路之后,低氧介导的细胞增殖和侵袭能力显著降低,这一结果证实Wnt/β-catenin信号通路在骨肉瘤细胞的增殖和侵袭中起着关键作用。因此我们认为低氧微环境下Wnt/β-catenin信号通路的激活能够进一步调控下游靶基因转录激活,从而促进骨肉瘤细胞的异常增殖和远处侵袭转移,最终促进骨肉瘤的发生发展。
综上所述,在缺氧模拟条件下,Wnt/β-catenin信号通路能够显著激活,进而来促进骨肉瘤细胞SaOS-2细胞的异常增殖并增强细胞的远处侵袭能力,这一研究结果能够加深对骨肉瘤发病机制的了解。因此,深入研究Wnt/β-catenin信号通路在骨肉瘤发生、发展中的作用及其调节机制,通过靶向阻断Wnt/β-catenin信号通路相关分子,从而逆转骨肉瘤细胞的快速增殖和远处侵袭,这对于骨肉瘤的特异性治疗药物的开发和防治具有重要意义和良好的应用前景。
[参考文献]
[1] Anderson ME.Update on survival in osteosarcoma[J].Orthop Clin North Am,2016,47(1):283-292.doi:10.1016/j.ocl.2015.08.022.
[2] Isakoff MS,Bielack SS,Meltzer P,et al.Osteosarcoma:current treatment and a collaborative pathway to success[J].J Clin Oncol,2015,33(27):3029-3035.doi:10.1200/JCO.2014.59.4895.
[3] Bishop MW,Janeway KA,Gorlick R.Future directions in the treatment of osteosarcoma[J].Curr Opin Pediatr,2016,28(1):26-33.doi:10.1097/MOP.0000000000000298.
[4] Gilkes DM,Semenza GL,Wirtz D.Hypoxia and the extracellular matrix:drivers of tumour metastasis[J].Nat Rev Cancer,2014,14(6):430-439.doi:10.1038/nrc3726.
[5] Vilchez V,Turcios L,Marti F,et al.Targeting Wnt/beta-catenin pathway in hepatocellular carcinoma treatment[J].World J Gastroenterol,2016,22(2):823-832.doi:10.3748/wjg.v22.i2.823.
[6] Ottaviani G,Jaffe N.The epidemiology of osteosarcoma[J].Cancer Treat Res,2009,152:3-13.doi:10.1007/978-1-4419-0284-9_1.
[7] Picci P.Osteosarcoma(osteogenic sarcoma)[J].Orphanet J Rare Dis,2007,2:6.doi:10.1186/1750-1172-2-6.
[8] Luetke A,Meyers PA,Lewis I,et al.Osteosarcoma treatment:where do we stand?A state of the art review[J].Cancer Treat Rev,2014,40(4):523-532.doi:10.1016/j.ctrv.2013.11.006.
[9] Huang G,Nishimoto K,Yang Y,et al.Participation of the Fas/FasL signaling pathway and the lung microenvironment in the development of osteosarcoma lung metastases[J].Adv Exp Med Biol,2014,804:203-217.doi:10.1007/978-3-319-04843-7_11.
[11] Setty BA,Jin Y,Houghton PJ,et al.Hypoxic proliferation of osteosarcoma cells depends on arginase II[J].Cell Physiol Biochem,2016,39(2):802-813.doi:10.1159/000447790.
[12] Liu Y,Yan W,Tohme S,et al.Hypoxia induced HMGB1 and mitochondrial DNA interactions mediate tumor growth in hepatocellular carcinoma through Toll-like receptor 9[J].J Hepatol,2015,63(1):114-121.doi:10.1016/j.jhep.2015.02.009.
[13] Zhang M,Zhang W,Wu Z,et al.Artemin is hypoxia responsive and promotes oncogenicity and increased tumor initiating capacity in hepatocellular carcinoma[J].Oncotarget,2015,7(3):3267-3282.doi:10.18632/oncotarget.6572.
[14] Silva P,Mendoza P,Rivas S,et al.Hypoxia promotes Rab5 activation,leading to tumor cell migration,invasion and metastasis[J].Oncotarget,2016,7(20):29548-29562.doi:10.18632/oncotarget.8794.
[15] Jamieson C,Sharma M,Henderson BR.Targeting the β-catenin nuclear transport pathway in cancer[J].Semin Cancer Biol,2014,27:20-29.doi:10.1016/j.semcancer.2014.04.012.
[16] Song X,Xin N,Wang W,et al.Wnt/β-catenin,an oncogenic pathway targeted by H.pylori in gastric carcinogenesis[J].Oncotarget,2015,6(34):35579-35588.doi:10.18632/oncotarget.5758.
[17] Deng F,Zhou K,Cui W,et al.Clinicopathological significance of wnt/beta-catenin signaling pathway in esophageal squamous cell carcinoma[J].Int J Clin Exp Pathol,2015,8(3):3045-3053.
[18] Cheung PF,Cheung TT,Yip CW,et al.Hepatic cancer stem cell marker granulin-epithelin precursor and β-catenin expression associate with recurrence in hepatocellular carcinoma[J].Oncotarget,2016,7(16):21644-21657.doi:10.18632/oncotarget.7803.
[19] Yong X,Tang B,Xiao YF,et al.Helicobacter pylori upregulates Nanog and Oct4 via Wnt/β-catenin signaling pathway to promote cancer stem cell-like properties in human gastric cancer[J].Cancer Lett,2016,374(2):292-303.doi:10.1016/j.canlet.2016.02.032.
[20] Xiao X,Wang W,Wang Z.The role of chemotherapy for metastatic,relapsed and refractory osteosarcoma[J].Paediatr Drugs,2014,16(6):503-512.doi:10.1007/s40272-014-0095-z.
[21] Zhang Q,Bai X,Chen W,et al.Wnt/β-catenin signaling enhances hypoxia-induced epithelial-mesenchymal transition in hepatocellular carcinoma via crosstalk with hif-1α signaling[J].Carcinogenesis,2013,34(5):962-973.doi:10.1093/carcin/bgt027.
[22] Paige SL,Osugi T,Afanasiev OK,et al.Endogenous Wnt/β-catenin signaling is required for cardiac differentiation in human embryonic stem cells[J].PloS One,2010,5(6):e11134.doi:10.1371/journal.pone.0011134.
[23] Kavitha K,Kowshik J,Kishore TK,et al.Astaxanthin inhibits NF-κB and Wnt/β-catenin signaling pathways via inactivation of Erk/MAPK and PI3K/Akt to induce intrinsic apoptosis in a hamster model of oral cancer[J].Biochim Biophys Acta,2013,1830(10):4433-4444.doi:10.1016/j.bbagen.2013.05.032.
[24] Ji Q,Liu X,Fu X,et al.Resveratrol inhibits invasion and metastasis of colorectal cancer cells via MALAT1 mediated Wnt/β-catenin signal pathway[J].PloS One,2013,8(11):e78700.doi:10.1371/journal.pone.0078700.