纤维素复合气凝胶制备技术及其在生物医药领域的研究进展
付菁菁, 何春霞, 陈永生, 王思群*
(1. 农业部南京农业机械化研究所,江苏 南京 210014;2. 南京农业大学 工学院,江苏 南京 210031;3. 田纳西大学 再生碳中心,美国 诺克斯维尔TN37996)
气凝胶的概念首次是在1931年由Kistler教授提出的,这种低密度、高孔隙率、高比表面积、低导热系数、低介电常数以及独特结构的纳米材料使其具有广阔的发展前景[1]。在新一代气凝胶发展阶段,由于纤维素气凝胶兼具传统气凝胶的优良特性及自身优良生物相容性和可降解性而得到迅速发展[2]。纤维素及其制品的研究和应用已有将近150年的历史[3],而纤维素气凝胶仅在2001年首次合成[4],但纤维素气凝胶的优越特性和多功能性使其应用范围从药物载体、光催化、超级电容器[5-7],发展到燃料电池电极、相变储能材料[8-9]和废水处理、甲醛吸附[10-12]等。近年来关于纤维素气凝胶的研究方向主要是复合气凝胶的制备及其性能提高和新功能开发,从而拓宽纤维素气凝胶在更多领域的发展与应用。
已有文献对纤维素气凝胶在疏水吸油、电子等领域的应用进行了总结,本研究基于纤维素气凝胶功能性增强,系统地介绍和总结了纤维素复合气凝胶的制备技术及其在生物医药领域的研究进展,并对其发展前景进行了展望。
1 纤维素复合气凝胶的制备技术
1.1 纤维素气凝胶的制备过程
目前已有很多技术开发用于制备具有纤维素网络结构的气凝胶:纤维粘接技术、冷冻干燥、超临界流体技术、模压和盐析法、气体发泡法、快速成型法和静电纺丝技术等[13-16],其中冷冻干燥和超临界干燥是较常选用的制备方法。纤维素气凝胶的制备过程可分为四个步骤:纤维素的溶解或分散,凝胶的形成及老化,溶剂置换和凝胶干燥。由于纤维素分子间及分子内极强的氢键作用、复杂的聚集结构和结晶区的存在,使得纤维素很难溶于水和普通有机溶剂[17]。目前,已有文献对纤维素气凝胶的制备进行了综述,可通过直接溶解法或水相分散法提取纤维素[18],再选用合适的液体媒介贯穿三维结构形成凝胶,之后进行溶剂置换,最终经过超临界干燥、冷冻干燥或常压干燥[19]获得气凝胶。
1.2 纤维素复合气凝胶的制备技术
纤维素复合气凝胶的制备是基于纤维素气凝胶的制备基础,关键步骤是将其他纳米材料或基团并入纳米纤维素基体中(即对其进行改性)。纤维素复合气凝胶的多功能化归功于纤维素体系中生成的新基团或新成分,将其他材料或基团引入纤维素基体主要有以下三种不同的方式[20]:一是在纳米纤维素分散体系中直接添加或生成客体材料,二是在纳米纤维素材料的体相结构中构建客体材料,三是在纤维素表面直接包覆客体材料。
1.2.1 直接添加/生成法
直接添加/生成法即在纳米纤维素分散体系中直接添加或生成客体材料。直接机械混合法是最易实现的手段,如将碳纳米管(CNT)分散系和纤维素分散在碱性尿素水溶液环境下简单机械搅拌均匀形成 CNT-纤维素溶胶体系[21]。超声法也可实现客体材料与纤维素复合,如刘昕昕[22]使用超声法将氧化铁均匀分散于再生纤维素溶液中,再经溶剂置换和冷冻干燥即可得到纤维素/氧化铁复合气凝胶;卢芸[23]将超声法与化学处理结合“自上而下”制备出纳米纤丝化甲壳素气凝胶。在溶胶-凝胶过程中形成纤维素复合溶胶体系也是较常采用的方法:溶胶-凝胶法制得氧化铝溶液,再将水溶性羟乙基纤维素与其混合均匀、冷冻干燥制备出高强度的纤维素复合气凝胶[24]。其他方法还有紫外辐射法、光交联法:在TEMPO氧化的纳米纤维素分散体系中加入一定量的银盐(AgNO3),通过紫外辐射使得羧酸盐基团与Ag+链接,再经冷冻干燥可制备出柔性导电复合气凝胶[25];王静等[26]先通过机械混合法将细菌纤维素(BC)加入到聚乙烯醇-苯乙烯基吡啶盐缩合物(PVA-SbQ)溶液中得到复合溶液,再将PVA-SbQ/BC混合体系在紫外光(400 W)照射120 min以得到光交联PVA-SbQ/BC复合纳米材料,最后进行冷冻干燥后得到复合气凝胶。离子诱导凝胶法和化学还原法也有研究报道:Yao等[27]用离子诱导凝胶法制得纳米纤维素和氧化石墨烯(GO)的水溶液,再经过氢碘酸(HI)化学还原GO和冷冻干燥得到两亲性的超轻多功能石墨烯/纤维素复合气凝胶,可应用于压力响应传感器等。
1.2.2 构建客体法
该法与直接添加/生成法不同的是在纳米纤维素材料的体相结构中构建客体材料。由于纳米纤维素具有一定延展性且牢固的网状结构,是构建客体功能材料的优良模板或支架材料(template)。浸渍法是最简便形成纤维素模板支撑客体材料的方法:Liu等[28]通过简单浸渍法将纤维素水凝胶薄膜浸渍于FeCl3和CoCl2混合均匀的水溶液中,使再生纤维素网络结构作为纳米钴铁(CoFe2O4)的支架从而获得复合水凝胶体系,再经冻干法制得磁性纤维素复合气凝胶。其他方法还有原位法等,如吴鹏[29]通过原位合成法成功地将纳米Ag2O颗粒引入纤维素凝胶球网络中制备出Ag2O/纤维素气凝胶球,能较好吸附I2蒸汽;Wan等[30]采用一步低温水热法将 ZnO纳米棒嵌入纤维素气凝胶可用于光催化和压电等领域;权迪[31]采用环氧化反应使纤维素成功固载β-CD,再通过β-CD对茉莉精油的包载作用,可成功的把茉莉精油引入到纤维素高分子链中,使得纤维素具有一定的缓释功能。在气凝胶基体中负载活性化合物等[32]用于药物运载系统也是此方法应用的典型代表。
1.2.3 直接包覆法
在纤维素表面直接包覆客体材料,即对纤维素进行表面改性或涂层(coating改性):纤维素表面改性常用于改善纤维素在聚合物基体中的相容性和均匀分散性,涂层改性通常是使纤维素表面疏水化。常用的表面改性法是用 2,2,6,6-四甲基哌啶氧自由基(TEMPO)对纤维素进行氧化催化,通过引入醛和羧基等功能团使其衍生出新的工业用途[33]:如TEMPO氧化改性后,纤维素气凝胶微观形貌更为均匀,从而其力学性能得以提高[34]。聚合物接枝法是通过聚合反应使得聚合物的功能基团接枝到纤维素分子链上以拓宽纤维素气凝胶的多功能性:如聚乙烯亚胺(PEI)接枝纳米纤维素气凝胶具有较高药物运载能力[35]。化学气相沉积法(CVD)、原子层沉积法(ALD)是形成疏水涂层的常用方法:Zhai等[36]采用非定向冷冻干燥法制备聚乙烯醇(PVA)/纤维素复合气凝胶,再用三氯甲基硅烷 CVD法使得聚二甲基硅氧烷(PDMS)充分填充于气凝胶多孔结构中得到超疏水复合气凝胶;Korhonen等[37]选用ALD法将TiO2引入纤维素气凝胶基体,以获得疏水亲油性质,可反复利用吸附油性物质。使用涂层剂在纤维素表面形成疏水涂层也是简单且有效的方法:甲基三甲氧基硅烷(MTMS)[38]、三甲基氯硅烷(TMCS)[39]等是常用的涂层剂。除了化学涂层法,物理涂层法也可使纤维素气凝胶获得疏水表面,如已商业化的水喷淋技术(ReviveX®Nubuck)[40],此方法可应用于大批量生产中。
纤维素与其他材料,不论经物理方法还是化学方法复合制备的纤维素复合气凝胶,不仅具备了纤维素气凝胶本身优异的性能,还由于功能性材料的引入拓展了其特殊性能,使其应用领域日益广泛。
2 纤维素气凝胶在生物医药领域的应用
2.1 纤维素气凝胶在药物运载系统中的应用
传统的药物配方有很多不良反应,且大多数非类固醇抗炎药的血浆清除半衰期很短(2~4 h)[41];药物可溶性差也是药物开发需要考虑的因素之一。采用亲水性载体吸附药物时,药物分解率得以很大提高[42],因此药物控制释放技术应运而生,药物运载系统可提供相对稳定的释放率、降低毒性以及优化药物疗法,并且提高了病人的依从性和便利性[43]。一些聚合物被开发研制来实现药物控制与释放,如PE、PP、PDMS等,但它们大多数是合成物且不可降解[44-45]。纤维素等多糖物质的稳定性、可得性、可再生、可降解以及低毒性等性能使其成为药物释放系统的优良材料[46]。常见的药物释放系统包括离子交换树脂、薄膜、微球、凝胶等[47-50],具有开孔结构和高比表面积的纤维素气凝胶作为药物释放系统得到越来越多的关注。近年来纤维素气凝胶作为药物释放系统,重点研究方向是提升药效、载药量和药物有效期[50-51],但他们又受到很多因素的影响,如外界条件[52](pH值,温度等)、药物粒径、基体比例、可溶性等[53]。
在气凝胶基体上负载活性物质主要有两种途径:一是溶胶凝胶过程(凝胶前[54]或在溶剂置换期间[51]),二是在干燥后的气凝胶基体上负载[42,55]。作为药物释放系统的重要因素,释放率会随着填充量、形成药物负载时的压力、承载材料和药物表面积等的变化而变化[55]。气凝胶材料的质构特性(如密度、孔尺寸、比表面积等)也影响着药物在基体中的吸附行为,而且还是决定药物承载能力的关键因素[51]。基体的表面改性也对释药行为和包埋药物的药效率影响显著[56]。通常情况下,气凝胶的比表面积和孔体积越大,载药能力就越高,同时在高比表面积和网状结构气凝胶中药物的释放速率快,体外吸收也较快[57-58]。负载药物的凝胶常压干燥时会产生不能进行药物释放的气孔,超临界干燥可保证材料尺寸的稳定性[59]。Haimer等[32]选用高结晶度和大分子量的细菌纤维素并通过超临界二氧化碳干燥制备气凝胶,其收缩几乎为0,且使干燥与活性物质负载同时进行;同时由于材料稳定性好,在完成释放后还可重新载药再利用。药物承载能力不依赖于药物本身特性,而释放行为取决于承载物质,释放效率也取决于载物基体的厚度。原始纤维素的载药量很低,纤维素化学改性可有效改善释放能力和使用药效率,酰胺基由于可包覆大量带负电荷的药物分子而常被选为改性基团[60]。Zhao等[61]制备的聚乙烯亚胺(PEI)接枝纤维素复合气凝胶具有超高载药量,可达287.39 mg/g,药物吸附过程可用Langmuir等温线和伪二阶模型表示,药物释放实验表明,pH值和温度对气凝胶的控制释放行为影响显著(如图 1所示)。Valo等[50]从几种不同的纤维素原料(红辣椒、微晶纤维素、细菌纤维素、榅桲籽和TEMPO氧化的桦木纤维素)制备了纳米纤维素气凝胶药物释放系统,并探讨了生物质原料对二丙酸氯地米松药物释放率的影响。
2.2 纤维素气凝胶在组织工程等方面的应用
组织工程是为修复和重建人体组织损伤或功能障碍等问题而建立的一门以细胞生物学、材料科学、医学和工程学等相结合的学科,其基本原理主要是在体外支架材料上培养和扩增原机体中的活体组织,再将构建的带支架细胞植入机体损伤组织或器官部位,支架材料因降解、吸收而消失,培养的细胞逐渐增殖并分泌细胞外基质,最终达到修复和重建损伤组织或器官的作用[62-63]。组织工程细胞的培养需构建体外三维细胞培养模型,为细胞提供良好生长和代谢环境以及增强细胞培养体的扩散效率,因此,选择适宜三维多孔结构的支架材料是组织工程的关键问题。随着医学治疗技术的发展,在组织工程领域已取得了较快和较好的进展,但仍存在待提高和改善等问题;同时人们对组织工程材料也提出了更高的要求[64-65]。组织工程支架材料所要求的性能首先需对目标组织及其构成的细胞分子有一定的生物相容性和生物降解性,需要高孔隙率、大比表面积、均匀孔分布和一定的孔连通性以供足够的营养传输,还需一定力学性能达到组织替换时降解和再吸收力[66]。同时需针对不同人体组织满足特定性能指标,如骨组织需要具有一定的强度和密度,而皮肤组织则需要有密度低、弹性大和抗压强度低等特性。
气凝胶材料的优异性能使其成为理想的组织工程支架材料:孔隙率高且可调节可用于制备位于细胞外支架材料;与其他高孔隙率材料相比又具备较高力学性能;生物相容性主要由化学成分(化学上)和降解物(物理和力学上)决定的,气凝胶材料具有多变的化学组成可使其广泛应用于各个领域[67]。纤维素气凝胶在具备传统气凝胶特性的同时,还融入了自身的优异性能,在组织工程等方面具有很大的应用。Zaborowska等[68]在发酵过程中将300~500 µm的石蜡微球引入细菌纤维素支架材料后再去除石蜡微球,此方法合成的多孔细菌纤维素支架材料具有一定的力学强度,并成功在支架空隙中培养骨先质细胞MC3T3-E1,可应用于骨组织工程。Lu等[69]采用超声处理木粉从中分离出纳米纤维素并用高碘酸钠氧化得到二醛纳米纤维素,之后通过席夫碱与胶原联结合成纳米纤维素/胶原复合气凝胶,该气凝胶孔隙率可达90%~95%,具有超强吸水率(4 000%)以及生物相容性,细胞活性与繁殖性能高,可有效地用作组织工程支架材料和创伤敷料(图 2)。Zhang等[70]结合水/油乳化过程和冷冻干燥制得聚乙烯醇(PVA)/纳米纤维素气凝胶微球可在骨架结构中培养增殖胚胎成纤维细胞系NIH 3T3,该细胞主要用于转染及基因表达的研究,对预防、诊断和治疗各种疾病(如残障等)具有重要意义。
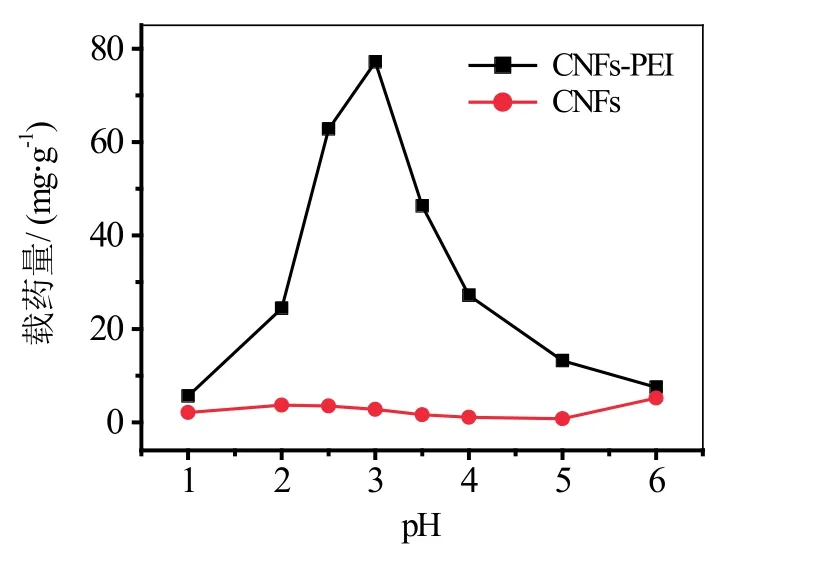
图1 pH值对CNFs-PEI气凝胶载药量的影响[61]
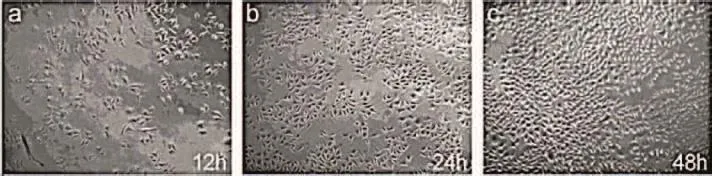
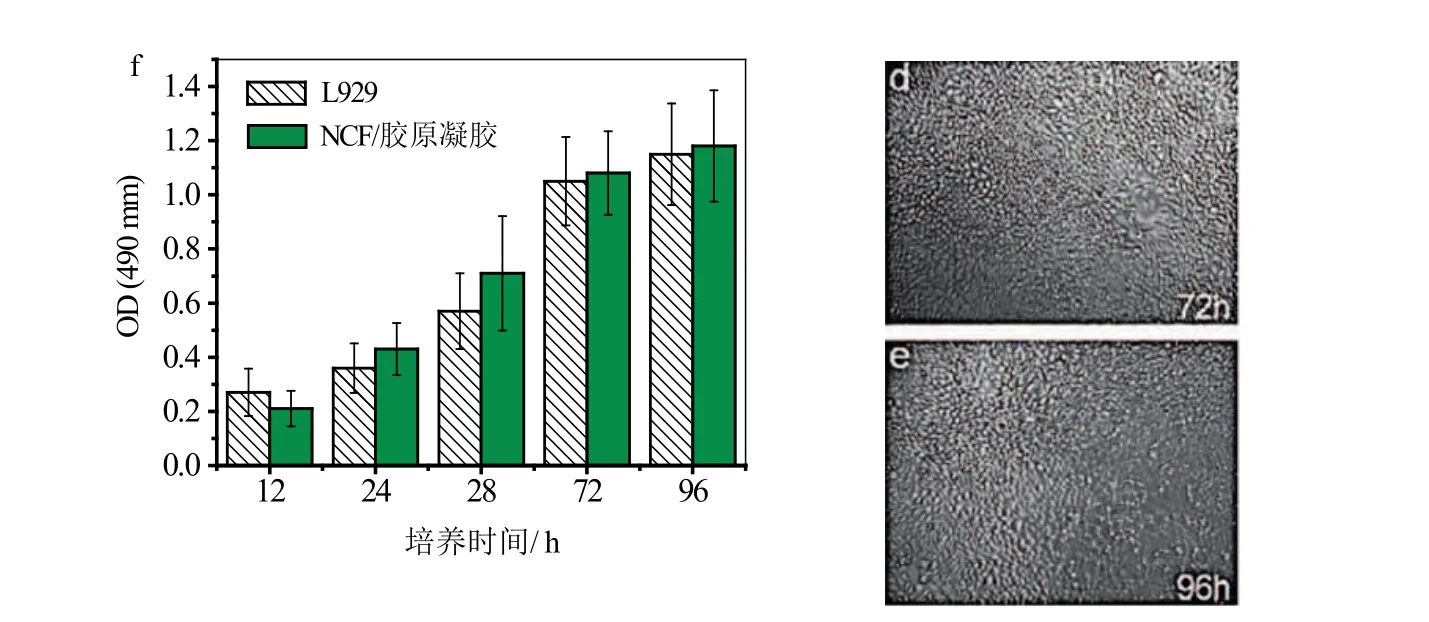
图2 (a~e)L929细胞在体外增殖的光学显微镜图片和(f)毒性测试[69]
3 总结与展望
纤维素气凝胶材料不仅继承了传统气凝胶的优异性能,还是一种绿色可再生材料。其来源广泛、生物相容性和生物可降解性优良,因而在生物医药等领域具有广泛的应用前景。纤维素气凝胶的制备过程包括纤维素的溶解/分散,凝胶的形成及老化,溶剂置换和凝胶干燥四个步骤,在此制备基础上,可通过三种方式:直接添加/生成法、构建客体法和直接包覆法使纤维素与其他材料复合从而制得多功能性的纤维素复合气凝胶。纤维素复合气凝胶在生物医药领域的应用主要为:在药物运载系统中作药物载体和在组织工程中做组织细胞/纤维的支架材料。目前对于纤维素气凝胶的研究已经取得了一定的进展,制备工艺简单且日益成熟,通过物理化学改性或复合使其具有疏水性、导电性、防火性、抗菌性等性能,可在吸附剂、医药载体、组织工程材料、吸音隔热材料、电子储能装置、模板材料、过滤材料、传感器和光电材料等领域广泛应用。但已有产品大都不能工业化大规模生产,纤维素气凝胶今后的发展方向将是集多功能于一体,满足各领域性能要求,降低生产制造成本,减少有毒化合物和溶剂的使用,形成可工业化生产的流水线。作为纳米科技中的一支新绿色队伍,纤维素复合气凝胶将会得到越来越广泛的应用。
参考文献:
[1] Aegerter M A, Leventis N, Koebel M M. Aerogels Handbook[M]. New York: Springer, 2011.
[2] Zou J, Liu J, Karakoti A S, et al. Ultralight multiwalled carbon nanotube aerogel[J]. ACS Nano, 2010, 4(12): 7293-7302.
[3] Yang X. Hydrogels and aerogels based on chemically cross-linked cellulose nanocrystals[D]. Hamilton: McMaster Unicersity,2014.
[4] Tan C, Fung B M, Newman J K, et al. Organic aerogels with very high impact strength[J]. Advanced Materials, 2001, 13(9):644-646.
[5] 张盼, 熊佳庆, 陶金, 等. 羟乙基纤维素基载银复合气凝胶的制备及性能[J]. 纺织导报, 2017, 25(3): 48-50.
[6] 林东瀚, 陈港, 方志强. 纳米纤维素复合气凝胶超级电容器的制备与性能[J]. 造纸科学与技术, 2017, 36(1): 28-35.
[7] 王培培, 王赟, 邹琛, 等. 柔性半导体气凝胶的定向构筑: 微纳多级结构的调控与性能研究[A]. 中国化学会, 第十三届固态化学与无机合成学术会议论文摘要集[C]. 中国化学会, 2014.
[8] Rooke J, de Matos Passos C, Chatenet M, et al. Synthesis and properties of platinum nanocatalyst supported on cellulose-based carbon aerogel for applications in PEMFCs[J]. Journal of The Electrochemical Society, 2011, 158(7): B779.
[9]杨静, 张恩薇, 李晓峰, 等. 纤维素/石墨烯气凝胶用于相变储能复合材料[A]. 中国化学会, 中国化学会第 30届学术年会摘要集-第十分会: 高分子[C]. 中国化学会, 2016.
[10]吴珍珍. 纤维素气凝胶功能材料的制备[D]. 东华大学, 2017.
[11]刘志明, 吴鹏. 壳聚糖/纤维素气凝胶球的制备及其甲醛吸附性能[J]. 林产化学与工业, 2017, 37(1): 27-35.
[12]廖骞. 功能性纤维素气凝胶的制备及其在水净化中的应用研究[D]. 浙江理工大学, 2017.
[13] Costa-Pinto A R, Correlo V M, Sol P C, et al. Osteogenic differentiation of human bone marrow mesenchymal stem cells seeded on melt based chitosan scaffolds for bone tissue engineering applications[J]. Biomacromolecules, 2009, 10(8):2067-2073.
[14] Sudheesh Kumar P T, Srinivasan S, Lakshmanan V, et al. β-Chitin hydrogel/nano hydroxyapatite composite scaffolds for tissue engineering applications[J]. Carbohydrate Polymers, 2011, 85(3): 584-591.
[15] Chung H J, Park T G. Surface engineered and drug releasing pre-fabricated scaffolds for tissue engineering[J]. Advanced Drug Delivery Reviews. 2007, 59(4-5): 249-262.
[16] Peng F, Shaw M T, Olson J R, et al. Hydroxyapatite needle-shaped particles/poly(l-lactic acid) electrospun scaffolds with perfect particle-along-nanofiber orientation and significantly enhanced mechanical properties[J]. The Journal of Physical Chemistry C, 2011, 115(32): 15743-15751.
[17] Lindman B, Karlström G, Stigsson L. On the mechanism of dissolution of cellulose[J]. Journal of Molecular Liquids, 2010,156(1): 76-81.
[18]马书荣, 米勤勇, 余坚, 等. 基于纤维素的气凝胶材料[J]. 化学进展, 2014, 26(5): 796-809.
[19] Tao D, Bai H, Liu S, et al. Research progress in the cellulose based aerogels materials[J]. Journal of Cellulose Science and Technology, 2011, 19(2): 64-75.
[20] Wei H, Rodriguez K, Renneckar S, et al. Environmental science and engineering applications of nanocellulose-based nanocomposites[J]. Environmental Science Nano, 2014, 1(4): 302-316.
[21] Qi H, Liu J, Pionteck J, et al. Carbon nanotube-cellulose composite aerogels for vapour sensing[J]. Sensors and Actuators B:Chemical, 2015, 213: 20-26.
[22]刘昕昕. 改性纤维素气凝胶的亲疏水特性研究[D]. 东北林业大学, 2016.
[23]卢芸. 基于生物质微纳结构组装的气凝胶类功能材料研究[D]. 东北林业大学, 2014.
[24]隋超. 纤维素掺杂SiO2与Al2O3柔性气凝胶的制备及性能表征[D]. 哈尔滨工业大学, 2015.
[25] Dong H, Snyder J F, Tran D T, et al. Hydrogel, aerogel and film of cellulose nanofibrils functionalized with silver nanoparticles[J]. Carbohydrate Polymers, 2013, 95(2): 760-767.
[26]王静, 王清清, 魏取福, 等. PVA-SbQ/细菌纤维素复合气凝胶的制备及吸油性能研究[J]. 功能材料, 2016, 47(3):3007-3010.
[27] Yao X, Yu W, Xu X, et al. Amphiphilic, ultralight, and multifunctional graphene/nanofibrillated cellulose aerogel achieved by cation-induced gelation and chemical reduction[J]. Nanoscale, 2015, 7(9): 3959-3964.
[28] Liu S, Yan Q, Tao D, et al. Highly flexible magnetic composite aerogels prepared by using cellulose nanofibril networks as templates[J]. Carbohydrate Polymers, 2012, 89(2): 551-557.
[29]吴鹏. 多孔改性纤维素凝胶球的制备及其吸附性能研究[D]. 东北林业大学, 2016.
[30] Wan C, Li J. Embedding ZnO nanorods into porous cellulose aerogels via a facile one-step low-temperature hydrothermal method[J]. Materials & Design, 2015, 83: 620-625.
[31]权迪. 纤维素气凝胶多孔材料的制备及改性应用[D]. 东北林业大学, 2016.
[32] Haimer E, Wendland M, Schlufter K, et al. Loading of bacterial cellulose aerogels with bioactive compounds by antisolvent precipitation with supercritical carbon dioxide[J]. Macromolecular Symposia, 2010, 294(2): 64-74.
[33] Bragd P L, van Bekkum H, Besemer A C. TEMPO-mediated oxidation of polysaccharides: Survey of methods and applications[J]. Topics in Catalysis, 2004, 27(1-4): 49-66.
[34] Silva T C F, Habibi Y, Colodette J L, et al. A fundamental investigation of the microarchitecture and mechanical properties of tempo-oxidized nanofibrillated cellulose (NFC)-based aerogels[J]. Cellulose, 2012, 19(6): 1945-1956.
[35] Zhao J, Lu C, He X, et al. Polyethylenimine-grafted cellulose nanofibril aerogels as versatile vehicles for drug delivery[J]. ACS Applied Materials & Interfaces, 2015, 7(4): 2607-2615.
[36] Zhai T, Zheng Q, Cai Z, et al. Poly(vinyl alcohol)/cellulose nanofibril hybrid aerogels with an aligned microtubular porous structure and their composites with polydimethylsiloxane[J]. ACS Applied Materials & Interfaces, 2015, 7(13): 7436-7444.
[37] Korhonen J T, Kettunen M, Ras R H A, et al. Hydrophobic nanocellulose aerogels as floating, sustainable, reusable, and recyclable oil absorbents[J]. ACS Applied Materials & Interfaces, 2011, 3(6): 1813-1816.
[38]骆金. 氧化硅-纤维素纳米晶气凝胶的微结构调控及性能研究[D]. 哈尔滨工业大学, 2016.
[39] Xiao S, Gao R, Lu Y, et al. Fabrication and characterization of nanofibrillated cellulose and its aerogels from natural pine needles[J]. Carbohydrate Polymers, 2015, 119(119): 202-209.
[40] Nguyen S T, Feng J, Ng S K, et al. Advanced thermal insulation and absorption properties of recycled cellulose aerogels[J].Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2014, 445(6): 128-134.
[41] Wang N, Xu T, Wu C, et al. Organic-inorganic hybrid anion exchange hollow fiber membranes: A novel device for drug delivery[J]. International Journal of Pharmaceutics, 2011, 408(1-2): 39-49.
[42] Smirnova I, Türk M, Wischumerski R, et al. Comparison of different methods for enhancing the dissolution rate of poorly soluble drugs: Case of griseofulvin[J]. Engineering in Life Sciences, 2005, 5(3): 277-280.
[43] Uhrich K E, Cannizzaro S M, Langer R S, et al. Polymeric systems for controlled drug release[J]. Chemical Reviews, 1999,99(11): 3181-3198.
[44] Cardamone M, Lofthouse S A, Lucas J, et al. In vitro testing of a pulsatile delivery system and its in vivo application for immunisation against tetanus toxoid[J]. J Control Release, 1997, 47(3): 205-219.
[45] Sintzel M B, Bernatchez S F, Tabatabay C, et al. Biomaterials in ophthalmic drug delivery[J]. European journal of pharmaceutics and Biopharmaceutics, 1996, 42: 358-374.
[46] García-González C A, Alnaief M, Smirnova I. Polysaccharide-based aerogels-Promising biodegradable carriers for drug delivery systems[J]. Carbohydrate Polymers, 2011, 86(4): 1425-1438.
[47] Kolakovic R, Peltonen L, Laukkanen A, et al. Nanofibrillar cellulose films for controlled drug delivery[J]. European Journal of Pharmaceutics and Biopharmaceutics, 2012, 82(2): 308-315.
[48] Kolakovic R, Peltonen L, Laukkanen A, et al. Evaluation of drug interactions with nanofibrillar cellulose[J]. European Journal of Pharmaceutics and Biopharmaceutics, 2013, 85(3): 1238-1244.
[49] Mohd Amin M C I, Ahmad N, Halib N, et al. Synthesis and characterization of thermo- and pH-responsive bacterial cellulose/acrylic acid hydrogels for drug delivery[J]. Carbohydrate Polymers, 2012, 88(2): 465-473.
[50] Valo H, Arola S, Laaksonen P, et al. Drug release from nanoparticles embedded in four different nanofibrillar cellulose aerogels[J]. European Journal of Pharmaceutical Sciences, 2013, 50(1): 69-77.
[51] Mehling T, Smirnova I, Guenther U, et al. Polysaccharide-based aerogels as drug carriers[J]. Journal of Non-Crystalline Solids,2009, 355(50-51): 2472-2479.
[52] Théron C, Gallud A, Carcel C, et al. Hybrid mesoporous silica nanoparticles with pH-operated and complementary H-bonding caps as an autonomous drug-delivery system[J]. Chemistry-A European Journal, 2014, 20(30): 9372-9380.
[53] Maderuelo C, Zarzuelo A, Lanao J M. Critical factors in the release of drugs from sustained release hydrophilic matrices[J].Journal of Controlled Release, 2011, 154(1): 2-19.
[54] Lee K P, Gould G L. Aerogel powder therapeutic agents: US, 6994842[P]. 2006-02-07.
[55] Smirnova I, Suttiruengwong S, Arlt W. Feasibility study of hydrophilic and hydrophobic silica aerogels as drug delivery systems[J]. Journal of Non-Crystalline Solids, 2004, 350(8): 54-60.
[56] Gorle B S K, Smirnova I, Arlt W. Adsorptive crystallization of benzoic acid in aerogels from supercritical solutions[J]. The Journal of Supercritical Fluids, 2010, 52(3): 249-257.
[57] Smirnova I, Suttiruengwong S, Seiler M, et al. Dissolution rate enhancement by adsorption of poorly soluble drugs on hydrophilic silica aerogels[J]. Pharmaceutical Development and Technology, 2004, 9(4): 443-452.
[58] Hindle M. Aerosol Drug Delivery[M]. John Wiley & Sons, Inc., 2008, 683-727.
[59] Liebner F, Haimer E, Wendland M, et al. Aerogels from unaltered bacterial cellulose: Application of scCO2drying for the preparation of shaped, ultra-lightweight cellulosic aerogels[J]. Macromolecular Bioscience, 2010, 10(4):349-352.
[60] Patri A K, Kukowska-Latallo J F, Baker Jr. J R. Targeted drug delivery with dendrimers: Comparison of the release kinetics of covalently conjugated drug and non-covalent drug inclusion complex[J]. Advanced Drug Delivery Reviews, 2005, 57(15):2203-2214.
[61] Zhao J, Lu C, He X, et al. Polyethylenimine-grafted cellulose nanofibril aerogels as versatile vehicles for drug delivery[J]. ACS Applied Materials & Interfaces, 2015, 7(4): 2607-2615.
[62]曹谊林. 组织工程学研究进展[J]. 上海交通大学学报(医学版), 2008, 28(7): 763-766.
[63] Butscher A, Bohner M, Hofmann S, et al. Structural and material approaches to bone tissue engineering in powder-based three-dimensional printing[J]. Acta Biomaterialia, 2011, 7(3): 907-920.
[64]杨春蓉. 骨组织工程支架研究现状及面临的问题[J]. 中国组织工程研究与临床康复, 2009, 13(8): 1529-1532.
[65]杨维, 崔占峰. 组织工程皮肤发展现状[J]. 中国科学:生命科学, 2015, 45(05): 460-470.
[66] Kanimozhi K, Khaleel Basha S, Sugantha Kumari V. Processing and characterization of chitosan/PVA and methylcellulose porous scaffolds for tissue engineering[J]. Materials Science and Engineering: C, 2016, 61: 484-491.
[67] Stergar J, Maver U. Review of aerogel-based materials in biomedical applications[J]. Journal of Sol-Gel Science and Technology, 2016, 77(3): 738-752.
[68] Zaborowska M, Bodin A, Bäckdahl H, et al. Microporous bacterial cellulose as a potential scaffold for bone regeneration[J].Acta Biomaterialia, 2010, 6(7): 2540-2547.
[69] Lu T, Li Q, Chen W, et al. Composite aerogels based on dialdehyde nanocellulose and collagen for potential applications as wound dressing and tissue engineering scaffold[J]. Composites Science and Technology, 2014, 94(4): 132-138.
[70] Zhang C, Zhai T, Turng L. Aerogel microspheres based on cellulose nanofibrils as potential cell culture scaffolds[J]. Cellulose,2017, 24(7): 2791-2799.

