一株鼠李糖乳杆菌的培养条件优化研究
罗素贤,叶 昱*,周信荣,陈燕君, 宋德平*,彭 棋,唐玉新*
(1.江西农业大学 动物科学与技术学院,江西 南昌 330045;2.江西省畜禽疫病诊断与防控重点实验室,江西 南昌 330045)
乳酸菌属于益生菌,主要存在于动物体肠道和阴道内[1]。它能改善肠道微环境,提高饲料利用率,促进动物生长性能[2],还能刺激免疫细胞,调节免疫应答,使机体免疫力持续处于较高水平[3]。随着我国畜牧养殖业中饲料添加抗生素产生的副作用日益明显,乳酸菌因其益生菌的功能而作为“绿色添加剂”获得广泛研究及应用[4]。鼠李糖乳杆菌是近年来研究最热门的乳酸菌之一,在肠道酸性环境定植,可以调节肠道菌群,预防和治疗腹泻,并且在机体排出毒素、预防龋齿和增强免疫等方面效果良好[5]。本试验以鼠李糖乳杆菌为对象,通过细菌形态学观察、生化试验和生长曲线等方面的测定,旨在确定鼠李糖乳杆菌生长最佳温度和最佳起始pH,探究溶氧量以及不同收获时间点对其生长的影响,了解鼠李糖乳杆菌体外培养的生长周期,为进一步研究乳酸菌菌群和乳酸菌作为饲料添加剂应用于生产实践中提供良好的参考。
1 材料与方法
1.1 材料
1.1.1 菌种 菌种鼠李糖乳杆菌(LGG)JX-1,由江西农业大学预防兽医教研室保存。
1.1.2 主要试剂 细菌微量生化反应管为杭州天和微生物试剂有限公司产品;脱脂奶粉为天津伊利乳业有限公司产品。
1.1.3 培养基 MRS液体培养基:称取MRS培养基粉末48 g,加入1 L水,充分搅拌溶解。MRS固体培养基:在MRS液体培养基的基础上,加入质量浓度为18 g/L的琼脂粉。
1.1.4 仪器设备 生化培养箱(型号:SPX-80 BSH-Ⅱ),上海新苗医疗器械制造有限公司生产;紫外可见分光光度计(型号:UV754N),上海佑科仪器仪表有限公司生产;pH计(型号:PHS-3C),上海仪电分析仪器有限公司生产等。
1.2 试验方法
1.2.1 细菌形态学观察 观察固体培养基中菌落的特点;经革兰氏染色后,在光学显微镜下观察细菌形态[6]。
1.2.2 生化试验 本研究使用微量生化反应管进行糖发酵试验、淀粉水解试验、明胶液化试验、硝酸盐还原试验;在种子液上滴加体积分数为3%~5%过氧化氢溶液,观察3~5 min进行过氧化氢试验[7]。
1.2.3 细菌生长最佳温度确定 本试验设置5个温度变量,分别在35 ℃、37 ℃、39 ℃、41 ℃和43 ℃培养乳酸菌。将活化好的鼠李糖乳杆菌按2%的量接种入5个锥形瓶中,每个温度重复3次,将锥形瓶分别标号并各置于5个温度条件下培养7 h后取出少量菌液,测定菌液OD600[8],探索鼠李糖乳杆菌的最适体外培养温度。
1.2.4 细菌生长初始pH确定 本试验在最适温度条件下培养细菌。以初始pH为变量,设置6组pH值,分别为5.5、6.0、6.5、7.0、7.5和8.0。每个锥形瓶中加入等量MRS培养基,盐酸溶液和碳酸钠溶液标定培养基至上述pH值,pH计测量并校准,经高压蒸汽灭菌后降至室温。按2%接种量将活化好的鼠李糖乳杆菌菌种液接入MRS培养基,每个pH重复3次,放入生化培养箱培养7 h后取出,测定各组OD600,确定最佳pH值。
1.2.5 溶氧量对细菌生长的影响 震荡培养基溶氧量高,静置培养基溶氧量低[9]。本试验在最适温度和pH条件下培养细菌,通过震荡培养(220 r/min)和静置培养两种方式改变溶氧量进行研究。以2%活化的菌种液分别接入MRS培养基,每种方式重复3次,分别放入恒温培养箱和震荡培养箱培养4 h和7 h取出测定OD600值。
1.2.6 细菌生长曲线绘制 在500 mL三角瓶中加入200 mL MRS培养基,2%接种量,在最适温度和pH条件下静置培养16 h,每2 h进行OD600测定、培养物的pH值测量及采用梯度稀释平板法进行细菌计数。使用Excel统计分析数据,计算并绘制pH、OD600变化曲线和细菌生长曲线。
2 结果分析
2.1 形态学特征和染色结果
细菌JX-1株的菌落呈淡黄色(图1),直径约1 mm的半圆形凸起,表面光滑、湿润,菌落边缘整齐,散发轻微酸味。革兰氏染色后置于100倍油镜下观察结果如图2,菌体革兰氏染色阳性,外形呈杆状,符合鼠李糖乳杆菌形态学特性[10]。

图1 细菌JX-1株菌落形态Fig.1 Colonial morphology of the JX-1 strain
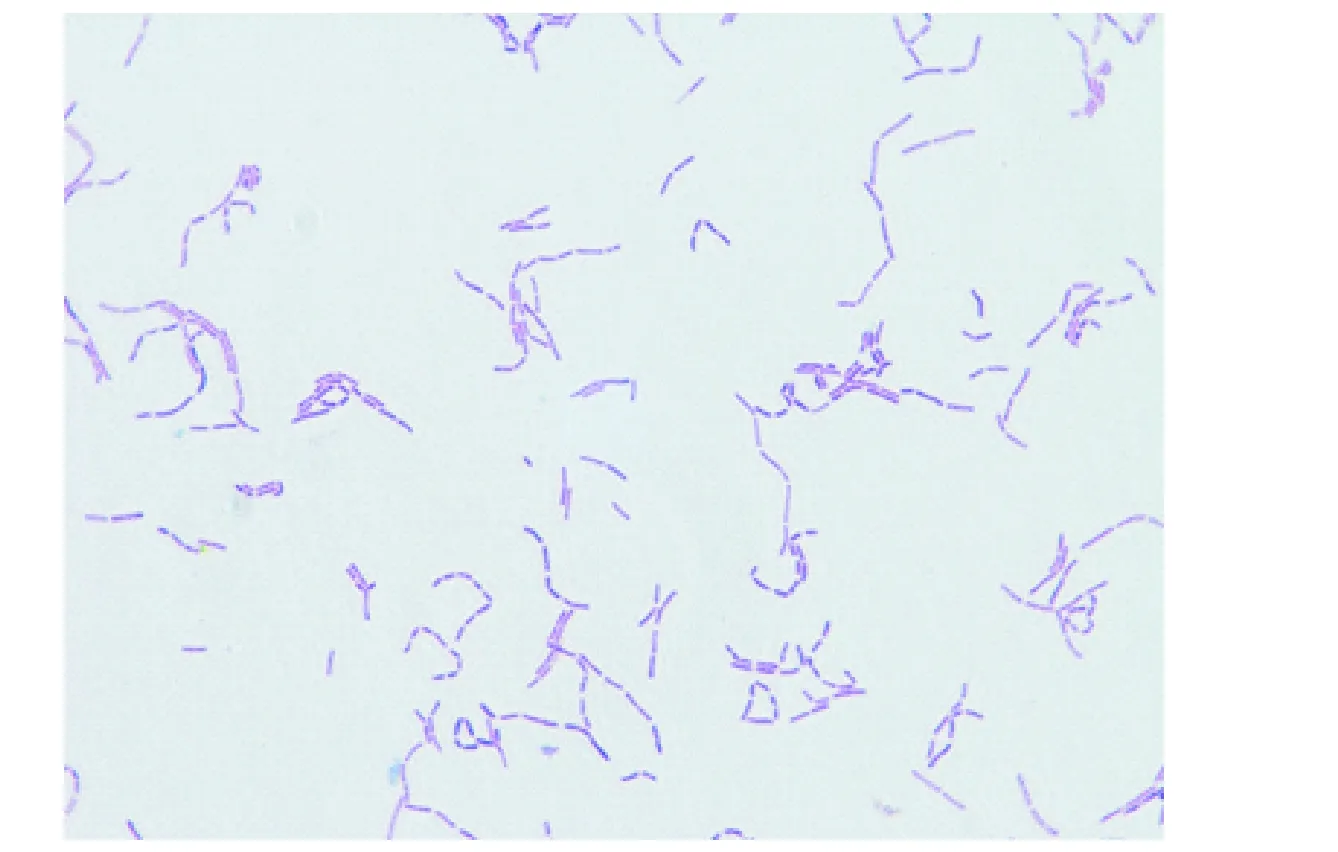
图2 革兰氏染色细菌形态(100×)Fig.2 Bacterial morphology with Gram staining(100×)
2.2 生理生化特征鉴定
过氧化氢酶试验结果显示,无气泡产生,呈阴性。经过生理生化特征检测(表1),结果表明该菌能利用果糖、鼠李糖、淀粉、蔗糖、麦芽糖、半乳糖、甘露醇、山梨醇、葡萄糖、甘露糖、靛基质、蕈糖,不能还原硝酸盐,不液化明胶。
综合生化鉴定、形态学分析和过氧化氢酶试验的结果,根据《伯杰氏鉴定细菌手册》及《乳酸细菌分类鉴定及试验方法》判断该菌为鼠李糖乳杆菌[11]。
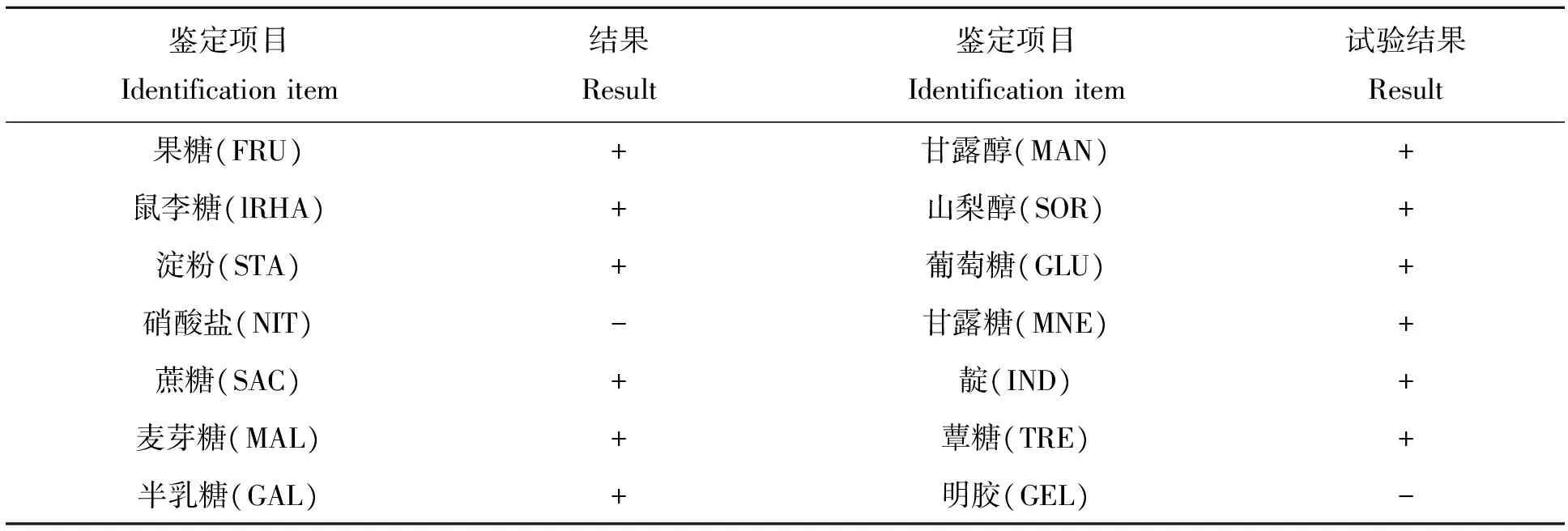
表1 生理生化试验结果
“+”为阳性;“-”为阴性
“+” means positive;“-” means negative
2.3 最适生长温度
温度高于或低于最适生长温度,生长速率都会随之下降[9]。本试验发现在35~43 ℃内,鼠李糖乳杆菌均能生长(图3)。而且随着温度的升高,鼠李糖乳杆菌的生长呈现升高趋势,其菌体量在39 ℃达到峰值(OD值为1.158)。随着培养温度进一步升高,鼠李糖乳杆菌菌体生长呈现明显的下降趋势。以上结果表明,鼠李糖乳杆菌的最适培养温度为39 ℃。
2.4 最佳起始pH值结果
图4所示的起始pH结果表明,鼠李糖乳杆菌适合于中性偏酸性环境下生长,其中以6.0的初始pH最佳。当初始pH高达8.0时,鼠李糖乳杆菌的繁殖受到较大影响,其菌液OD600值与pH 6.0相差0.595。
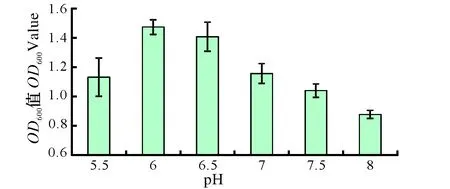
图4 初始pH对鼠李糖乳杆菌生长影响Fig.4 Growth curve of LGG on various initial pH
2.5 溶氧量影响结果
分别测定了静置培养和震荡培养两种培养方式对鼠李糖乳杆菌生长的影响,其4 h和7 h的菌液OD600差值分别为0.045和0.178(表2),且4 h时静置培养的菌体量显著高于震荡培养(P=0.039 4),7 h时静置培养的菌体量极显著高于震荡培养(P=0.05)。本试验结果说明,溶氧量较高的震荡培养,不利于鼠李糖乳杆菌生长。
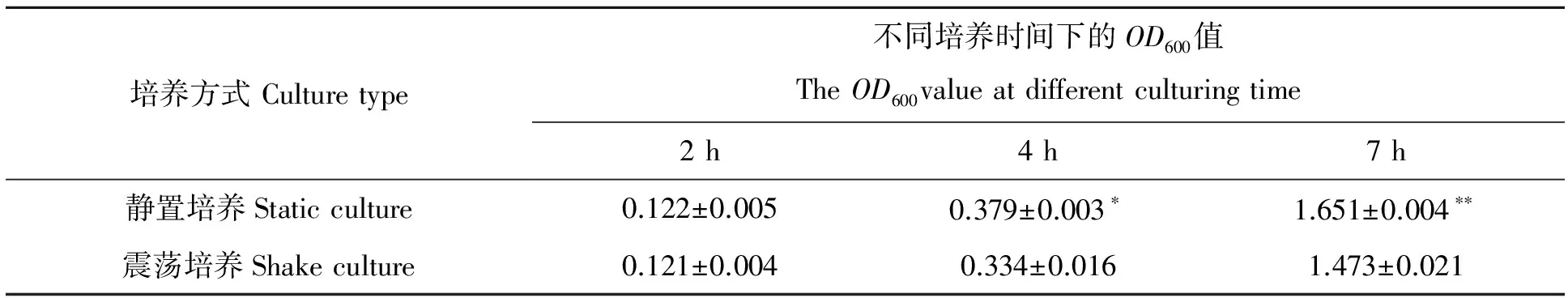
表2 不同培养方式的生长结果
*表示差异5%水平显著性,**表示差异1%水平显著性。
* significant at 0.05 level,** significant at 0.01 level.
2.6 生长曲线绘制结果
从图5可知,鼠李糖乳杆菌繁殖引起培养基pH值降低,说明其生长代谢产生大量酸性物质(乳酸)。与其他很多微生物不同,除了营养物质消耗等因素制约外,乳酸菌还受代谢过程产酸而形成对自身的酸抑制的影响。细菌代谢产生的有机酸溶于培养基中,随着培养时间逐渐积累,造成菌体周围环境pH值下降,严重干扰乳酸菌正常代谢,抑制其繁殖。在图5中,OD600值曲线呈S形,说明菌体存在一个加速繁殖到平稳生长的时期,而pH值曲线显示在菌体加速繁殖时期乳酸也在大量产生。以上结果反映了菌体加速生长引起产生乳酸,大量乳酸积累反过来降低菌体生长速率的现象。

图5 pH、OD600变化曲线 Fig.5 The curves show pH and OD changes with the culture of LGG
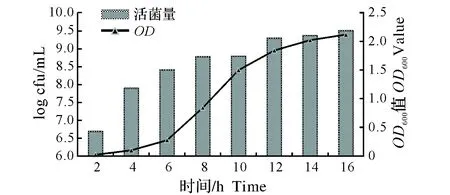
图6 生长曲线Fig.6 Growth curve of LGG
如图6所示,活菌量计数结果发现0~2 h,鼠李糖乳杆菌接种培养基后适应新环境,经历迟缓期;2~4 h细菌生长进入对数期,以指数级速度增殖,菌量上升最快,4 h时菌量达到108cfu/mL。而OD600值曲线显示6~8 h总菌数上升最快;并且在6 h时,活菌量高而OD600值较低,可能与该阶段菌体较小导致OD600测量值偏低有关。因此,鼠李糖乳杆菌生物量的实时检测时,活菌量的变化较OD600曲线准确。活菌量与OD600曲线测定均显示,10 h后,随着营养物质消耗,乳酸含量升高,活菌数上升逐渐减弱,OD600值上升趋势逐渐平缓,说明该菌群进了稳定期。
3 讨 论
鼠李糖乳杆菌是乳酸菌群中一员,是最常用的益生菌,也是最具代表性的菌株[12]。它能抗氧化、促吸收,从而提高机体免疫力,对于生产生活也有十分积极的作用[13]。然而发挥益生作用不仅仅需要代谢产物,菌体活性也十分关键。活性菌体进入动物胃肠道后,将部分蛋白质、糖类和维生素等降解成小分子物质,促进动物体吸收营养[14]。所以在优化培养条件下,研究鼠李糖乳杆菌生长特性与菌体活性的关系,有助于该菌的工业化生产与实践应用。本试验绘制生长曲线采用活菌计数、OD600值测定和pH值测定同时进行,旨在充分展示鼠李糖乳杆菌生长过程中活菌数、总菌数和产酸程度之间的联系。结果表明温度39 ℃、pH值6.0静置培养6 h,活菌数占总菌数比重最高,产酸速率随培养时间累积逐渐加快。
在不考虑溶氧量影响的情况下,培养基营养分布越均匀,细菌的长势越好。震荡培养条件下,营养分布较静置培养更加均匀,但试验结果显示鼠李糖乳杆菌更适宜静置培养,上述结论与古元懿[9]的试验结果相一致,说明静置和震荡两种培养方式创造了相对不同的溶氧量环境,而且溶氧量环境对鼠李糖乳杆菌培养的影响较大。
参考杨子萱等[15]研究结果,按2%接种鼠李糖乳杆菌培养7 h,取样测定OD600值反映菌液长势情况。上述方法与陈佩等[10]培养18 h不同。因此,上述因素可能导致了本试验最佳温度与其研究结果的不同,说明鼠李糖乳杆菌在37 ℃与39 ℃的生长曲线可能呈交叉的“S”形,而且随着培养时间延长,最适温度会有所降低,具体的机理还有待进一步研究。另外,大多数家畜、家禽的体温均高于37 ℃。本试验最适温度结果能够更好地模仿鼠李糖乳杆菌在动物体肠道内的温度环境。因此,绘制39 ℃的生长曲线可能较37 ℃更具实际意义。
参考文献:
[1] Gong Y H,T L S L.Achieving high yield of lactic acid for antimicrobial characterization in cephalosporin resistanceLactobacillusby the co-expression of the phosphofructokinase and glucokinase[J].J Microbiol Biotechnol,2016,26(1):2.
[2] 代永刚,田志刚,南喜平.乳酸菌及其生理功能研究的进展[J].农产品加工(学刊),2009(7):24-26,29.
Dai Y G,Tian Z G,Nan X P.Progress of theLactobacillusand its physiological function[J].The processing of agricultural products,2009(7):24-26,29.
[3] 张友华,胡怀容,鲜欣言,等.荣昌猪肠道乳酸菌筛选及鉴定[J].西南大学学报(自然科学版),2016,38(9):6-11.
Zhang Y H,Hu H R,Xian X Y,et al.Isolation and identification of lactic acid bacteria from intestinal tract of Rongchang pig[J].Journal of Southwest University(Natural Science Edition),2016,38(9):6-11.
[4] 郭志杰.仔猪源乳酸菌的筛选及其对仔猪作用的影响[D].哈尔滨:东北农业大学,2012.
Guo Z J.Screening ofLacticacidbacteria isolated from piglet and its effect on piglets[D].Harbin:Northeast Agricultural University,2012.
[5] 赵乙桢,沈雷,孙亚链,等.鼠李糖乳杆菌ZJ225细菌素的分离纯化及其特性研究[J].中国食品学报,2015,15(7):54-60.
Zhao Y Z,Shen L,Sun Y L,et al.Separation and purification of a bacteriocin produced byLactobacillusrhamnosusZJ225 and characteristic study[J].Journal of Chinese Institute of Food Science and Technology,2015,15(7):54-60.
[6] 杨杨,石超,郭旭生.高寒草甸魏斯氏乳酸菌的分离鉴定及理化特性研究[J].草业学报,2014,23(1):266-275.
Yang Y,Shi C,Guo X S.Characterization and identification ofWeissellaspecies isolated fromKobresialittledaleigrowing in alpine meadows[J].Acta Prataculturae Sinica,2014,23(1):266-275.
[7] 叶青.性状优良乳酸菌的筛选分离鉴定及生物学特性研究[D].南昌:江西农业大学,2014.
Ye Q.Research on excellentLacticacidbacteria isolation and idetification and its biological characteristics[D].Nanchang:Jiangxi Agricultural University,2014.
[8] 陆爱华.浓缩型乳酸菌发酵剂制备工艺的研究[D].合肥:安徽农业大学,2006.
Lu A H.The research of technology about concentrated starter ofLacticacidbacteria[D].Hefei:Anhui Agricultural University,2006.
[9] 古元懿.乳酸菌高密度培养及冻干工艺的研究[D].哈尔滨:东北林业大学,2008.
Gu Y Y.Study on the high-density cultivation and freeze-drying Processing ofLacticacidbacteria[D].Harbin:Northeast Forestry University,2008.
[10] 陈佩,党辉,王伟,等.具有降糖作用的鼠李糖乳杆菌生物学特性研究[J].食品工业科技,2016,37(21):162-165,171.
Chen P,Dang H,Wang W,et al.Biological characteristics ofLactobacillusrhamnosuswith antidiabetic activity[J].Science and Technology of Food Industry,2016,37(21):162-165,171.
[11] 陈宇强,曾敏,潘丽媚.鼠李糖乳杆菌生物学特性及功能特性研究进展[J].科技信息,2010(20):357.
Chen Y Q,Zeng M,Pan L H.The Advances ofLactobacillusrhamnosusinin biological characteristics and functional characteristics[J].Science&Technology Information,2010(20):357.
[12] 黄琴,黄怡,崔志文,等.鼠李糖乳杆菌对巨噬细胞先天性免疫应答的调节作用[J].中国农业科学,2012,45(8):1621-1626.
Huang Q,Huang Y,Cui Z W,et al.Modulation ofLactobacillusrhamnosuson innate immuneresponses in macrophages[J].Scientia Agricultura Sinica,2012,45(8):1621-1626.
[13] 刘玉婷,吴明阳,靳艳玲,等.鼠李糖乳杆菌利用甘薯废渣发酵产乳酸的研究[J].中国农业科学,2016,49(9):1767-1777.
Liu Y T,Wu M Y,Jin Y L,et al.Lactic acid fermentation byLactobacillusrhamnosusfrom sweet potato residue[J].Scientia Agricultura Sinica,2016,49(9):1767-1777.
[14] 刘艳姿.乳酸菌的生理功能特性及应用的研究[D].秦皇岛:燕山大学,2010.
Liu Y Z.The investigation on physiology functional characterisics of Lactic acid bacteria and its applications[D].Qinhuangdao:Yanshan University,2010.
[15] 杨子萱,李晨,卢海强,等.鼠李糖乳杆菌原生质体制备与再生[J].中国食品学报,2015,15(12):39-46.
Yang Z X,Li C,Lu H Q,et al.Protoplasts preparation and regeneration condition ofLactobacillusrhamnosus[J].Journal of Chinese Institute of Food Science and Technology,2015,15(12):39-46.

