胆道闭锁胆管细胞破坏与修复的研究进展
熊希倩,詹江华
胆道闭锁(biliary atresia,BA)以肝内、外胆管梗阻,进行性炎症及肝纤维化为主要病理特征,早期行葛西(Kasai)手术虽可改善胆汁淤积,但不能终止肝纤维化进程[1-2]。胆管上皮细胞受损后,可引发一系列炎症反应,使胆管细胞破坏、增殖和胆管结构重建[3]。研究表明,增生的胆管细胞以非成熟胆管上皮细胞为主,而这些不成熟胆管上皮细胞在短时间内迅速增生,可能是BA胆管纤维化迅速恶化的主要原因[4]。本文就胆管细胞破坏及其修复过程进行综述。
1 胆管结构改变
胆管分为肝内胆管和肝外胆管,Kasai手术能够解除肝外胆道梗阻症状,但无法改变肝内胆管结构,因此BA患儿在Kasai术后仍表现为进行性肝内小胆管破坏、胆汁淤积、肝硬化。BA肝内胆管早期改变为汇管区水肿、胆管增生、毛细胆管淤胆、中性粒细胞和淋巴细胞浸润,部分可见汇管区周围肝细胞化生为胆管细胞,与增生胆管相互连接;晚期大量间质成分增生,汇管区出现纤维化及桥接坏死,胆管管腔狭窄或闭锁,胆管上皮细胞正常结构受到破坏。电镜下超微结构可见胆管上皮细胞变性、空泡形成、细胞核固缩、胞质萎缩及基底膜增厚、内质网扩张、线粒体肿胀、毛细胆管上皮微绒毛缺失或形态异常,以上为BA肝内胆管基本病变[5]。Obayashi等[6]利用门管区胆管数量/门管区测量面积(the number of the bile ducts in the portal canal/measured surface area of the portal canal,BDP)比值作为BA患者Kasai术后预后指标,发现预后差(死亡或肝移植)的BDP比值为1.19±0.42,而预后好(自体肝生存)的BDP比值为1.64±0.53(P=0.04),说明胆管数量与BA预后密切相关。刘丹丹等[7]证实Kasai术后肝门区胆管直径总和大于300 μm的BA患儿比胆管直径总和小于100 μm者预后好。然而能通畅引流胆汁功能的肝内胆管的直径和数量,以及肝内胆管的直径、数量与BA预后的关系等方面研究报道较少。
2 胆管上皮细胞破坏
2.1 围生期病毒感染 围生期多种病毒感染均与BA相关,其中轮状病毒感染与BA关系的研究较为深入,不仅在BA患儿肝脏检测到了轮状病毒,新生鼠感染轮状病毒还能制作出小鼠的BA模型。德国学者Petersen[8]给新生鼠腹腔注射恒河猴轮状病毒(rhesus monkeys rotavirus,RRV),可观察到约75%的新生鼠发生与人类BA完全一致的肝内外胆管损伤,现已成为目前研究BA发病机制的标准模型[9-12]。RRV是一种二十面体、无包膜、双链RNA病毒,具有三层蛋白质衣壳(VP4、VP6和VP7)。Lobeck等[10]发现轮状病毒诱导的BA小鼠会依赖VP6蛋白引起的细胞外信号相关激酶(ERK)磷酸化,并引发钙内流,促进病毒在胆管细胞中复制,病毒产量不断增加。
轮状病毒受体包括整联蛋白α2β1、α4β1、αVβ3和αXβ2,整联蛋白是一类分布广泛的黏附受体,可以激活多种信号通路,从而在细胞黏附、增殖、分化、迁移、抗细胞凋亡等方面发挥重要作用。轮状病毒非结构蛋白4(non structural protein 4,NSP4)是由第10位基因编码的跨内质网膜糖蛋白,其对病毒的形态发生、复制及致病机制具有重要作用[13]。郑帅玉等[14]通过激光共聚焦方法检测到肝外胆管上皮细胞表面表达整联蛋白α2β1,进一步证实轮状病毒NSP4和整联蛋白α2亚基共区域存在于肝外胆管上皮细胞胞质内,并且轮状病毒NSP4从感染细胞向紧邻的非感染细胞进行扩散,即整联蛋白α2β1可以与轮状病毒NSP4相互作用,并进一步导致肝外胆管上皮细胞损伤。
除轮状病毒外,巨细胞病毒(cytomegalovirus,CMV)、呼吸道肠道病毒等也与BA胆管上皮细胞的损伤有关,且有报道显示在BA血液或组织中检测到CMV感染的发生[15-16],这为病毒感染引发BA提供了循证医学证据。
2.2 免疫炎症反应 目前研究证实,γ-干扰素(IFN-γ)、CD8+T淋巴细胞、自然杀伤(NK)细胞、巨噬细胞以及调节性T细胞(Tregs)均与轮状病毒引起的新生鼠肝内外胆管损伤有关,清除CD8+T淋巴细胞、NK细胞、Tregs或阻断IFN-γ的表达后轮状病毒均不能造成新生鼠胆管损伤,由此推断轮状病毒引起BA并不仅仅是对胆管上皮细胞的直接破坏所致,由轮状病毒感染引发的免疫炎症反应可能才是BA形成的真正原因[17]。
病毒感染时,机体会调动固有的免疫反应来对抗病毒的入侵,当免疫炎症反应紊乱,就会造成胆管上皮细胞的损伤[17]。Okamura等[18]利用双链 RNA(dsRNA)类似物聚肌胞苷酸(poly I∶C)感染人BA胆管上皮细胞诱导先天性免疫应答,发现胆管上皮细胞有Toll样受体3(Toll-like receptor 3,TLR3)的高表达。Shimada等[19]认为TLR3-NK-κB/IRF3-CCL5通路(图1)可能是BA胆管上皮细胞固有免疫反应中的重要通路,病毒入侵机体后合成大量的dsRNA中间体,胆管上皮细胞中识别dsRNA,激活核因子(NF)-κB和干扰素调节因子3(IRF3),从而诱导产生趋化因子CCL5,引发一系列炎症反应,最终导致胆管上皮细胞的破坏。
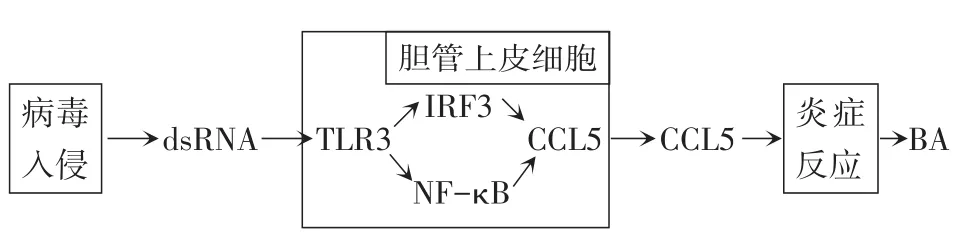
Fig.1 Proposed role of CCL5 in the pathogenesis of dsRNA virusmediated BA图1 CCL5在dsRNA病毒介导的BA发病机制中的作用
胆管上皮细胞受损后,激活丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)通路,延长激酶的激活时间,导致细胞因子白细胞介素(IL)-6和IL-8的不平衡表达[20]。IL-6在肝损伤时从胆管上皮细胞释放出来,直接促进细胞增殖,使细胞存活和再生[21]。血清IL-6的浓度与BA的严重程度有关[22]。伴有严重黄疸和门静脉高压的BA患儿血清中IL-8浓度显著升高[23]。MAPK通路激活后,多种免疫细胞也被激活,活化的免疫细胞能直接杀伤或分泌多种细胞因子,损伤被感染的胆管上皮细胞[20]。Brindley等[24]发现BA患儿中Tregs的表达量低于正常对照,而Tregs的缺乏会使炎症反应和自身免疫反应增强,最终导致胆管上皮细胞破坏和胆管损伤。Shivakumar等[25]发现NK细胞和CD8+T淋巴细胞能通过分泌穿孔素和颗粒酶使两者产生协同作用,导致胆管上皮细胞损伤;可见胆管上皮细胞的炎症和免疫损伤是造成胆管纤维化改变的主要原因。
3 胆管修复
胆管修复过程包括胆管上皮细胞增生和胆管结构重建,其病理学特征是出现活性胆管细胞。活性胆管细胞与正常的胆管细胞相比具有特殊的生物学特性,前者具有一定程度的“可塑性”,表现为上皮细胞分泌和屏障功能缺乏,以及上皮间质转化标志物的表达[26-27]。活性胆管细胞能够产生大量的可溶性介质,导致大量炎症细胞(巨噬细胞、NK细胞、固有淋巴细胞)和间充质细胞(肝星状细胞、成纤维母细胞)的聚集,形成肝脏修复复合物[3]。
BA患儿早期胆管上皮增生时要比静止时分泌更多的细胞因子,包括细胞黏附因子(CAM)、血小板衍生因子(PDGF)、炎症因子,如转化生长因子β(TGF-β)、IFN-γ等。而这些细胞因子又趋化更多的基质细胞及炎症细胞浸润,引发瀑布或链锁式炎症反应,加速了胆管受损、闭塞,直至纤维化的发生。Jun等[28]发现IL-33参与人类胆管上皮细胞的增生过程,IL-33/2型固有淋巴细胞(ILC2)/IL-13通路的激活促进BA小鼠模型的胆管修复。胆管细胞增生是胆管上皮细胞受损后的病理生理反应,但这些增生胆管是否有引流胆汁的功能值得关注。Song等[29]发现癌症亮氨酸拉链下调因子1(leucine zipper downregulated in cancer 1,LDOCl)基因表达上调可以促进NF-κB入核,转录并激活下游炎症因子IL-2和肿瘤坏死因子α(TNF-α)表达,导致胆道上皮细胞发生炎症损伤,进而抑制胆管上皮细胞凋亡,小胆管阻塞,最终导致胆汁淤积这一BA特有的临床病理表现。Zhang等[4]用CD56来标记未成熟的胆管上皮细胞,发现新形成未成熟的胆管或小胆管没有胆汁运输功能,胆汁无法正常引流,最终形成胆栓。
4 上皮间质转化与肝纤维化的关系
上皮间质转化(epithelium mesenchymal transi⁃tion,EMT)指在外界因素作用下,上皮细胞失去极性,变成间叶细胞独特的纺锤型的现象。在四氯化碳诱导的小鼠肝纤维化模型中,发现间叶细胞标志物(如α平滑肌肌动蛋白、纤连蛋白等)表达均上调[30],而上皮细胞标志物(如CK-19等)表达下调[31],肝细胞开始表达促进EMT的转录因子snail[32]。Xue等[33]提出可以通过诱导产生有关细胞因子和生长因子的变化而逆转或者减弱EMT过程。众所周知,TGF-β1是肝纤维化过程中的敏感因子,可促进组织纤维化。实验发现TGF-β1可诱导体外培养的小鼠肝细胞发生EMT,导致细胞表型转化和胶原沉积[34]。目前认为各种因素导致的胆管上皮细胞发生EMT是导致肝纤维化的主要病理进程之一[35]。
5 总结和展望
病毒入侵机体引起BA,不仅与病毒不断复制引起胆管上皮细胞损伤有关,更主要是其引起胆管上皮细胞相关因子表达增高,从而引发一系列免疫炎症反应,最终导致胆管的持续性损伤和肝纤维化的发生。胆管修复包括胆管细胞增生和胆管结构重塑,但BA增生的胆管以未成熟胆管为主,基本没有胆汁引流功能。而更多细胞因子的分泌,趋化更多的基质细胞及炎性细胞的浸润,引发链锁式炎症反应,加速了胆管受损、闭塞,直至纤维化的发生。EMT在BA的发病机制中扮演着重要角色,抑制EMT相关分子的表达或许有助于阻止BA胆管纤维化进程。随着BA胆管上皮细胞破坏和胆管修复机制研究的深入,如何促进增生胆管的成熟及阻止BA进程中各种因子介导的锁链式炎症反应,将成为今后工作中需要解决的问题。
[1]詹江华.胆道闭锁早期筛查现状及对策[J].天津医药,2015,43(1):1-3.Zhan JH.The early screening and countermeasures of bil⁃iary atresia[J].Tianjin Med J,2015,43(1):1-3.doi:10.3969/j.issn.0253-9896.2015.01.001.
[2]Chiu CY,Chen PH,Chan CF,et al.Biliary atresia in preterm in⁃fants in Taiwan:a nationwide survey[J].J Pediatr,2013,163(1):100-103.doi:10.1016/j.jpeds.2012.12.085.
[3]Fabris L,Spirli C,Cadamuro M,et al.Emerging concepts in biliary repair and fibrosis[J].Am J Physiol Gastrointest Liver Physiol,2017,313(2):G102-G116.doi:10.1152/ajpgi.00452.2016.
[4]Zhang RZ,Yu JK,Peng J,et al.Role of CD56-expressing imma⁃ture biliary epithelial cells in biliary atresia[J].World J Gastroen⁃terol,2016,22(8):2545-2557.doi:10.3748/wjg.v22.i8.2545.
[5]刘丹丹,张辉,詹江华.胆道闭锁Kasai术后胆管改变与胆管炎发生关系研究进展[J].中华小儿外科杂志,2014,35(12):952-955.Liu DD,Zhangh,Zhan JH,et al.The study on the relationship between bile duct change and cholangitis after biliary atresia[J].Chin J Pediat Surg,2014,35(12):952-955.doi:10.3760/cma.j.issn.0253-3006.2014.12.017.
[6]Obayashi J,Kawaguchi K,Manabe S,et al.Prognostic factors indi⁃cating survival with native liver after Kasai procedure for biliary atresia[J].Pediatr Surg Int,2017,33(10):1047-1052.doi:10.1007/s00383-017-4135-y.
[7]刘丹丹,詹江华,高伟,等.胆道闭锁Kasai术后胆管病理改变的研究[J].中华小儿外科杂志,2014,35(4):248-253.Liu DD,Zhan JH,Gao W,et al.Changes of bile duct pathology in children with biliary atresia after Kasai portoenterstomy[J].Chin J Pediat Surg,2014,35(4):248-253.doi:10.3760/cma.j.issn.0253-3006.2014.04.004.
[8]Petersen C.Biliary atresia:unity in diversity[J].Pediatr Surg Int,2017,33(12):1255-1261.doi:10.1007/s00383-017-4156-6.
[9]Hertel PM,Estes MK.Rotavirus and biliary atresia:can causation be proven?[J].Curr Opin Gastroenterol,2012,28(1):10-17.doi:10.1097/MOG.0b013e32834c7ae4.
[10]Lobeck I,Donnelly B,Dupree P,et al.Rhesus rotavirus VP6 regu⁃lates ERK-dependent calcium influx in cholangiocytes[J].Virolo⁃gy,2016,499(10):185-195.doi:10.1016/j.virol.2016.09.014.
[11]Mohanty SK,Donnelly B,Dupree P,et al.A point mutation in the rhesus rotavirus VP4 protein generated through a rotavirus reverse genetics system attenuates biliary atresia in the murine model[J].J Virol,2017,91(15).pii:e00510-17.doi:10.1128/JVI.00510-17.
[12]Wang JY,Li ZH,Ye M,et al.Effect of miR-29c and miR-129-5p on epithelial-mesenchymal transition in experimental biliary atre⁃sia mouse models[J].Genet Mol Res,2016,15(3).doi:10.4238/gmr.15037753.
[13]Arias CF,Silva-Ayalad,López S.Rotavirus entry:a deep journey into the cell with several exits[J].J Virol,2015,89(2):890-893.doi:10.1128/JVI.01787-14.
[14]郑帅玉,王文美,赵文涛,等.NSP4与整联蛋白α2β1在轮状病毒致肝外胆管上皮细胞损伤中的作用[J].中华小儿外科杂志,2012,33(7):528-531.Zheng SY,Wang WM,Zhao WT,et al.The role of NSP4 and integrin α2β1 in the damage of extrahepatie bili⁃ary epithelial cells[J].Chin J Pediat Surg,2012,33(7):528-531.doi:10.3760/cma.j.issn.0253-3006.2012.07.013.
[15]Wen J,Xiao Y,Wang J,et al.Low doses of CMV induce autoim⁃mune-mediated and inflammatory responses in bile duct epithelia of regulatory T cell-depleted neonatal mice[J].Lab Invest,2015,95(2):180-192.doi:10.1038/labinvest.2014.148.
[16]Harada K.Sclerosing and obstructive cholangiopathy in biliary atre⁃sia:mechanisms and association with biliary innate immunity[J].Pediatr Surg Int,2017,33(12):1243-1248.doi:10.1007/s00383-017-4154-8.
[17]Shivakumar P,Mizuochi T,Mourya R,et al.Preferential TNF-α signaling via TNFR2 regulates epithelial injury and duct obstruc⁃tion in experimental biliary atresia[J].JCI Insight,2017,2(5):1-15.doi:10.1172/jci.insight.88747.
[18]Okamura A,Harada K,Nio M,et al.Interleukin-32 production as⁃sociated with biliary innate immunity and proinflammatory cyto⁃kines contributes to the pathogenesis of cholangitis in biliary atresia[J].Clin Exp Immunol,2013,173(2):268-275.doi:10.1111/cei.12103.
[19]Shimada T,Imaizumi T,Shirai K,et al.CCL5 is induced by TLR 3 signaling in HuCCT1 human biliary epithelial cells:possible in⁃volvement in the pathogenesis of biliary atresia[J].Biomed Res,2017,38(5):269-276.doi:10.220/biomedres.38.269.
[20]Clemente MG,Patton JT,Anders RA,et al.Rotavirus infects hu⁃man biliary epithelial cells and stimulates secretion of cytokines IL-6 and IL-8 via MAPK pathway[J].Biomed Res Int,2015,2015:1-9.doi:10.1155/2015/697238.
[21]Yu J,Sheung N,Soliman EM,et al.Transcriptional regulation of IL-6 in bile duct epithelia by extracellular ATP[J].Am J Physiol Gastrointest Liver Physiol,2009,296(3):G563-571.doi:10.1152/ajpgi.90502.2008.
[22]Nobili V,Marcellini M,Giovannelli L,et al.Association of serum interleukin-8 levels with the degree of fbrosis in infants with chron⁃ic liver disease[J].J Pediatr Gastroenterol Nutr,2004,39(5):540-544.
[23]Moyer K,Kaimal V,Pacheco C,et al.Staging of biliary atresia at di⁃agnosis by molecular profiling of the liver[J].Genome Med,2010,2(5):33.doi:10.1186/gm154.
[24]Brindley SM,Lanham AM,Karrer FM,et al.Cytomegalovirus-spe⁃cific T-cell reactivity in biliary atresia at the time of diagnosis is as⁃sociated with deficits in regulatory T cells[J].Hepatology,2012,55(4):1130-1138.doi:10.1002/hep.24807.
[25]Shivakumar P,Mourya R,Bezerra JA.Perforin and granzymes work in synergy to mediate cholangiocyte injury in experimental biliary atresia[J].J Hepatol,2014,60(2):370-376.doi:10.1016/j.jhep.2013.09.021.
[26]Brivio S,Cadamuro M,Fabris L,et al.Epithelial-to mesenchymal transition and cancer invasiveness:What can we learn from cholan⁃giocarcinoma?[J].J Clin Med,2015,4(12):2028-2041.doi:10.3390/jcm4121958.
[27]Fabris L,Brivio S,Cadamuro M,et al.Revisiting epithelial-to-mes⁃enchymal transition in liver fibrosis:clues for a better understand⁃ing of the“reactive”biliary epithelial phenotype[J].Stem Cells Int,2016,2016:2953727.doi:10.1155/2016/2953727.
[28]Li J,Razumilava N,Gores GJ,et al.Biliary repair and carcinogene⁃sis are mediated by IL-33-dependent cholangiocyte proliferation[J].J Clin Invest,2014,124(7):3241-3251.doi:10.1172/JCI73742.
[29]Song Z,Dong R,Zhao R,et al.Overexpression of LDOC1 in human biliary epithelial cells inhibits apoptosis through NF-κB signaling[J].J Pediatr Gastroenterol Nutr,2013,57(6):713-717.doi:10.1097/MPG.0b013e3182a7e1da.
[30]Bai GP,Yan G,Wang GJ,et al.Anti-hepatic fibrosis effects of a novel turtle shell decoction by inhibiting hepatic stellate cell prolif⁃eration and blocking TGF-β1/Smad signaling pathway in rats[J].Oncol Rep,2016,36(5):2902-2910.doi:10.3892/or.2016.5078.
[31]马明第,李昭铸,韩沛林,等.胆道闭锁与上皮间质转化机制的研究进展[J].中华小儿外科杂志,2017,38(8):631-635.Ma MD,Li ZZ,Han PL,et al.Mechanisms of biliary atresia and epithe⁃lial mesenchymal transition[J].Chin J Pediat Surg,2017,38(8):631-635.doi:10.3760/cma.j.issn.0253-3006.2017.08.017.
[32]Rowe RG,Lin Y,Shimizu-Hirota R,et a1.Hepatocytederived Snail1 propagates liver fibrosis progression[J].Mol Cell Biol,2011,31(12):2392-2403.doi:10.1128/MCR01218-10.
[33]Xue ZF,Wu XM,Liu M.Hepatic regeneration and the epithelial to mesenchymal transition[J].World J Gastroenterol,2013,19(9):1380-1386.doi:10.3748/wjg.v19.i9.1380.
[34]Shi L,Dong N,Fang X,et al.Regulatory mechanisms of TGF-β1-induced fibrogenesis of human alveolar epithelial cells[J].J Cell Mol Med,2016,20(11):2183-2193.doi:10.1111/jcmm.12918.
[35]Xiao L,Zhou X,Liu F,et al.MicroRNA-129-5p modulates epithe⁃lial-to-mesenchymal transition by targeting SIP1 and SOX4 during peritoneal dialysis[J].Lab Invest,2015,95(7):817-832.doi:10.1038/labinvest.2015.57.

