巨噬细胞外泌体抑制HBV DNA复制
杨 帆,杨 涛,周文靖,徐若男,王福生
慢性乙型肝炎(chronic hepatitis B,CHB)是由HBV感染引起的一种潜在危及生命的肝脏疾病。据WHO报道,全球约有2.4亿HBV感染者[1-2]。病毒持续复制、机体HBV特异性免疫功能低下,诱发肝组织发生特异性和非特异性免疫损伤是CHB发生的主要病理基础[3]。
外泌体于1983年首次在绵羊网织红细胞中被发现[4],是一种特异性的亚细胞结构,表达CD63、CD81、MFGE8、GAPDH等膜蛋白以及热休克蛋白等分子[5]。不同细胞来源的外泌体,其组成成分、表面标志物和生物学功能不尽相同[6-8]。例如在小鼠肝纤维化模型中,外泌体相关微小RNA(microRNA,miRNA)-214 作为效应分子直接参与肝星状细胞的激活[9]。另外,血浆外泌体中miRNA-192升高可能是酒精性肝损伤加重的危险因素[10]。
前期研究显示IFN-α可以通过诱导肝脏非实质细胞分泌高水平外泌体相关的miRNA-638间接抑制HBV DNA复制,发挥抗病毒效应[11]。然而免疫细胞尤其是巨噬细胞(macrophage,Mø)是否可以借助外泌体发挥直接抗病毒效应,并且这种抗病毒效应与miRNA-638的关系目前尚不清楚。本研究应用实时定量 PCR的方法,体外验证外泌体是否具有抑制HBV DNA复制的功能,同时检测Mø及Mø外泌体中miRNA-638的表达,探讨Mø外泌体中miRNA-638抑制HBV DNA复制及与CHB患者肝损伤及病毒复制的相关性。其次,通过实时定量 PCR检测CHB患者外周血血清外泌体中miRNA-638的表达,并分析其与肝损伤的相关性。
1 对象与材料
1.1 对象 2016年12月—2017年9月解放军第三〇二医院门诊收治的CHB免疫活化(immune activation,IA)期、低(非)复制(inactive carrier,IC)期患者41例。其中,IA期患者25例(男19例,女6例),平均年龄为(31.5±9.2)岁;IC期16例(男12例,女4例),平均年龄为(36.4±15.1)岁。纳入标准:①IA期:HBsAg和HBeAg阳性,HBV DNA>100 000 IU/ml,转氨酶>60 U/L ;②IC期:HBeAg阴性且HBeAb阳性,HBV DNA<10 000 IU/ml,转氨酶正常。排除标准:合并HCV或HIV感染;合并酒精性肝损伤;肝脏原发或继发性恶性肿瘤;肝外梗阻性病变;孕妇等。2组患者均为未接受抗病毒治疗的初治患者,健康对照(healthy control,HC)为同时期本研究室工作人员,共12例(表1)。

表1 基本临床资料Table 1 Basic clinical data
1.2 材料 HepG2.2.15及THP-1细胞株由解放军第三〇二医院感染病诊疗与研究中心提供;DMEM、1640培养液、胎牛血清(Gibco公司);佛 波 酯(phorbol-12-myristate-13-acetate,PMA)、GW4869(Sigma公司);anti-CD14-percp-cy5.5、anti-CD11b-FITC、anti-CD9-FITC及 anti-CD63-percpvio700(美国BD公司);ExoQuick、ExoQuick-TC外泌体提取试剂盒(美国SBI);超过滤管(美国Millipore);HBV DNA检测试剂盒(湖南圣湘生物科技有限公司);Trizol试剂、总外泌体RNA分离试剂盒(北京天漠生物科技有限公司);miRNA反转录试剂盒(广州锐博科技生物有限公司);miRNA-638、内参(U6)及外参(cel-mir-39-3p)的特异性探针(广州锐博科技生物科技有限公司)。
2 方 法
2.1 细胞培养 将人-单核细胞系THP-1培养于含10%胎牛血清(fetal bovine serum,FBS)的1640培养基中,于37 ℃、5%CO2培养箱中传代培养。细胞经1200 rpm离心5 min后换液或传代,同时要注意维持THP-1细胞均一、圆形、透亮的悬浮状态。HepG2.2.15细胞培养于含10%FBS的DMEM培养基中,于37 ℃、5%CO2培养箱中传代培养。细胞经1200 rpm离心5 min后换液或传代。
2.2 Mø外泌体的体外诱导 将悬浮的THP-1细胞以5×105个/ml的密度接种于75 cm2培养基中,并加PMA(50 ng/ml)进行诱导。24 h后悬浮的THP-1细胞被诱导为贴壁的Mø,用PBS清洗并更换为无FBS的1640培养基,加入10%无外泌体的FBS作为对照组,于37 ℃、5%CO2培养箱培养48 h后收集培养上清备用。
2.3 外泌体的分离 ①Mø上清外泌体分离:取Mø上清液,用超过滤管3000×g离心30 min,取上层上清,按5∶1比例加入外泌体抽提试剂,快速混合均匀后置于4 ℃过夜,次日取出,1500×g离心30 min后弃去上清,沉淀即为抽提的外泌体,用PBS重悬后通过BCA法进行蛋白定量。置于-80 ℃冰箱长期保存,避免反复冻融。②血清外泌体分离:取所有入组者的外周血血清与外泌体抽提试剂按4∶1比例混合均匀后,置于4 ℃冰箱30 min,1500×g离心30 min后弃去上清,沉淀即为抽提的血清外泌体。置于-80 ℃冰箱长期保存,避免反复冻融。
2.4 外泌体的鉴定 外泌体电镜标本制备及观察:取外泌体样品,向样品中滴入染色剂醋酸铀水溶液(1%),混匀,用移液枪滴加至去静电的复膜铜网上,室温静置自然干透后于透射电镜下观察,并进行拍摄。外泌体流式细胞仪检测:将latex beads溶于300 μl MES buffer中,混匀后4000 rpm离心 15 min。每管加入 20 μg/μl的外泌体,加入MES buffer混匀。室温下孵育60 min后,甘氨酸室温封闭30 min。用含3% FBS MES buffer洗涤后分别加入CD9抗体和CD81抗体,同型IgG抗体作为空白对照。
2.5 Mø外泌体与HepG2.2.15细胞共培养 将10 μmol/L Mø外泌体阻断剂GW4869加入Mø培养上清,无血清条件下刺激48 h,将细胞上清与HepG2.2.15细胞于37 ℃、5%CO2培养箱中共培养48 h。收集上清用于HBV DNA定量检测。
2.6 HBV DNA的实时定量 PCR定量分析 取HBV DNA检测试剂盒中的各组分,平衡至室温后混匀备用。取5 μl Mø与HepG2.2.15细胞共培养后的细胞培养上清加至96孔板后继续加入5 μl样品释放剂(阴性对照、阳性对照、定量参考品与待测样本相同处理),每管加入40 μl PCR混合液,2000 rpm离心30 s。PCR反应条件为:50 ℃2 min;94 ℃ 5 min,94 ℃ 15 s,57 ℃ 30 s,45 个循环;25 ℃ 10 s。
2.7 外泌体miRNA-638的检测 分别提取Mø、非Mø、Mø外泌体以及血清外泌体总RNA。用特异的反转录探针将miRNA-638反转录成cDNA,使用miRNA反转录试剂盒配制反转录体系,配置反应体系的所有操作均在冰上进行。根据microRNA Assay操作手册配制相关试剂进行PCR反应。采用U6作为内参照,cel-mir-39-3p作为外参照,以2-ΔΔCt值评估miRNA-638的相对表达量。
2.8 统计学处理 采用SPSS 20.0软件进行统计分析,计量资料呈正态分布以±s表示,非正态分布的资料以中位数(最小值,最大值)表示,组间差异显著性检验采用成组t检验,多组比较采用单因素方差分析,相关性分析采用Spearman相关性分析,P<0.05为差异有统计学意义。
3 结 果
3.1 Mø的体外诱导及鉴定 THP-1细胞经50 ng/ml PMA刺激24 h后,细胞由悬浮、圆形变成贴壁、有伪足的Mø(图1A)。Mø经流式细胞仪检测结果显示,PMA刺激后的Mø高表达CD11b-FITC及CD14-percp-cy5.5 ,阳性率分别为:97.2%、96.4%(图1B)。

图1 Mø形态和流式鉴定A.PMA诱导前后Mø的形态学观察;B.Mø的流式鉴定Figure 1 Morphology and flow identification of macrophage
3.2 外泌体的形态学鉴定及流式细胞学分析 在透射电镜下显示Mø外泌体呈圆形或椭圆形,大小不一,外形直径在100 nm左右,可见明显的膜性结构(图2A)。流式细胞仪检测结果显示提取的外泌体表达特异性表面标志物分子CD9和CD81,阳性率分别为59.3%、55.8%(图2B)。
3.3 Mø外泌体抑制HepG2.2.15细胞HBV DNA复制 通过实时定量PCR检测HepG2.2.15细胞上清中HBV DNA的表达水平。结果如表2所示,无血清条件下,Mø外泌体可以明显抑制HBV DNA的复制。经GW4869阻断后,发现Mø上清抑制HepG2.2.15细胞HBV DNA复制的能力明显降低(P<0.05)(图3)。以上结果显示,体外条件下,Mø来源的外泌体可以有效抑制HepG2.2.15细胞HBV DNA的复制。

图2 Mø来源外泌体的特征鉴定A.外泌体的电镜鉴定;B.外泌体的流式鉴定Figure 2 Characteristics identification of macrophage-derived exosomes
表2 HBV DNA定量情况(±s,log10IU/ml)Table 2 Quantification of HBV DNA(±s,log10IU/ml)

表2 HBV DNA定量情况(±s,log10IU/ml)Table 2 Quantification of HBV DNA(±s,log10IU/ml)
注:FBS均指无外泌体的FBS;-.表示无FBS或GW4869刺激;+.表示有FBS或GW4869刺激;ND.没有检测
培养条件 FBS- FBS+GW4869 - 2.926±0.454 4.600±0.598 GW4869 + 4.533±0.751 ND

图3 Mø来源外泌体抑制HBV DNA复制(n=18)注:-.表示无FBS或GW4869刺激;+.表示有FBS或GW4869刺激(FBS均指无外泌体的FBS);***.P<0.001Figure 3 Macrophage-derived exosomes inhibits HBV DNA replication (n=18)
3.4 Mø外泌体中miRNA-638表达水平分析 结合前期的研究结果,为了进一步分析Mø中miRNA的表达情况,经磁珠分选人单核细胞后,分别检测人单核Mø以及除去单核Mø以外的外周血单个核细胞中miRNA的表达,结果显示,人外周血来源Mø组中的miRNA-638的表达水平高于非Mø组(P<0.05)(图4A)。THP-1来源的Mø经体外无FBS(无外泌体)刺激后,Mø外泌体中miRNA-638的表达也明显升高(P<0.05)(图4B)。
3.5 CHB患者血清外泌体中miRNA-638的表达 通过实时定量PCR检测受试对象血清外泌体中miRNA-638的表达,结果显示,IA期、IC期及HC组3组miRNA-638的相对表达量分别为:0.168±0.208、0.824±0.605、1.307±0.282,IA 期 患者血清外泌体中miRNA-638表达水平低于IC期,并且2组患者的miRNA-638表达水平均低于HC组(P均<0.05)(图5)。
3.6 CHB患者IA期血清外泌体中miRNA-638与肝损伤和HBV DNA复制的相关性分析 CHB患者IA期血清外泌体中miRNA-638表达水平与ALT(r=0.539,P=0.006)、AST(r=-0.589,P=0.002)、 和 HBV DNA(r=-0.656,P=0.000)水平均呈负相关(图6)。
4 讨 论
外泌体来自于细胞的内吞系统,电镜下外泌体呈球状、杯状,直径在30~100 nm之间,富含效应分子如mRNA、miRNA和蛋白质等[12]。外泌体中的miRNA因其本身所具有的调控基因表达的强大功能,吸引了更多的研究者的关注。miRNA是一类长约19~25个核糖核苷酸的非编码调控单链小分子的RNA。目前miRbase数据库已有多达9500多个该类分子,研究证实许多miRNA与人类病毒感染、肿瘤等的发生和发展密切相关[13]。前期研究显示,IFN-α的抗病毒效应是通过Mø相关外泌体介导的,与外泌体中高表达的miRNA-4284、miRNA-638分子密切相关[11]。外泌体富含效应分子如mRNA、miRNA和蛋白质等在HBV DNA复制、肝细胞炎性损伤、肝细胞恶性转化的过程中发挥重要作用[14-15]。以往的研究发现,单核细胞来源的外泌体可以调节肝脏的炎性反应[16]。然而,Mø作为天然免疫的重要组成部分,自身的抗病毒功能不容忽视。Mø来源的外泌体是否具备直接的抗病毒功能,在肝脏炎性损伤中的作用目前还不清楚。就目前而言,肝脏疾病相关外泌体的研究还处于起步阶段,特别是免疫细胞来源的外泌体与病毒性肝炎、肝硬化以及肝癌之间的研究还较少。
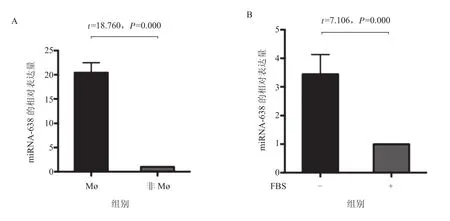
图4 人外周血Mø及THP-1细胞上清外泌体中miRNA-638的表达鉴定(n=4)A.Mø及去除Mø以外的外周血单个核细胞中miRNA-638的表达;B.有无血清刺激条件下,Mø上清外泌体中miRNA-638的表达Figure 4 Expression of miRNA-638 in the exosomes derived from human peripheral blood macrophages and the supernatant of THP-1 cell line (n=4)
分泌外泌体的细胞受不同物质的调控,Mø外泌体具有自己特殊的性质,其表面常见分子标志有CD9、CD81、CD63等。本研究从Mø培养上清中分离鉴定出外泌体,电镜下观察近似圆形,直径在30~100 nm之间,表达特征性标志分子CD9和CD81。并且Mø来源的外泌体可以有效抑制HepG2.2.15细胞中HBV DNA复制。GW4869是已知的外泌体阻断剂[17],当外泌体被特异性阻断剂(GW4869)阻断后,细胞上清中总蛋白和总RNA水平降低(前期研究已证实),外泌体对HBV DNA复制的抑制效果也明显减弱。单独应用GW4869并不影响HepG2.2.15细胞自身的HBV DNA的复制。说明外泌体可能是抑制HBV DNA复制的效应分子。
目前已有大量的文献涉及外泌体中miRNA的体内研究。本研究进一步证实Mø外泌体中高水平表达miRNA-638分子,经无血清刺激后表达上调。临床研究结果显示,IA期患者血清外泌体相关miRNA-638表达较IC期明显降低。并且IA期患者血清外泌体中miRNA-638的表达水平与其自身ALT、AST及HBV DNA水平呈负相关。但本研究并未进行miRNA-638的阻断试验,须要进一步确定外泌体中miRNA-638对HBV DNA复制和HBsAg合成的影响,同时由于病例数较少,是否可以作为诊断肝损伤的免疫学指标还有待扩大样本量进一步观察。另外,入组的2组CHB患者均未接受抗病毒治疗,而抗病毒治疗是否会影响到外泌体的分泌和功能还有待进一步探索。

图6 CHB患者血清外泌体miRNA-638与血清转氨酶和病毒复制的相关性分析Figure 6 Correlation with exosome associated miRNA-638 derived from serum in CHB patients with serum transaminase and viral replication
【参考文献】
[1]Wang Y,Zhao C,Zhang L,et al.Predictive value of interferongamma inducible protein 10 kD for hepatitis B e antigen clearance and hepatitis B surface antigen decline during pegylated interferon alpha therapy in chronic hepatitis B patients[J].Antiviral Res,2014,103:51-59.
[2]Bartel DP.MicroRNAs: genomics,biogenesis,mechanism,and function[J].Cell,2004,116(2):281-297.
[3]Gong LL,Zhao BB,Fan WF,et al.Correlations of IFN-gammainducible protein-10 with the risk of chronic hepatitis B and the efficacy of interferon therapy in Asians[J].Int J Clin Exp Pathol,2015,8(7):8367-8375.
[4]Johnstone RM,Adam M,Hammond JR,et al.Vesicle formation during reticulocyte maturation.Association of plasma membrane activities with released vesicles (exosomes) [J].J Biol Chem,1987,262(19):9412-9420.
[5]杨帆,杨涛,王福生,等.肝脏疾病中外泌体的作用和临床研究进展[J].传染病信息,2018,31(2):66-70.
[6]Blanchard N,Lankar D,Faure F,et al.TCR activation of human T cells induces the production of exosomes bearing the TCR/CD3/zeta complex[J].J Immunol,2002,168(7):3235-3241.
[7]Van Niel G,Raposo G,Candalh C,et al.Intestinal epithelial cells secrete exosome-like vesicles[J].Gastroenterology,2001,121(2):337-349.
[8]De Gassart A,Geminard C,Hoekstra D,et al.Exosome secretion:the art of reutilizing nonrecycled proteins? [J].Traffic,2004,5(11):896-903.
[9]Charrier A,Chen R,Chen L,et al.Exosomes mediate intercellular transfer of pro-fibrogenic connective tissue growth factor (CCN2)between hepatic stellate cells,the principal fibrotic cells in the liver[J].Surgery,2014,156(3):548-555.
[10]Momen-Heravi F,Saha B,Kodys K,et al.Increased number of circulating exosomes and their microRNA cargos are potential novel biomarkers in alcoholic hepatitis[J].J Transl Med,2015,13:261.
[11]Li J,Liu K,Liu Y,et al.Exosomes mediate the cell-to-cell transmission of IFN-alpha-induced antiviral activity[J].Nat Immunol,2013,14(8):793-803.
[12]Gould SJ,Raposo G.As we wait: coping with an imperfect nomenclature for extracellular vesicles[J].J Extracell Vesicles,2013,2.
[13]Banerjee-Basu S,Larsen E,Muend S.Common microRNAs target established ASD genes[J].Front Neurol,2014,5:205.
[14]Yang N,Li S,Li G,et al.The role of extracellular vesicles in mediating progression,metastasis and potential treatment of hepatocellular carcinoma[J].Oncotarget,2017,8(2):3683-3695.
[15]Deng W,Lu M.The role of microRNAs in hepatocyte metabolism and hepatitis B virus replication[J].Virol Sin,2016,31(6):472-479.
[16]Saha B,Momen-Heravi F,Kodys K,et al.MicroRNA Cargo of extracellular vesicles from alcohol-exposed monocytes signals naive monocytes to differentiate into M2 macrophages[J].J Biol Chem,2016,291(1):149-159.
[17]Mittelbrunn M,Gutierrez-Vazquez C,Villarroya-Beltri C,et al.Unidirectional transfer of microRNA-loaded exosomes from T cells to antigen-presenting cells[J].Nat Commun,2011,2:282.

