三角褐指藻跑道池规模化培养及岩藻黄素积累条件的优化
宋培钦,刘鹭,魏东
(华南理工大学食品科学与工程学院,广东广州 510640)
岩藻黄素(fucoxanthin)是一种参与光合作用的类胡萝卜素,占自然界总类胡萝卜素的10%以上,广泛存在于褐藻、硅藻和金藻等藻类中[1]。岩藻黄素在藻类细胞中与叶绿素和蛋白组合成一个FCP复合体,在光合作用的光捕获、光能传递和光保护等生理作用中扮演重要的角色[2]。岩藻黄素具有一个区别于其他常见类胡卜素(如β-胡萝卜素、番茄红素和虾青素等)的丙二烯结构和5,6-环氧结构(如图1)。

图1 岩藻黄素的化学结构式Fig.1 Chemical structure of fucoxanthin
岩藻黄素具有很好的研究意义及很高的应用价值。Peng J等[3]研究发现岩藻黄素在抗癌、抗内毒素炎症、抗氧化、抗疟疾以及保护肝脏、血管等有显著的功效。另外,Kuipers R S等[4,5]研究证实了岩藻黄素能显著改善胰岛素抵抗特性,降低血液中葡萄糖含量,在减肥方面功效显著。
目前用于提取岩藻黄素的原料主要为海带、裙带菜等大型海藻。然而由于大型海藻中岩藻黄素含量低、养殖成本高、提取纯化困难且有季节性生长的特点,严重限制了岩藻黄素的开发利用[6,7]。Kim S M等[8]研究发现海洋硅藻中的岩藻黄素含量丰富,含量高达15.42~16.51 mg/g,是大型海藻的10倍以上。同时单细胞微藻具有生长速度快、易于培养和在生物反应器中可人工调控的优点,从而解决了工业化生产的原料问题。
三角褐指藻是一种海洋真核单细胞藻,其岩藻黄素含量是大型藻的数倍,且相对于大型藻类来说更易于提取分离[1,8]。同时三角褐指藻的生长速率较快,易于室内或户外规模化培养。目前微藻养殖的方法和反应器很多如:跑道池、光生物反应器和发酵罐等。跑道池易于排氧及规模化,迄今为止90%的微藻商业化养殖,均采用跑道池[9,10]。本文选取三角褐指藻为实验材料,探讨在户外跑道池条件下盐度、pH值和氮源种类对三角褐指藻生长情况及岩藻黄素含量的影响,以期为三角褐指藻的户外大规模生产提供理论依据。
1 材料与方法
1.1 材料与仪器
三角褐指藻(P. tricornutum)由中国科学院水生生物研究所胡晗华研究员惠赠;岩藻黄素标准品购于美国Sigma公司;乙腈、乙酸乙酯、甲醇为色谱纯试剂,丙酮、磷酸二氢钠和硅酸钠等均为分析纯试剂;Instant Ocean海盐购自Marineland;盐度计(ATC)购自上海淋誉贸易有限公司;笔式pH计(MT-8062)购自 Exact Instrument;可见分光光度计(721)购自上海佑科仪器仪表有限公司;冷冻干燥机(Modulyod)购自Thermor Eletron Corporation。
1.2 实验方法
1.2.1 种子液制备

表1 f/2培养基Table 1 f/2 medium

表2 f/2微量元素溶液Table 2 f/2 trace metal solution
三角褐指藻种子液的制备分三步进行,首先在250 mL的锥形瓶中(装液量100 mL)培养至指数期,然后转移到3 L的锥形瓶(装液量1.5 L),最后扩种到18 L的PVC透明培养装置中培养。第一、二步培养在恒温摇床上进行,培养温度 20±1 ℃,光照强度4000±500 Lux;第三步培养时,需用空气泵经无菌滤膜泵入空气,保证 CO2的溶解量,并增加光强至8000±500 Lux。接种前要对培养基和培养器皿进行高温高压灭菌(121 ℃、20 min)和其他消毒处理。三角褐指藻的培养采用f/2人工海水培养基[11](表1、2)。海水利用人工海盐(Reef Crystals®,Instant Ocean Corp., VA, USA)进行配置。
1.2.2 户外培养及采收

图2 开放池和超滤采收装置Fig.2 Open pool and ultrafiltration recovery unit
三角褐指藻户外培养阶段主要包括由一级池到三级池的户外培养以及采收工作。各级跑道池的底面积为:一级跑道2.5 m2;二级跑道池10 m2,三级跑道池40 m2,各级跑道池的培养水深均为20 cm。在户外培养过程中每级跑道池的起始接种密度要达到OD450nm在0.2~0.3之间,接种时间一般选在早上光照不强的时间,接种以及培养过程中添加的培养基均采用 f/2人工海水培养基。户外培养基用水为自来水,配置培养基之前经过 0.5 μm 微孔滤膜过滤系统进行过滤,并用10-5的二氧化氯消毒。在每次使用培养池之前,使用5×10-5的二氧化氯对培养池进行消毒,每次消毒时间12 h。
采收过程采用二级过滤采收模式,首先藻液通过20 μm的预过滤装置除去藻液中较大的杂质,再经过0.5 μm的微滤膜组件来浓缩藻液,连续循环浓缩后达到预期浓度的藻液灌装后冷藏备用。一级培养池及采收装置见图2。
1.2.3 三角褐指藻户外生长过程的监控
采用OD值法、血球计数法和干重法对三角褐指藻的户外生长过程进行监控。
OD值法:吸取3 mL藻液置于石英比色皿中,在紫外分光光度计下测定450 nm条件下的光密度值。血球计数法:在显微镜下,通过计数获得。干重法:吸取40 mL藻液置于已准确称量的50 mL康宁离心管中,6000 r/min离心10 min,所得藻泥用超纯水进行清洗后继续进行离心,重复两次,得到的藻泥进行冷冻干燥,然后用分析天平准确称量干燥后藻粉的最终质量并计算差值。
通过细胞密度计算出不同培养条件下三角褐指藻的比生长速率μ/d。比生长速率计算公式:

1.3 实验设计及处理
实验室之前的研究成果表明:三角褐指藻在盐度25、pH值8.0、尿素为氮源(含氮量1.76 mmol/L)的条件下其生长状况最佳。本次户外跑道池研究实验中选用盐度、pH值、氮源种类为主要影响因子(考虑到生产成本,氮源选用较为廉价的尿素和碳铵),探究其对三角褐指藻生长及岩藻黄素积累的影响。影响因子的浓度设计及氮源种类见表3。
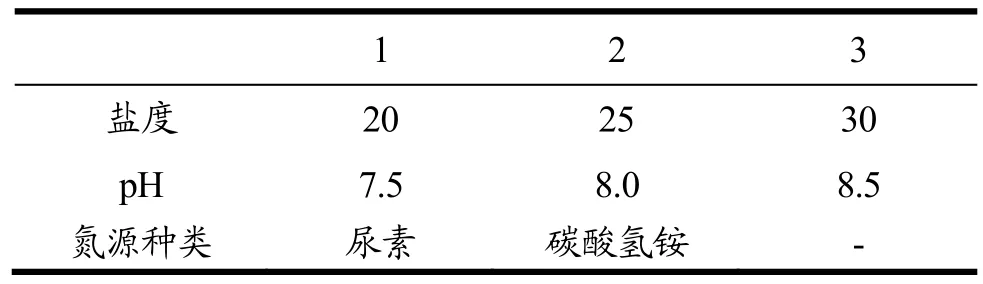
表3 影响因子实验设计Table 3 Experiment design of influence factors
实验过程中,通过跑道池、CO2储气罐、pH检测器和通气管道来维持pH值的恒定。通气管道的一端与储气罐相连,另一端伸入跑道池内的藻液中,检测器具有一根浸没于藻液中的pH电极,通过电极检测跑道池内的藻液pH值,然后将测得的pH与检测器所设定的阈值相比较,并形成阈值比较信号;通气管道上具有电子通气控制器能够控制通气管道的气路通断,电子通气控制器与检测器连接并可接收检测器的阈值比较信号,并根据所接收的阈值比较信号控制电子通气控制器,从而实现pH值的稳定。实验结束后,通过对细胞密度、OD值以及岩藻黄素的积累情况进行分析对比,以确定户外高密度培养三角褐指藻的最适宜条件。
1.3.1 盐度对三角褐指藻生长及岩藻黄素积累的影响
盐度优化实验在一级跑道池中进行。培养基采用f/2人工海水培养基;碳铵为氮源(含氮量 1.76 mmol/L);pH值8.0(通过通入CO2控制pH恒定);设置A、B、C三池,盐度分别为20、25和30;使用电机搅拌,搅拌速率80 r/min。保持接种密度相同。实验时间在4月上旬。
1.3.2 pH值对三角褐指藻生长及岩藻黄素积累的影响
pH优化实验在一级跑道池中进行。设置A、B、C三池,在接种密度相同的条件下,通过通入CO2分别控制培养基pH在7.5、8.0和8.5;培养基采用f/2人工海水培养基;碳铵为氮源(含氮量1.76 mmol/L);选取最优盐度20;使用电机搅拌,搅拌速率80 r/min。实验时间在4月中旬。
1.3.3 氮源对三角褐指藻生长及岩藻黄素积累的影响
氮源优化实验在一级跑道池中进行。设置 A、B两池,采用去除氮源的 f/2培养基,分别以尿素和碳铵为氮源(含氮量1.76 mmol/L);选取最优盐度20,最优pH值8.0,使用电机搅拌,搅拌速率80 r/min。实验时间在4月下旬。
1.3.4 一个光暗周期中岩藻黄素含量的变化
在一级跑道池中,采用 f/2人工海水培养基;盐度20;pH值8.0;碳铵为氮源(含氮量1.76 mmol/L)培养三角褐指藻。培养至稳定期时,从第一天晚上 7点开始每三个小时取样一次,一直持续到次日晚上 7时测定一天中三角褐指藻岩藻黄素含量的变化。实验时间在4月下旬。
1.3.5 光照强度和温度的测定
分别使用TES 132A光照强度测量计和酒精温度计进行光照强度和水温的测定,每隔一个小时测定一次,记录数据。
1.4 岩藻黄素的提取分析
准确称取10 mg藻粉,装入2 mL冻存管中,添加适量陶瓷珠。加入4 ℃丙酮提取液,每次添加量1 mL,用震荡器在3800 r/min下,震荡30 s。用液氮浸提5 min,离心收集上清液至15 mL离心管中,反复进行多次,直至藻泥变成白色。合并所有上清液,用氮气吹干离心管中有机溶剂。用色谱级丙酮定容至 1 mL,经0.22 μm滤膜过滤后,置于棕色进样瓶中。全过程保持色素溶液处于无光或短暂弱光中。
HPLC系统采用Waters双1525泵和2996二极管阵列检测器(Waters, MA, USA),Waters Spherisorb®ODS2 C18柱(4.6 mm×250 mm,5 μm)。流动相由A液(乙腈/甲醇/0.1 M Tris-HCl,体积比为 84:2:14,pH 8.0)和B液(甲醇/乙酸乙酯,体积比为68:32)组成。梯度洗脱:从100% A线性变化到100% B,1~15 min;100% B,15~22 min;从100% B线性变化到100% A,22~25 min;100% A,25~30 min。流速为1.2 mL/min。进样量为20 μL。色素的吸收光谱从250 nm到700 nm,在其峰位置450 nm处测定岩藻黄素的含量[12]。
1.5 数据统计
采用Microcal Origin 8.5 Software对数据进行处理和统计学分析,实验数据均采用平均值±标准误差(mean±SD)给出(n=3)。采用t检验来确定各试验组之间差异,p<0.05为显著差异。
2 结果与分析
2.1 三角褐指藻色素的定性定量分析

图3 250~700 nm波长扫描下岩藻黄素标准品的光谱图Fig.3 Spectrogram of the fucoxanthin standard at wavelength range of 250~700 nm
本研究检测了三角褐指藻在不同条件下,不同生长阶段的岩藻黄素含量。首先通过HPLC法,以岩藻黄素浓度(μg/mL)为纵坐标,以峰面积为横坐标建立不同浓度的标准品与其峰面积的回归曲线(线性回归方程如表4)。

表4 岩藻黄素浓度(μg/mL)与峰面积的关系Table 4 The relationship between the fucoidin concentration(μg/mL) and the peak area
岩藻黄素标品在250~700 nm波长下扫描的光谱图见图3。如图3所示,三角褐指藻在450 nm处有最大吸收峰。
岩藻黄素标准品在450 nm条件下的HPLC光谱图见图4。如图4所示,岩藻黄素的定性出峰时间在第8 min。
450 nm条件下三角褐指藻色素提取液的HPLC光谱图如图5所示。

图4 450 nm下岩藻黄素标准品的HPLC谱图Fig.4 HPLC spectrum of fucoxanthin standard at 450 nm

图5 450 nm下三角褐指藻色素提取液的HPLC谱图Fig.5 HPLC spectrum of P. tricornutum pigment extract at 450nm
通过HPLC光谱图的出峰时间可以对三角褐指藻提取液中的岩藻黄素进行定性的分析,通过峰面积及回归曲线可以对三角褐指藻中岩藻黄素含量进行一个定量的分析。
2.2 光照强度和温度的变化情况
盐度、pH和氮源优化过程中的最高光照强度和最高温度以及一个光照周期中的光照强度和温度随时间的变化如图6所示。
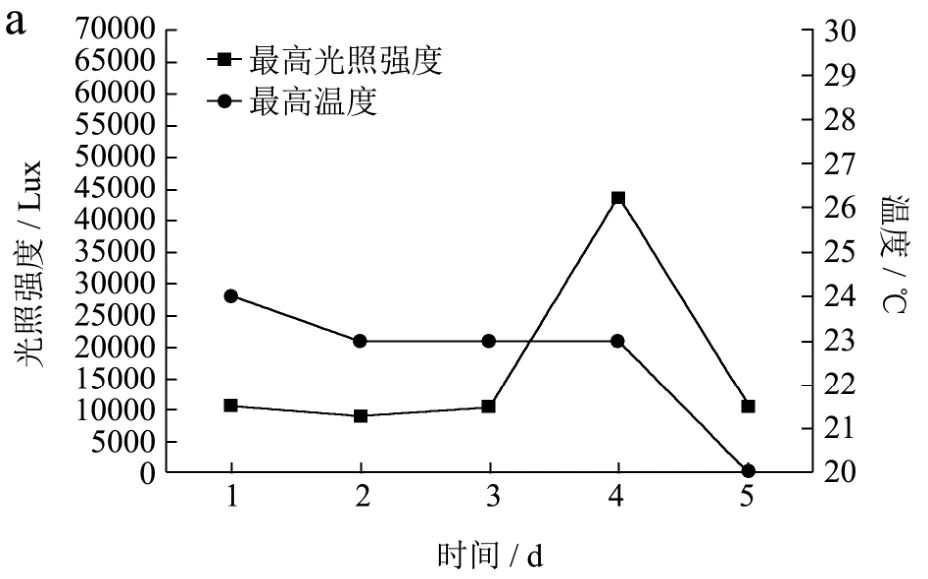

图6 光照强度和温度随时间的变化Fig.6 Light intensity and temperature change over time
由于三组优化实验分时段进行,从图6中可以看出,不同时间光照强度和温度的变化存在较大差异。
由图6a可以看出,盐度优化过程中的最大光照强度和最高温度无显著的波动性变化,最大光照强度基本维持在10000 Lux,最高温度基本维持在20~25 ℃。由图6b可以看出,pH优化过程中的最高温度无显著的波动变化,基本维持在23~24 ℃;最大光照强度呈现出波动式的变化,在培养的第1 d、第4 d光照强度普遍偏高,在培养的第3 d最大光强仅为5000 Lux。由图6c可以看出,氮源优化过程中水温及光照强度普遍偏高,最高水温基本维持在26~28 ℃,最大光强基本维持在30000 Lux。由图6d可以看出,在13时光照最强,并且在13时~19时,培养池的水温普遍偏高,基本维持在27 ℃以上。
2.3 不同培养条件下三角褐指藻的比生长速率
户外不同条件下三角褐指藻的比生长速率如表 5所示。

表5 不同条件下三角褐指藻的比生长速率Table 5 The specific growth rate of P. tricornutum under different conditions
2.4 培养基盐度对三角褐指藻生长情况及岩藻黄素含量的影响
不同盐度对三角褐指藻生长情况的影响如图7a、7b、7c。如图所示,随着培养时间的变化,三角褐指藻的OD值、细胞密度、干重呈现出不断增长的趋势。


图7 不同盐浓度下OD值(a)、细胞数(b)、干重(c)和岩藻黄素含量(d)的变化Fig.7 Effects of different salinity on the OD value (a), cell counts(b), dry biomass concentration (c) and the fucoxanthin content(d) of P. tricornutum
随着培养液盐度的增加,OD值、细胞密度、干重的增长有显著性差异(p<0.05)。实验进行到第3 d时,细胞进入到指数增长期,细胞增长较快。在第5 d时,盐度为20条件下的OD值、细胞密度、干重最大,分别为0.998、6.01×106/mL、177.78 mg/L;盐度为25条件下次之,OD值为0.951、细胞密度为5.67×106/mL、干重为165.93 mg/L;盐度为30条件下的细胞密度、OD值及干重最低,分别为0.921、5.36×106/mL、158.52 mg/L。如表5所示,在盐度为20的条件下,三角褐指藻的比生长速率最高为0.157。
三角褐指藻对盐度的适应范围较广,在盐度为9~92的范围内都能生存[13]。然而较高和较低的盐度,都不利于三角褐指藻的生长,随着盐度的升高,其生物量呈现出先增加后下降的趋势这可能是由于盐度对细胞渗透压、细胞膜的通透性等产生了影响。
不同盐度对三角褐指藻岩藻黄素含量的影响如图7d所示。由图7d可知,随着培养时间的增加,岩藻黄素含量呈现出不断增长的趋势。稳定期时不同盐度条件下,岩藻黄素含量无显著性差异(p>0.05)。在盐度为20条件下,岩藻黄素含量最高为18.65 mg/g。
从图 6a可以看出培养过程中的最高光强基本维持在10000 Lux左右;最高温度基本维持在20~24 ℃之间,光照强度和温度都较适宜于三角褐指藻的生长和岩藻黄素的积累。因此三角褐指藻的生长及岩藻黄素含量呈现出不断增长的趋势。
因此,盐度为20的条件下,不仅适合三角褐指藻的生长,更有利于岩藻黄素的积累。
2.5 培养基pH值对三角褐指藻户外生长情况及岩藻黄素含量的影响
从图8a、8b、8c中可以看出,在起始两天内,不同pH条件下OD值、细胞密度及干重均呈现增长的趋势。从实验第3 d开始,三种pH值下的OD值、细胞密度及干重的增长速率发生了明显的变化,pH值8.0下的OD值、细胞密度和干重增长迅速,最终OD值高达1.045、细胞密度为5.8×106/mL、166.39 mg/L;pH值8.5条件下的OD值、细胞密度及干重相对增长缓慢,最终 OD值达到 0.635、细胞密度为4.15×106/mL、干重为114.72 mg/L;而pH值为7.5条件下的OD值、细胞密度及干重则开始下降,最终OD值为 0.352、细胞密度为 1.75×106/mL、干重为 66.11 mg/L。培养结束后,pH 8.0条件下的生物量明显高于pH 7.5和pH 8.5条件下的生物量(p<0.05)。如表5所示,pH值在 8.0条件下,比生长速率最高,达到0.191。
海洋微藻的最适生长 pH值与海水相接近约为8.0,但不同藻种之间也具有差异性。陈峰等[14]研究指出pH值的变化会影响微藻细胞内外离子平衡、相关膜的结构组成、渗透压及藻细胞内相关酶的活性,一旦偏离最适pH值,微藻的生长及体内相关代谢活动会受抑制。吴伟伟等[15]研究发现三角褐指藻的最适生长pH值是8.0,且与pH值7.5和8.5的差异性显著。本实验中三角褐指藻的最适生长pH值为8.0,这与之前的研究呈现出相同的变化规律。
如图8d所示,在培养周期内,不同pH值条件下,岩藻黄素的含量呈现出一种波动式的变化。这可能是光照和温度等其他因素共同作用得到的结果。从图6b可以看出,培养过程中最高水温维持在23~24 ℃,比较有利于三角褐指藻的生长;在光照较强的第4 d,岩藻黄素明显的下降,而在光照强度较低的第2 d、第3 d、第5 d岩藻黄素含量都相对较高。和初始接种时相比,整体呈现出一个下降的趋势。pH值为8.0的培养基下降的较少,岩藻黄素含量相对较高。

图8 不同pH条件下OD值(a)、细胞数(b)、干重(c)和岩藻黄素含量(d)的变化Fig.8 Effects of different pH on the OD value (a), cell counts (b),dry biomass concentration (c) and the fucoxanthin content (d) of P. tricornutum
Huang C C等[16]研究发现在光照强度较低时,叶绿素a和其他捕光色素(叶绿素b、叶绿素c和岩藻黄素等)含量增加;在光照强度较高时,一些次级类胡萝卜素(如β-胡萝卜素、虾青素和叶黄素)等起光保护作用的色素的含量会增加。本次实验中,由于户外光照强度的不断变化,岩藻黄素含量呈现出波动式的变化,并且与之前的研究规律相同。研究表明在pH 8.0的条件下,岩藻黄素的含量相对较高,这可能由于偏离最适pH后,三角褐指藻胞内相关代谢活动受抑制所造成的。
由此可以看出pH 8.0的条件下,不仅适合三角褐指藻的生长,更有利于岩藻黄素的积累。
2.6 培养基氮源的种类对三角褐指藻户外生长情况及岩藻黄素含量的影响
如图9a、8b和9c所示,与碳酸氢铵相比尿素对三角褐指藻生长的促进效果更加显著(p<0.05),最终OD值为0.667、细胞密度为4.0×106/mL、干重为150.83 mg/L。从表5可以看出,以尿素为氮源三角褐指藻的比生长速率略高,为0.138。不同氮源对三角褐指藻岩藻黄素含量的影响如图9d所示。


图9 不同氮源条件下OD值(a)、细胞数(b)、干重(c)和岩藻黄素含量(d)的变化Fig.9 Effects of different nitrogen sources on the OD value (a),cell counts (b), dry biomass concentration (c) and the fucoxanthin content (d) of P. tricornutum
从图中可以看出,随着培养时间的变化,岩藻黄素含量呈现出不断下降的趋势。培养至第5 d时,碳酸氢铵中岩藻黄素含量明显高于尿素中岩藻黄素含量,达到9.96 mg/g。从图6c可以看出,氮源优化过程中的光照强度相对较高,最高光强普遍达到 30000 Lux以上,并且温度也相对较高,最高温度基本维持在 26~28 ℃。
氮是微藻生长所必需的,同时也是藻体内蛋白质、核酸及色素合成的重要元素,对微藻的生长发育有着非常重要的作用。光照、温度和氮源类型等对微藻的生长、油脂和色素的积累及多糖含量与脂肪酸组成也有着较为显著的影响[17]。培养过程中岩藻黄素含量的下降可能与培养过程中较高的光照强度、温度及氮源浓度等环境因素紧密相关。
三角褐指藻能利用铵态氮、硝态氮、尿素态氮及其他无机氮源。氮源的种类、浓度都会对三角褐指藻的生长、岩藻黄素的积累产生影响。考虑到生产成本,本实验选用经济实用的尿素和碳铵为氮源,得出尿素更有利于三角褐指藻的生长,碳酸氢铵更有利于岩藻黄素的积累。因此,以碳铵为氮源更有利于岩藻黄素的积累及生产。
2.7 一个光暗周期内岩藻黄素含量变化
如图10所示,一天中不同时刻岩藻黄素含量呈现出波动式的变化趋势,岩藻黄素含量分别在晚上 10时,上午4时及下午4时,取得最大峰值。
在起始的19时~22时,岩藻黄素含量有一个明显的上升。从图6d可以看出,此时温度明显下降,较利于三角褐指藻的生长及岩藻黄素的积累。从 22时以后,由于氮源的缺乏,岩藻黄素含量整体呈现出下降的趋势,并且在光照强度及温度都相对较高的13时,达到最低值。

图10 一个光照周期内岩藻黄素含量变化Fig.10 Changes in the fucoxanthin content of P. tricornutum in a light cycle
3 结论
本研究表明,三角褐指藻在户外开放式跑道池中,在盐度为20、pH值为8.0、碳铵为氮源的环境中生长较快,岩藻黄素的含量较高,适合大规模生产。此外,藻种采集可以选择在晚上10时左右进行,以获得最大生物量和岩藻黄素含量。在今后的研究中,多个因素之间的交互作用,及交互作用下的最优水平,以及户外条件下对光强、温度等的控制仍需要更深入的探究。
[1]Wu H, Li T, Wang G, et al. A comparative analysis of fatty acid composition and fucoxanthin content in sixPhaeodactylum tricornutumstrains from different origins [J].Chinese Journal of Oceanology and Limnology, 2016, 34(2):391-398
[2]Takaichi S. Distributions, biosyntheses and functions of carotenoids in algae [J]. Marine Drugs, 2013, 9(6):1101-1018
[3]Peng J, Yuan J-P, Wu C-F, et al. Fucoxanthin, a marine carotenoid present in brown seaweeds and diatoms:metabolism and bioactivities relevant to human health [J].Marine Drugs, 2011, 9(10): 1806-1828
[4]Gammone M A, D'Orazio N. Anti-obesity activity of the marine carotenoid fucoxanthin [J]. Marine Drugs, 2015,13(4): 2196-214
[5]Woo M-N, Jeon S-M, Kim H J, et al. Fucoxanthin supplementation improves plasma and hepatic lipid metabolism and blood glucose concentration in high-fat fed C57BL/6N mice [J]. Chemico-Biological Interactions, 2010,186(3): 316-322
[6]臧正蓉,解修俊,赵佩佩,等.温度和光照对三角褐指藻的生长及岩藻黄素含量的影响[J].海洋科学,2015,39(7):1-6 ZANG Zheng-rong, XIE Xiu-jun, ZHAO Pei-pei, et al.Effects of temperature and light on growth and fucoidan content ofPhaeodactylum tricornutum[J]. Marine Sciences,2015, 39(7): 1-6
[7]Xia S, Wang K, Wan L, et al. Production, characterization,and antioxidant activity of fucoxanthin from the marine diatomOdontella aurita[J]. Marine Drugs, 2013, 11(7):2667-2681
[8]Kim S M, Jung Y-J, Kwon O N, et al. A potential commercial source of fucoxanthin extracted from the microalgaPhaeodactylum tricornutum[J]. Applied Biochemistry and Biotechnology, 2012, 166(7): 1843-1855
[9]Carvalho A P, Meireles L A, Malcata F X. Microalgal reactors:a review of enclosed system designs and performances [J].Biotechnology Progress, 2006, 22(6): 1490-1506
[10]Norsker N-H, Barbosa M J, Vermu M H, et al. Microalgal production-a close look at the economics [J]. Biotechnology Advances, 2011, 29(1): 24-27
[11]Guillard R R L. Culture of phytoplankton for feeding marine invertebrates [M]. Culture of marine invertebrate animals.Springer, 1975
[12]Sugawara T, Matsubara K, Akagi R, et al. Antiangiogenic activity of brown algae fucoxanthin and its deacetylated product, fucoxanthinol [J]. Journal of Agricultural and Food Chemistry, 2006, 54(26): 9805-9810
[13]赵萍,邹宁,孙东红,等.盐度对三角褐指藻生长及有机质积累的影响[J].中国油料作物学报,2013,35(2):217-220 ZHAO Ping, ZOU Ning, SUN Dong-hong, et al. Effects of salinity on growth and organic matter accumulation ofPhaeodactylum tricornutum[J]. Chinese Journal of Oil Crop Sciences, 2013, 35(2): 217-220
[14]陈峰,姜悦.微藻生物技术[M].北京:中国轻工业出版社,1999 CHEN Feng, JIANG Yue. Thematic technology of microalgae [M]. Beijing: China Light Industry Press, 1999
[15]吴伟伟.环境因子和抑制剂对三角褐指藻脂肪酸合成的影响[D].南京:南京农业大学,2012 WU Wei-wei. Effects of environmental factors and inhibitors on fatty acid synthesis ofPhaeodactylum tricornutum[D].Nanjing: Nanjing Agricultural University, 2012
[16]Huang C C, Hung J J, Peng S H, et al. Cultivation of a thermo-tolerant microalga in an outdoor photobioreactor:influences of CO2and nitrogen sources on the accelerated growth [J]. Bioresource Technology, 2012, 112(112): 228
[17]Gómez-Loredo A, Benavides J, Rito-Palomares M. Growth kinetics and fucoxanthin production of Phaeodactylum tricornutum, and Isochrysis galbana, cultures at different light and agitation conditions [J]. Journal of Applied Phycology,2016, 28(2): 849-860

