超高效液相色谱串联质谱检测动物组织中卡马西平及其代谢物的残留量
杨盛茹,姚喜梅,邹建,刘洪斌
(1.河南牧业经济学院食品工程学院,河南郑州 450046)(2.中国标准化协会,北京 100048)(3.中国动物疫病预防控制中心,北京 102609)
卡马西平作为《世界卫生组织基本药物标准清单》和《中国国家基本药物目录》在列药物,主要用于治疗癫痫和三叉神经痛等精神疾病[1]。同时具有治疗心律失常和抗利尿的作用,但随着该类药物的广泛使用,其毒副作用也日益受到重视。较常见的不良反应有视力模糊或复视、惊厥,剧烈眩晕或嗜睡,诱发的刺激抗利尿激素释放,可引起水钠潴留。水钠潴留可造成组织水肿,体重异常增加[2]。这为不法分子向动物体内非法注水,并通过药物保水抗利尿功能,以达到增重增收的目的提供了可能。同时新版兽药典并未收录卡马西平及其代谢物,因此检测动物组织中卡马西平及其代谢物异常含量,对打击非法药物添加和注水具有重要意义。
自2001年开始,关于卡马西平及其代谢物的检测研究多见于医学研究领域[3~6],主要有分光光度法[7,8]、液相色谱法[9,10]、离子色谱法[11]和质谱法[12,13];近几年环境领域的研究也逐步开展[14,15],目前尚未见有动物组织中检测方法的报道,因此本文建立动物组织中卡马西平及其代谢物残留超高效液相色谱串联质谱检测方法,方法前处理操作简单,灵敏度高,稳定性好,能较好的满足动物组织中卡马西平及其代谢物的检测需求,以便更好地防范和监管动物源性食品非法添加的问题。
1 实验部分
1.1 试剂与耗材
卡马西平、10,11-环氧化卡马西平购于百灵威公司,纯度均在97%以上;乙腈、甲醇、乙酸乙酯和甲酸等有机溶剂均为色谱纯,购自美国 Fisher公司;Waters Oasis PRiME HLB SPE柱(60 mg,3 cc)购于美国waters公司。
用甲醇将上述标准品配制单标母液,并配制 10 μg/mL混合储备液于-20 ℃保存,使用时现配成系列标准工作液;猪肉、猪肝和猪肾购于农贸市场,经LC-MS/MS分析确认为阴性样本。
1.2 仪器设备
超高效液相色谱仪(Acquity UPLC)配三重四极杆质谱仪(quattro premier XE),美国waters公司;3K15型离心机,美国sigma公司;纯水仪,美国millipore公司。
1.3 实验部分
1.3.1 前处理过程
提取:准确称取2 g(精确到0.01 g)动物组织样品于50 mL离心管中,加入10 mL 0.2%甲酸乙腈,9500 r/min离心5 min取上清液于另一50 mL离心管中,再用10 mL 0.2%甲酸乙腈重复提取一次,合并两次提取液,待过净化柱。
净化:将提取液全部转移至事先用3 mL 0.2%甲酸乙腈活化的Oasis PRiME HLB柱中,流速1~2 d/s,收集全部滤过液,50 ℃氮气吹至近干,1 mL初始流动相定容,12000 r/min离心5 min,0.22 μm滤膜过滤待上机测定。
1.3.2 液相条件
色谱柱:Acquity UPLC BEH C18 (100 mm×2.1 mm,1.7 μm);流速:0.3 mL/min;流动相A:甲醇,B:0.1%甲酸水溶液,0~0.5 min,3%A 保持不变,0.5~3.5 min,3%A线性变化至90%;3.5~5.0 min,90%A保持不变,5.0~5.5 min,90%A线性变化至3%;5.5~8.0 min,3%A保持不变。
1.3.3 质谱条件
电离模式:ESI+;毛细管电压:3.5 kV;萃取锥孔电压:3 V;RF透镜电压:0.5 V;源温:110 ℃;脱溶剂温度:350 ℃;锥孔气流速:50 L/h;脱溶剂气流速:550 L/h;碰撞气流速:0.17 mL/min;采集模式:MRM;各种药物优化母离子和子离子及对应聚焦电压和碰撞电压值见表1。
2 结果与讨论
2.1 质谱条件优化

图1 卡马西平及其代谢物母离子及其碎片离子结构图Fig.1 Structures of parent and fragment ions of carbamazepine and its metabolites
由于卡马西平及其代谢物具有伯胺结构,试验考虑采用正离子模式,将浓度为1 mg/L的卡马西平及其代谢物标准溶液以流动泵直接进样方式采集卡马西平及 10,11-环氧化卡马西平准分子离子峰m/z237.2和m/z 253.2,对其准分子离子峰进行二级质谱扫描,得到定性和定量碎片离子信息,卡马西平子离子峰为m/z192和m/z194,10,11-环氧化卡马西平子离子峰为m/z180和m/z210,然后对碰撞气能量、电喷雾电压、雾化气、源温等质谱参数进行优化,卡马西平及其代谢物母离子及其碎片离子结构图见图1。质谱采集的驻留时间(dwell time)的设定,对目标化合物峰型采集的准确性和相应的灵敏度至关重要,过大的驻留时间能降低单位时间采集色谱峰的采样点数,从而影响目标化合物的灵敏度和准确性,而过小的驻留时间则会增加采集点数,但会降低扫描频次,因此实验经优化,最终确定0.1 ms作为实验用最优驻留时间。
2.2 不同过滤膜对药物回收率的影响

图2 不同滤膜过滤条件下回收率对比图Fig.2 Comparison of recoveries under different filtration membrane filtration conditions
前处理过程中过滤步骤是去除杂质,基质效应和保护仪器的关键环节,因此滤膜的选择在前处理方法优化中至关重要,本文考察了 4种型号的滤膜对 50 μg/L混合标准溶液的吸附影响,试验选取津腾有机尼龙膜、聚醚砜膜、Waters PTFE膜和Agilent PTFE膜等四种适用于绝大多数有机溶剂和水溶液的滤膜,通过图2可以看出waters PEFT膜滤对两种药物均有吸附,吸附率分别是46%和43.2%;津腾有机尼龙膜对10,11-环氧化卡马西平吸附严重,吸附率在42.2%;聚醚砜膜与Aglient PTFE滤膜滤过性能较好,药物吸附更少,综合性价比考虑,试验选取聚醚砜膜作为实验用过滤膜。
2.3 前处理条件
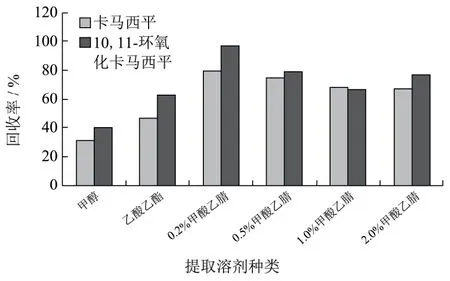
图3 不同提取条件下回收率Fig.3 Recoveries under different extraction methods
目前关于卡马西平及其代谢物的研究多见于医学和环境领域,基质多为血浆[3~7]、尿液[16]和环境废水[14,15]等,前处理方法较为简单,动物组织中前处理方法未见报道,鉴于动物组织的复杂性,本文通过空白猪肝样品添加 10 µg/kg卡马西平及其代谢物混标溶液,分别选取甲醇、乙酸乙酯、0.2%甲酸乙腈、0.5%甲酸乙腈、1%甲酸乙腈和2%甲酸乙腈为提取溶剂处理样品,结果表明:当甲醇为提取剂时,蛋白沉淀差,样品整体较为浑浊,杂质干扰较大;乙酸乙酯为提取剂时,沉淀蛋白较完全,但回收率较差,卡马西平回收率仅为46.1%,实验中酸化乙腈为提取溶剂,提取效率普遍高于60%,原因主要为酸性条件有助于该类药物在提取溶剂的溶解;但通过图3可以看出随着酸量的增加,回收率略有下降,0.2%甲酸乙腈提取效果最好,卡马西平及其代谢物回收率均能达到75%以上。
提取液经Oasis PRiME HLB固相萃取柱净化,Oasis PRiME HLB是一新型的反相吸附剂,该吸附剂利用了Oasis HLB的水可浸润性和保留特性,无需进行吸附剂的活化和平衡步骤,根据提取溶剂有机相比例不同,可分为捕获+洗脱型和通过型两种净化模式,该款萃取柱能够去除蛋白、盐和磷脂等95%以上的基质干扰物,即使是跟HLB相比,它能够去除比HLB多90%的磷脂,能够有效去除动物组织样品中的大部分基质干扰,实验结果表明,卡马西平及其代谢物适用于Oasis PRiME HLB固相萃取柱通过型净化模式,回收率能达到70%以上。
2.4 基质效应

图4 基质效应图Fig.4 The matrix effect in animal matrix
动物组织成分较为复杂,样品虽经前处理,但仍有各种有机物(脂类、糖类、可溶性蛋白或肽类及其代谢产物等)保留在待测样品溶液中,当这些物质与目标化合物共流出色谱柱进入电离源时,将严重影响目标化合物的离子化过程,对检测药物的信号产生抑制或增强的效果。试验采用提取后添加法量化基质效应的影响,试验按照1.3.1方法处理组织样本(猪肉、猪肝和猪肾),然后添加10 μg/kg混合标准溶液制成基质加标溶液,与溶剂加标溶液进行比较,基质效应(ME)=标液在空白动物组织中峰面积/标液在纯溶剂中峰面积,若比值小于1.0,说明基质对待测物的响应产生抑制作用;若大于1.0,说明基质的存在增强效果;若等于1.0,说明待测物的响应未受影响。试验结果发现2种药物在三种基质中均存在不同程度的基质抑制作用,其中猪肾基质对两种药物存在严重抑制作用,ME分别为0.45和0.37;两种药物在猪肉基质抑制效果不明显,因此为减少基质效应带来的影响,应在实际检测中采用空白基质加标溶液。不同药物基质抑制程度见图4。
2.5 线性方程及灵敏度实验
实验采用空白组织样品经 1.3.1方法处理,在1.0~50.0 µg/L浓度范围内分别添加卡马西平及其代谢物混标溶液,配制1.0、2.0、5.0、10.0、20.0、50.0 µg/L基质加标溶液,依次进样,以定量离子色谱峰面积为纵坐标,化合物浓度为横坐标做标准曲线,实验结果表明在猪肉、猪肝、猪肾组织中,卡马西平及其代谢物在1.0~50.0 µg/L范围内均能线性良好,相关系数均大于0.999,以猪肾组织为例,卡马西平及其代谢物线性方程、相关系数、检出限和定量限等参数见表2。
将处理好的空白组织样品逐级稀释标准溶液,按3倍信噪比确定方法检出限(LOD),10倍信噪比确定方法的定量限(LOQ),卡马西平及其代谢物的方法定量限均为1.0 μg/kg。

表2 猪肾中卡马西平及其代谢物线性方程、相关系数、检出限和定量限Table 2 Linear equations, correlation coefficients, detection limits, and quantification limits of carbamazepine and its metabolites in porcine kidney

表3 动物组织中卡马西平及其代谢物添加回收率、RSD值(n=6)Table 3 Spiked recoveries, RSDs of carbamazepine and its metabolites in animal matrix(n=6)
取空白猪肉、猪肝、猪肾样品,添加浓度为1.0、10、20 µg/kg三个水平混标溶液,每个浓度6个平行,按1.3.1方法进行添加回收实验,空白样品与添加样品总离子图(以猪肾样本为例)见图 5、6,回收率为70.9%~106.8%,RSD%值为1.43%~10.3%,结果见表3。
2.6 回收率实验

图5 空白猪肾样品MRM图Fig.5 The MRM chromatograms of the blank porcine kidney
图6 空白猪肾基质中添加1.0 μg/kg卡马西平及其代谢物选择离子图Fig.6 The chromatograms obtained from blank porcine kidney spiked with 1.0 µg/kg of carbamazepine and its metabolites
2.7 实际样品检测
本实验对从屠宰场及农贸市场共抽检猪肉、肝、肾样品50份进行测定,并随样由不同实验人员进行盲样添加试验,最终从抽检的50份样本中未检出卡马西平及其代谢物,随测盲样检出卡马西平4.7 µg/kg(添加量为5.0 µg/kg),检测结果符合欧盟2002/657/EC中对回收率的要求,进一步证实该方法适用于动物组织中卡马西平及其代谢物检测。
3 结论
本实验通过卡马西平及其代谢物结构分析对其液相、质谱参数进行优化,并优化提取试剂和过滤膜,最终建立了动物组织中卡马西平及其代谢物UPLC-MS/MS检测方法,通过方法学验证和基质效应研究证实该方法灵敏度较高,回收率和稳定性较好,能够满足动物组织中该类药物残留检测要求,对防范人药兽用、非法添加行为和打击注水肉提供一定的技术依据。
[1]Alrashood S T. Chapter three-Carbamazepine [J]. Profiles of Drug Substances, Excipients and Related Methodology, 2016,41: 133-321
[2]喻东山.卡马西平不良反应和药物相互作用的研究进展[J].医药导报,2010,29(10):1281-1284 YU Dong-shan. Advances in the study of carbamazepine adverse reactions and drug interactions [J]. Herald of Medicine, 2010, 29(10): 1281-1284
[3]Roberto M, Fiorenzo A, Giovanna C, et al. Simultaneous high-performance liquid chromatography determination of carbamazepine and five of its metabolites in plasma of epileptic patients [J]. Journal of Chromatography B:Biomedical Sciences and Applications, 2001, 762(2): 109-116
[4]Van R G F, Badenhorst D, Swart K J, et al Determination of carbamazepine and carbamazepine 10,11-epoxi- de in human plasma by tandem liquid chromatography-mass spectrometry with electrospray ionization [J]. Journal of Chromatography B, 2002, 769(1): 1-7
[5]ZHU Yong-xin, CHANG Hua, Wulster-Radcliffe M, et al.Liquid chromatography/tandem mass spectrometry for the determination of carbamazepine and its main metabolite in rat plasma utilizing an automated blood sampling system [J].Journal of Pharmaceutical and Biomedical Analysis, 2005,38(1): 119-125
[6]Lopes B R, Barreiro J C, Baraldi P T,et al. Quantification of carbamazepine and its active metabolite by direct injection of human milk serum using liquid chromatography tandem ion trap mass spectrometry [J]. Journal of Chromatography B,2012, 889: 17-23
[7]Kanakapura B, Sameer A M. Utilization of bromination reactions for the determination of carbamazepine using bromate-bromide mixture as a green brominating agent [J].Arabian Journal of Chemistry, 2014, 7(3): 297- 305
[8]陈世文,刘玲,姜宁.紫外分光光度法测定癫痫患者的卡马西平血药浓度[J].中国药业,2010,19(9):18-19 CHEN Shi-wen, LIU Ling, JIANG Ning. Determination of Serum carbamazepine concentration by UV-spectrophoto-mentry [J]. China Pharmaceuticals, 2010, 19(9): 18-19
[9]Maryam V, Shiva G, Masoumeh S. Chemometrics enhanced HPLC-DAD performance for rapid quantification of carbamazepine and phenobarbital in human serum samples[J]. Talanta, 2014, 119(5): 17-23
[10]阙万才,丘宏强,程昱,等.固相萃取_高效液相色谱法测定人血浆中奥卡西平及其代谢产物10-羟基卡马西平的浓度[J].中国临床药理学杂志,2015,31(22):2254-2256 QUE Wan-cai, QIU Hong-qiang, CHENG Yu, et al.Determination of oxcarbazepine and its metabolite 10,11-dihydro-10-hydroxy carbamazepine in human plasma by solid phase extraction and HPLC [J]. Chin. J Clin.Pharmacol., 2015, 31(22): 2254-2256
[11]WU Shu-chao, XU Wei, Qamar S, et al. Ion chromatography combined with online electrochemical derivatization and fluorescence detection for the determination of carbamazepine in human plasma [J]. Talanta, 2012, 101(22):541-545
[12]QU Li-hua, FAN Yuan-jie, WANG Wen-jun, et al.Development, validation and clinical application of an online-SPE-LC-HRMS/MS for simultaneous quantification of phenobarbital, phenytoin, carbamazepine, and its active metabolite carbamazepine 10,11-epoxide [J]. Talanta, 2016,158: 77-88
[13]戴博,张华峰,宋青,等.高效液相色谱-质谱联用法同时测定苯巴比妥、丙戊酸钠、苯妥英钠和卡马西平的血药浓度[J].中国临床药理学杂志,2011,27(3):213-215 DAI Bo, ZHANG Hua-feng, SONG Qing, et al.Determination the concentrations of phenobarbital, sodium valproate, phenytoin sodium and carbamazepine in human plasma for simultaneous quantification by HPLC-MS [J].Chin. J Clin. Pharmacol., 2011, 27(3): 213-215
[14]TEO Hui-ling, WONG Ling-kai, LIU Qin-de, et al. Simple and accurate measurement of carbamazepine in surface water by use of porous membrane-protected micro-solid-phase extraction coupled with isotope dilution mass spectrometry[J].Analytica Chimica Acta, 2016, 912: 49-57
[15]Oberleitner L, Dahmen-Levison U, Garbe L A,et al.Application of fluorescence polarization immunoassay for determination of carbamazepine in wastewater [J]. Journal of Environmental Management, 2017, 193: 92-97
[16]Behbahani M, Najafi F, Bagheri S, et al.Application of surfactant assisted dispersive liquid-liquid microextraction as an efficient sample treatment technique for preconcentration and trace detection of zonisamide and carbamazepine in urine and plasma samples [J]. Journal of Chromatography A, 2013,1308(14): 25-31

