气相色谱法检测水产品中拟除虫菊酯类农药的基质效应研究
李丽春,刘书贵,尹怡,郑光明,马丽莎,戴晓欣,单奇,赵城
(中国水产科学研究院珠江水产研究所,农业部水产品质量安全风险评估实验室(广州),农业部休闲渔业重点实验室,广东广州 510380)
拟除虫菊酯类农药(Pyrethroids)是一类高效广谱、低毒低残留且可生物降解的新型杀虫剂,广泛运用于农业、林业和渔业生产中[1,2]。农业和林业生产中使用的拟除虫菊酯类农药随农田排水和地表径流等进入水体,严重破坏水生生态系统结构和功能,并通过食物链进入人体,给人类健康带来严重隐患[1,3]。随着水产品中农药残留问题的日趋严重,欧盟规定了水产品中氯氰菊酯最高残留量为50 µg/kg,溴氰菊酯为10µg/kg[4]。日本“肯定列表制度”中规定了鲑形目:大马哈鱼(Oncorhynchus keta)和虹鳟(Oncorhynchusmykiss)等中氯氰菊酯、溴氰菊酯最高残留限量为30 µg/kg,其他鱼及水生动物均为 10 µg/kg[5],中国农业部 235号公告也规定鱼肌肉中溴氰菊酯最大残留限量为 30µg/kg[6]。目前水产品中农药残留主要集中在有机磷和有机氯农药[7~12],菊酯类农药研究较少,其残留检测方法主要有气相色谱法(GC)[15~17]、气相色谱质谱法(GC-MS)[13~16]、高效液相色谱法(HPLC)[17~20]和酶联免疫分析方法[21],大多采用层析柱法,前处理方法繁琐,检测灵敏度低,难以满足越来越严格的限量要求。因此建立水产品中拟除虫菊酯类农药简单、快速、准确的测定方法具有重要的现实意义,可为水产品中拟除虫菊酯类农药残留量的快速测定及其药代动力学和风险评估研究提供技术支持。
基质效应主要指试样中的非待测组分影响待测物浓度或质量测定的准确度,引起待测物响应值增加或减少的现象[22~24]。水产品中蛋白质和脂肪等杂质较复杂,容易引起基质增强或基质抑制效应。研究表明样品提取[25]、固相萃取净化[26]、同位素标记[27,28]和去除基质中磷脂等可以有效减少或者消除基质效应。目前农药残留分析的基质效应研究大多在蔬菜、谷物和水果中[29~37],水产品中拟除虫菊酯类农药残留测定的基质效应的研究尚未见报道。为了确保水产品中菊酯类农药检测的准确性,本研究拟建立气相色谱法检测水产品中9种拟除虫菊酯的方法,并对其基质效应进行探讨,为有效消除或补偿农药残留测定中的基质效应提供理论依据,为拟除虫菊酯类农药在水产品中的准确定量分析提供技术支持。
1 材料与方法
1.1 材料和试剂
拟除虫菊酯类农药 9种,分别为:七氟菊酯(Tefluthrin)、三氟氯氰菊酯(Cyhalothrin)、联苯菊酯(Bifenthrin)、氯菊酯(Permethrin)、氟氯氰菊酯(Cyfluthrin)、甲氰菊酯(Fenpropathrin)、氯氰菊酯(Cypermethrin)、氰戊菊酯(Fenvalerate)和溴氰菊酯(Deltamethrin),纯度为 99.0%~99.8%,德国Dr.Ehrenstorfer公司;乙腈(色谱纯)和正己烷(色谱纯),韩国Honeywell Burdick & Jackson公司;无水硫酸镁(分析纯)和氯化钠(分析纯),国药集团化学试剂有限公司;N-丙基乙二胺(PSA,40~60 μm)和中性氧化铝(100~300目),天津博纳艾杰尔科技公司;水产品基质分别为:罗非鱼(Oreochromis spp)、草鱼(Ctenopharyngodon idellus)、鲫鱼(Carassius auratus)、对虾(Penaeus orientalis)和鲢鱼(Hypophthalmichthys molitrix),购买于当地水产品市场,样品购回后取肌肉组织匀浆-18 ℃保存待用。
1.2 仪器设备
气相色谱仪(Agilent 7890A),配备63Ni-ECD检测器,HP-5(5%苯基甲基聚硅氧烷)毛细管色谱柱(30 m×0.32 mm×0.25 μm),天平(XS5003SXDR),氮吹仪(N-EVAP-112,USA),离心机(TDL-5-A),漩涡振荡器(MS3,IKA,Germany)及其他常规器皿等。
1.3 标准溶液的配制
分别准确称取七氟菊酯、三氟氯氰菊酯、联苯菊酯、氯菊酯、氟氯氰菊酯、甲氰菊酯、氯氰菊酯、氰戊菊酯和溴氰菊酯标准品 10.0 mg,用正己烷定容至10 mL,配制成1.0 mg/mL单标标准储备液。分别移取100 μL 9种菊酯类农药单标标准储备液于同一容量瓶中,用正己烷定容至10 mL配制成10 μg/mL混合标准溶液于-20 ℃避光保存。采用系列稀释法将混合标准溶液配制成 2.5、5.0、10、50、100、200、500和750 ng/mL的系列工作溶液备用。
1.4 前处理方法
准确称取混合均匀的基质样品5.0±0.1 g,加入10 mL乙腈、2.0 g无水硫酸镁和1.0 g氯化钠,涡旋振荡提取1 min,以5000 r/min离心5 min,上层提取液转入装有PSA 200 mg、中性氧化铝300 mg和无水硫酸镁300 mg的离心管中,剩余残渣再用5 mL乙腈提取一次,合并提取液,涡旋振荡1 min,然后5000 r/min离心5 min,上层净化液,转移至50 mL玻璃指型管中,氮气吹干,用1 mL正己烷定容,过0.22 μm微孔滤膜待气相色谱仪检测。
1.5 气相色谱条件
气相色谱仪7890A(Agilent),63Ni-ECD检测器,色谱柱为 HP-5毛细管柱,(5%苯基甲基聚硅氧烷),30 m×0.32 mm×0.25 μm;载气为99.999%高纯氮气,流速为1.5 mL/min。进样口温度为270 ℃,进样量1 μL,不分流进样;柱温程序为初始温度160 ℃,维持3 min,以30 ℃/min升至250 ℃,维持0 min,再以7.5 ℃/min升至 280 ℃,保持 5 min。柱流速为 2.5 mL/min (恒定流量)。检测器温度为300 ℃,尾吹气流速为25 mL/min。
1.6 基质效应
采用基质提取后加标法分析基质种类、基质浓度和目标分析物浓度对基质效应的影响,分别测定空白基质提取液与纯溶剂中同浓度目标物的响应强度,通过二者峰面积的相对比值评价基质效应(Matrix effect,ME)[33],即ME=基质中目标物峰面积/溶剂中目标物峰面积。如果ME大于1.0,说明基质对目标化合物具有增强响应强度的作用,如果ME小于1.0,说明基质对目标化合物具有抑制其响应强度的作用;如果ME等于1.0,则说明基质对目标化合物无影响,即不存在基质效应;ME偏离 1.0越大说明基质效应越强,ME越接近1.0,则表明基质效应越小[38~43]。
1.7 数据统计分析
本文中实验数据采用Excel 2016计算平均值、标准差和相对标准偏差等,并将每个处理6组数据进行加权平均后采用GraphPad Prism 5作折线图和柱形图比较分析。
2 结果与讨论
2.1 线性范围、检测限和定量限
采用系列稀释法配制不同浓度的拟除虫菊酯混合标准溶液,按照本方法确定的色谱条件进行测定,以峰面积为纵坐标Y,浓度为横坐标X建立标准曲线,获得其线性方程及相关系数(表1)。在浓度为5.0~750 ng/mL范围内联苯菊酯、甲氰菊酯、三氟氯氰菊酯、氟氯氰菊酯、氯氰菊酯、氰戊菊酯和溴氰菊酯线性良好,相关系数在0.9996~0.9998之间;在浓度为2.5~750 ng/mL范围内七氟菊酯线性良好,相关系数为0.9999;在浓度为10~750 ng/mL范围内氯菊酯线性良好,相关系数为0.9998。分别以性噪比(S/N)等于3和10计算方法中农药的检出限(LOD)和定量限(LOQ)。联苯菊酯、甲氰菊酯、三氟氯氰菊酯、氟氯氰菊酯、氯氰菊酯、氰戊菊酯和溴氰菊酯LOD和LOQ分别为1.0 µg/kg和3.0 µg/kg;七氟菊酯LOD和LOQ分别为0.5 µg/kg和2.0 µg/kg;氯菊酯LOD和LOQ分别为2.0 µg/kg 和 5.0 µg/kg。

表1 9种菊酯类农药线性方程、相关系数、检测限和定量限Table 1 Linear equation, correlation coefficient, LOD and LOQ for 9 pyrethroid pesticides
2.2 回收率和精密度
采用基质加标的方法分别考察了 5.0、50和100µg/kg三个浓度水平的加标回收率,每个水平设置 6次重复,并对其加标回收率及日内精密度和日间精密度进行了测定,测定结果见表2和表3。由表2和表3可知,9种拟除虫菊酯类农药在添加浓度为 5.0、50和100 µg/kg三个水平下,在5种水产品中平均加标回收率在80.1±2.95%~116±2.45%(n=6),日内精密度和日间精密度分别为 0.272%~10.7%(n=6)和0.164%~12.8%(n=6)。其中低浓度水平下回收率明显较高浓度水平高,可能是由于低浓度下存在较强的基质增强效应引起。该方法检测水产品中9种菊酯类农药前处理操作简单快捷,溶剂用量少,回收率和精密度较好,在仪器稳定条件下该方法完全满足国内外对水产品中拟除虫菊酯类农药残留检测的要求。

表2 9种拟除虫菊酯类农药在5种水产品中日内加标回收率和精密度Table 2 The intra-day recoveries and precisions of 9 pyrethroid pesticides in 5 aquatic products (n=6)
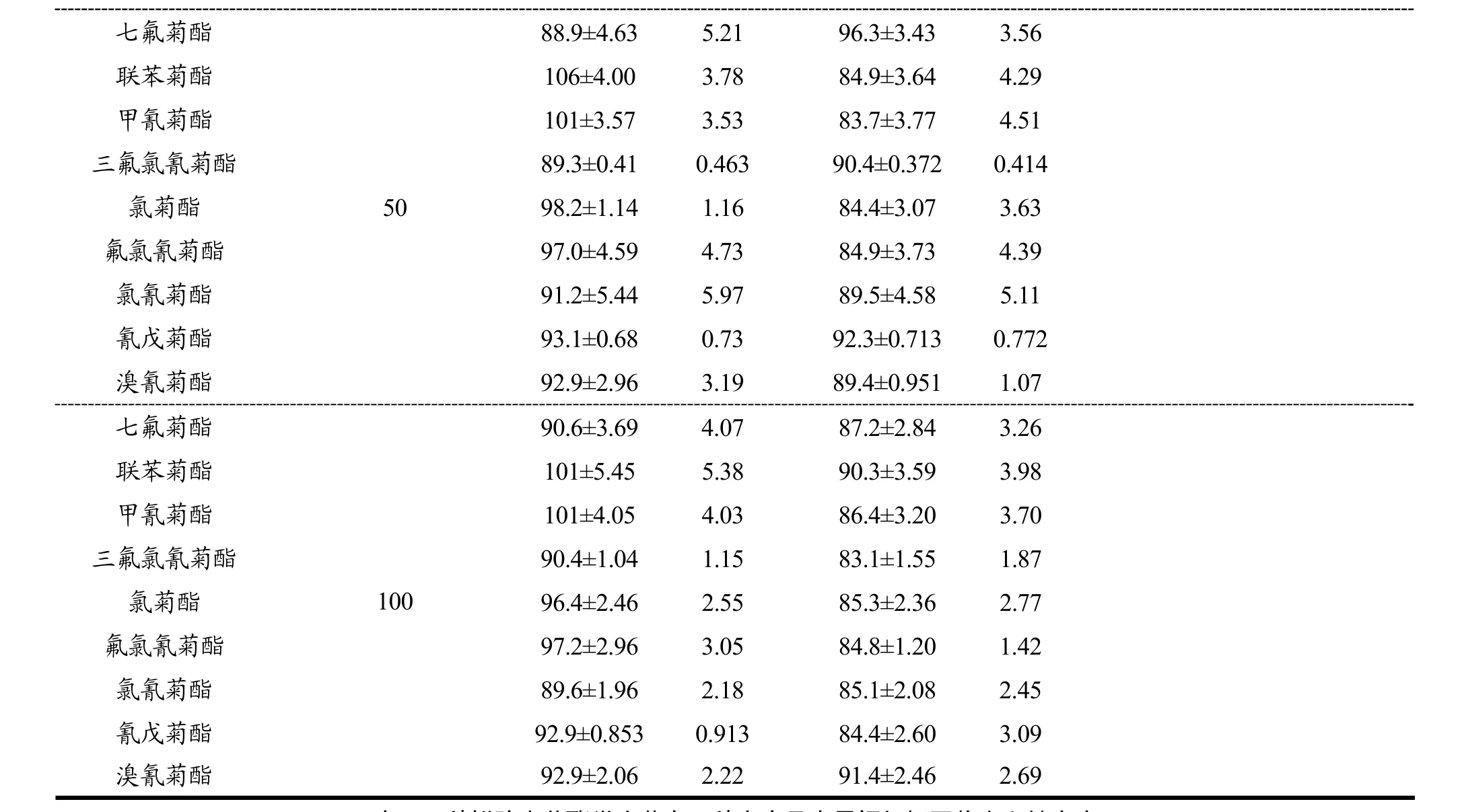
七氟菊酯50 88.9±4.63 5.21 96.3±3.43 3.56联苯菊酯 106±4.00 3.78 84.9±3.64 4.29甲氰菊酯 101±3.57 3.53 83.7±3.77 4.51三氟氯氰菊酯 89.3±0.41 0.463 90.4±0.372 0.414氯菊酯 98.2±1.14 1.16 84.4±3.07 3.63氟氯氰菊酯 97.0±4.59 4.73 84.9±3.73 4.39氯氰菊酯 91.2±5.44 5.97 89.5±4.58 5.11氰戊菊酯 93.1±0.68 0.73 92.3±0.713 0.772溴氰菊酯 92.9±2.96 3.19 89.4±0.951 1.07七氟菊酯100 90.6±3.69 4.07 87.2±2.84 3.26联苯菊酯 101±5.45 5.38 90.3±3.59 3.98甲氰菊酯 101±4.05 4.03 86.4±3.20 3.70三氟氯氰菊酯 90.4±1.04 1.15 83.1±1.55 1.87氯菊酯 96.4±2.46 2.55 85.3±2.36 2.77氟氯氰菊酯 97.2±2.96 3.05 84.8±1.20 1.42氯氰菊酯 89.6±1.96 2.18 85.1±2.08 2.45氰戊菊酯 92.9±0.853 0.913 84.4±2.60 3.09溴氰菊酯 92.9±2.06 2.22 91.4±2.46 2.69
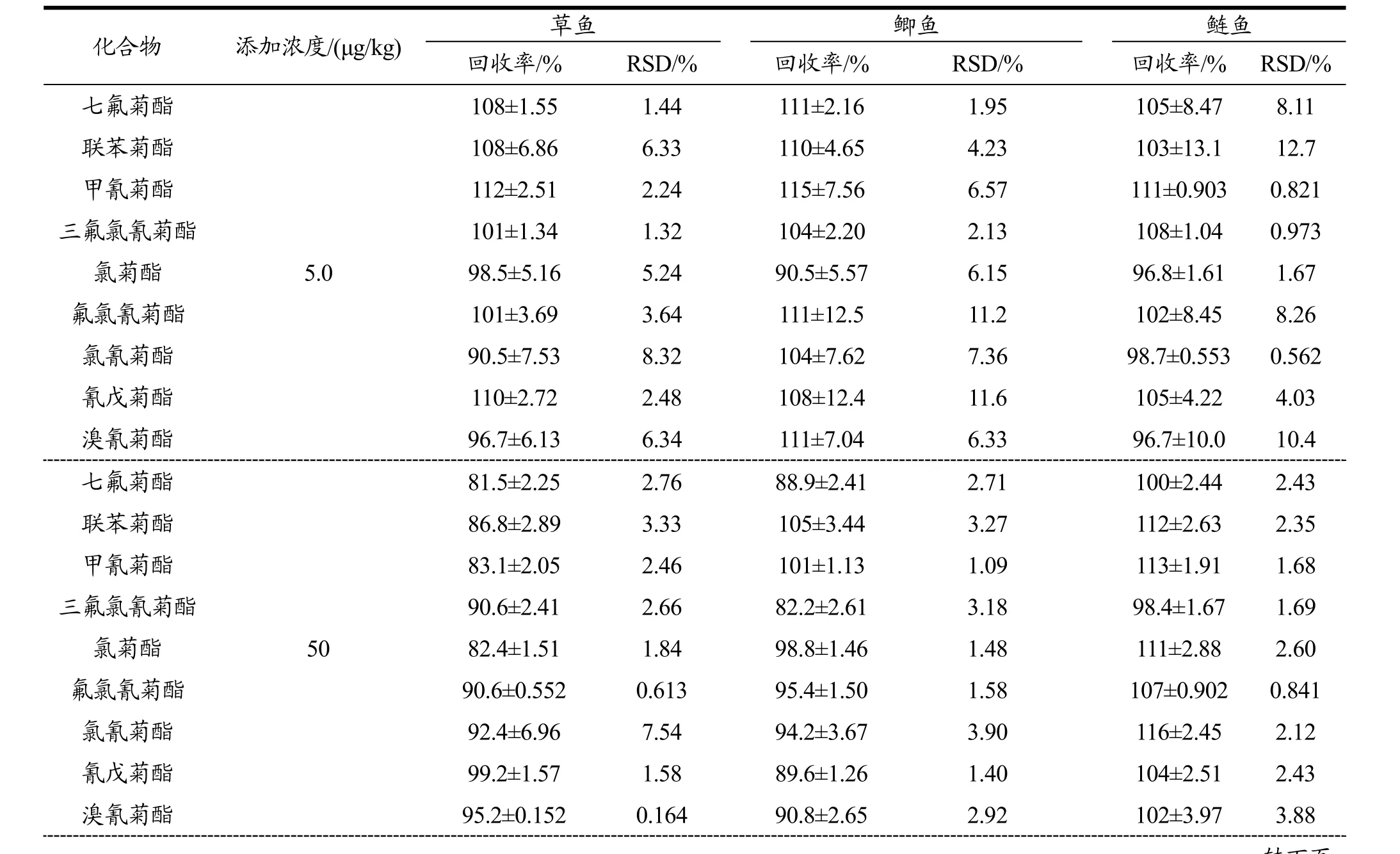
表3 9种拟除虫菊酯类农药在5种水产品中日间加标回收率和精密度Table 3 The inter-day recoveries and precisions of 9 pyrethroid pesticides in 5 aquatic products (n=6)

七氟菊酯100 92.7±3.04 3.28 97.7±4.41 4.51 86.0±2.50 2.01联苯菊酯 99.2±2.42 2.42 95.9±3.71 3.87 105±2.12 1.36甲氰菊酯 93.5±3.64 3.89 94.3±2.98 3.16 94.1±1.28 4.85三氟氯氰菊酯 85.5±2.64 3.09 85.2±2.76 3.23 87.8±4.26 1.32氯菊酯 101±2.63 2.60 93.7±3.47 3.70 91.6±1.21 1.37氟氯氰菊酯 88.2±1.12 1.27 91.0±0.828 0.912 91.3±1.25 4.09氯氰菊酯 91.7±1.67 1.82 92.2±2.22 2.40 90.8±3.71 2.16氰戊菊酯 90.1±1.12 1.24 104±4.10 3.93 86.2±1.86 2.53溴氰菊酯 89.1±1.46 1.64 88.9±2.26 2.55 89.7±2.27 2.01化合物 添加浓度/(μg/kg) 罗非鱼 对虾回收率/% RSD/% 回收率/% RSD/%七氟菊酯5.0 112±10.3 9.23 95.7±2.57 2.68联苯菊酯 113±7.62 6.77 88.4±7.11 8.04甲氰菊酯 105±4.29 4.10 97.7±1.17 1.20三氟氯氰菊酯 112±4.35 3.87 90.2±0.327 0.367氯菊酯 102±6.25 6.16 107±1.28 1.20氟氯氰菊酯 106±6.20 5.86 112±8.79 7.85氯氰菊酯 108±13.8 12.8 101±7.03 6.96氰戊菊酯 100±7.22 7.20 88.2±2.04 2.32溴氰菊酯 102±10.0 9.85 91.6±4.40 4.80七氟菊酯50 92.0±2.56 2.78 103±5.41 5.24联苯菊酯 102±4.88 4.78 81.6±2.77 3.40甲氰菊酯 101±3.97 3.92 97.8±3.27 3.35三氟氯氰菊酯 90.2±2.50 2.77 87.0±2.13 2.44氯菊酯 100±3.80 3.79 80.1±2.95 3.69氟氯氰菊酯 96.8±1.43 1.47 92.0±0.248 0.272氯氰菊酯 98.6±7.60 7.71 94.2±6.93 7.36氰戊菊酯 93.6±0.704 0.751 92.2±0.799 0.871溴氰菊酯 92.7±2.34 2.52 86.1±1.90 2.21七氟菊酯100 91.1±2.20 2.42 89.0±3.06 3.43联苯菊酯 101±3.92 3.86 92.2±1.93 2.10甲氰菊酯 100±3.12 3.11 93.7±8.48 9.05三氟氯氰菊酯 89.9±2.81 3.13 101±2.13 2.12氯菊酯 98.5±3.15 3.20 88.6±3.71 4.19氟氯氰菊酯 99.0±1.20 1.21 84.1±1.78 2.12氯氰菊酯 92.1±8.25 8.97 86.3±4.54 5.26氰戊菊酯 93.6±0.62 0.662 99.4±5.91 5.94溴氰菊酯 94.6±1.64 1.73 84.8±6.18 7.29
2.3 基质效应
2.3.1 基质种类对基质效应的影响
比较同一目标物浓度(100 ng/mL)下9种菊酯类农药在草鱼、鲫鱼、鲢鱼、罗非鱼和对虾5种水产品中的基质效应,分析基质种类对基质效应的影响。
本文采用基质提取后加标法通过水产品空白基质提取液与纯溶剂中同浓度目标化合物的响应强度(峰面积)的比值来评价基质效应(ME),分析了基质种类、基质浓度和目标分析物内浓度对基质效应的影响。同一浓度(100 ng/mL)的9种拟除虫菊酯类农药在5种水产品中表现出不同的基质效应,其中七氟菊酯受基质种类的影响较小,在5种水产品中七氟菊酯基质效应在0.948~1.00之间,存在较弱的基质抑制效应,在测定水产品中七氟菊酯时可适当忽略基质效应的影响。除七氟菊酯外,其他8种菊酯类农药均表现不同程度的基质增强效应。三氟氯氰菊酯的基质效应在1.05~1.21之间,表现为较弱的基质增强效应,且基质种类对其基质效应的影响较弱。基质种类对联苯菊酯、氯菊酯、氟氯氰菊酯和氯氰菊酯的基质效应影响较大,但草鱼和鲫鱼对9种菊酯类农药的基质效应影响不明显,其基质效应在0.906~1.30之间在罗非鱼基质中氟氯氰菊酯基质效应最低为1.01,而氯菊酯基质效应则最大为1.86;对虾中氯氰菊酯基质效应达到2.45,联苯菊酯在鲢鱼中基质效应达到1.88。因此建议在检测水产品中拟除虫菊酯类农药时,应采用基质匹配标准曲线法来减弱或消除基质效应对检测结果的影响。

图1 5种水产品基质中9种拟除虫菊酯类农药(100 ng/mL)的基质效应Fig.1 Matrix effects of 9 pyrethroid pesticides (100 ng/mL) in 5 aquatic products extracts
2.3.2 农药浓度对基质效应的影响
采用提取后加标法,比较分析了同一基质中不同农药浓度(5.0、10、50、100、200、500和750 ng/mL)对基质效应的影响。结果表明,在5种不同水产品基质中,菊酯类农药浓度对基质效应有较大影响。
据文献报道,基质效应大小与基质中目标分析物浓度有一定相关性,高浓度水平基质效应低于低浓度水平[44,45]。


图2 农药浓度对基质效应的影响Fig.2 Matrix effects of 9 pesticides in different aquatic products of different pesticide concentrations
从5种基质中不同农药浓度下的基质效应(图2)可知基质效应随农药浓度的增加而减弱,即低浓度下基质增强或基质抑制效应较大,而高浓度下基质效应较小,本文结果与前人研究基本保持一致。但在鲫鱼基质中三氟氯氰,鲢鱼中氰戊菊酯和溴氰菊酯以及对虾中七氟菊酯的基质效应基本不受菊酯类农药浓度的影响,而罗非鱼和鲢鱼基质中基质效应受农药浓度的影响最为显著,低浓度下(5.0 ng/mL)在罗非鱼基质中9种菊酯类农药基质效应在2.13~3.89,鲢鱼中基质效应在1.57~2.99,而在高浓度(750 ng/mL)下罗非鱼中基质效应在 0.952~2.24,鲢鱼中基质效应在0.891~2.43。在同种基质中,当农药浓度大于 200 ng/mL时,一定浓度范围内(200~750 ng/mL)基质效应受浓度影响较小。
2.3.3 基质浓度对基质效应的影响


图3 不同基质浓度下9中菊酯类农药在5种水产品种的基质效应Fig.3 Matrix effects of 9 pyrethroid pesticides in 5 aquatic products with different matrix concentrations
比较分析了不同浓度基质对基质效应的影响。按照上述前处理方法,分别以2.0、5.0和10 g样品,提取净化后用100 ng/mL混合标准溶液定容至1 mL,获得基质浓度分别为2.0、5.0和10 g/mL,农药浓度为100 ng/mL的基质标准溶液,采用气相色谱仪检测分析。结果表明,基质浓度对基质效应影响较大,在罗非鱼中,基质效应随基质浓度增加有所增加,当基质浓度为 2.0和 5.0 g/mL时 9种菊酯基质效应在0.940±0.041~1.220±0.011,当基质浓度为10 g/mL 时,联苯菊酯和七氟菊酯表现较强的基质抑制效应,其基质效应分别为0.741±0.110和0.892±0.012,其他7种菊酯均表现为基质增强效应,其中氯氰菊酯和氯菊酯基质增强效应较强分别为1.72±0.011和1.92±0.012。在鲢鱼基质中,除七氟菊酯表现为基质抑制效应外,其他均表现不同程度的基质增强效应,联苯菊酯、氯菊酯和氟氯氰菊酯在基质低浓度(2.0 g/mL)和基质高浓度(10 g/mL)均表现为较强的基质增强效应,当基质浓度为 10 g/mL时联苯菊酯基质增强效应达到3.21±0.013。在鲫鱼和草鱼基质中,基质浓度对 9种菊酯农药的基质效应影响不大,且基质效应随基质浓度的变化较小。而在对虾基质中,联苯菊酯、氟氯氰菊酯、氯氰菊酯和溴氰菊酯受基质浓度的影响较大,氟氯氰菊酯在对虾基质浓度为2.0 g/mL时表现较强的基质抑制效应,其基质效应为0.751±0.012,在基质浓度为10 g/mL时均表现为基质增强效应。
3 结论
3.1 本文采用气相色谱法对5种水产品中9种拟除虫菊酯类农药残留量进行定量测定,样品基质经乙腈提取,PSA和中性氧化铝净化,正己烷定容后气相色谱仪测定,通过基质匹配标准曲线法消除或减弱基质效应。联苯菊酯、甲氰菊酯、三氟氯氰菊酯、氟氯氰菊酯、氯氰菊酯、氰戊菊酯和溴氰菊酯在5.0~750 ng/mL浓度范围内线性良好,相关系数在 0.9996~0.9998之间;在2.5~750 ng/mL范围内七氟菊酯线性良好,相关系数为 0.9999;而氯菊酯在浓度为 10~750 ng/mL范围内线性良好,相关系数为0.9998。联苯菊酯、甲氰菊酯、三氟氯氰菊酯、氟氯氰菊酯、氯氰菊酯、氰戊菊酯和溴氰菊酯检测限(LOD)和定量限(LOQ)分别为1.0 µg/kg和3.0 µg/kg;七氟菊酯LOD和LOQ分别为0.5 µg/kg和2.0 µg/kg;氯菊酯LOD和LOQ分别为2.0 µg/kg和5.0 µg/kg。9种拟除虫菊酯类农药在添加浓度为5.0、50和100 µg/kg三个水平下的日内平均回收率在80.7±1.72%~116±6.95%之间,日内精密度为 0.272%~10.7%;日间加标回收率为80.1±2.95%~116±2.45% , 日 间 精 密 度 为0.164%~12.8%。
该方法检出限(LOD)和定量限(LOQ)较低,日内和日间加标回收率和精密度较好,完全满足国内外水产品中菊酯类农药残留测定的要求。且该方法前处理简单、易操作、分析时间短,溶剂用量少,可满足简便、快捷、准确且环境友好的要求,灵敏度、重复性和准确性较好,可用于水产品中9种拟除虫菊酯类农药残留量的测定。
3.2 采用气相色谱法检测水产品中拟除虫菊酯类农药时,草鱼、鲫鱼、鲢鱼、罗非鱼和对虾对9种菊酯类农药均存在不同程度的基质效应,其中溴氰菊酯均存在较强的基质增强效应;七氟菊酯存在较弱的基质抑制效应,基质效应在0.948~1.00之间,在水产品中七氟菊酯检测时可忽略其基质效应对检测结果的影响。基质种类、目标分析物浓度和基质浓度对基质效应有一定影响,其中基质种类和分析物浓度对基质效应影响较大。
9种菊酯类农药在5种水产品中低浓度水平基质效应高于高浓度水平,当农药浓度大于200 ng/mL时,农药浓度在一定范围内变化(200~750 ng/mL)对各化合物在5种水产品中的基质效应没有明显影响。基质浓度对其基质效应的所影响在罗非鱼和鲢鱼中最明显,其中联苯菊酯和氯菊酯受基质浓度的影响较为突出;鲫鱼和草鱼基质浓度对其基质效应影响不大,其中七氟菊酯、三氟氯氰菊酯、氯菊酯、氯氰菊酯和溴氰菊酯基本不受基质浓度的影响。草鱼和鲫鱼中菊酯类农药残留的检测中可忽略基质浓度对其基质效应的影响。在实际检测工作中,对于基质效应较强的目标化合物,建议采用基质匹配校准曲线法进行定量分析,可有效减少或消除基质效应的干扰,确保水产品中拟除虫菊酯类农药残留检测结果的准确性。
[1]张征,李今,梁威,等.拟除虫菊酯杀虫剂对水生态系统的毒性作用[J].长江流域资源与环境,2006,15(1):125-129 ZHANG Zheng, LI Jin, LIANG Wei, et al. Toxic effects of pyrethroid pesticide on water ecosystem [J]. Resources and Environment in the Yangtze Basin, 2006, 15(1): 125-129
[2]李海屏.杀虫剂新品种开发进展及特点[J].江苏化工,2004,32(1):6-11 LI Hai-ping. Developing progresses and characteristic of novel insecticides [J]. Jiangsu Chemical Industry, 2004, 32(1):6-11
[3]刘淑娟.生物农药与生态环境保护[J].泰安师专学报,2002,24(6):74-75 LIU Shu-juan. Biological pesticide and ecological environment protection [J]. Journal of Taian Teachers College,2002, 24(6): 74-75
[4]Esteve-Turrillas F A, Pastor A, de la Guardia M. Comparison of different mass spectrometric detection techniques in the gas chromatographic analysis of pyrethroid insecticide residues in soil after microwave-assisted extraction [J].Analytical and Bioanalytical Chemistry, 2006, 384(3): 801-809
[5]葛志荣.食品中农业化学品残留限量(食品卷)[M].北京:中国标准出版社,2006 GE Zhi-rong. Maximum residue limits of agricultural chemicals in foods (Volume of Foods) [M]. Beijing:Standards Press of China, 2006
[6]中华人民共和国农业部公告.动物性食品中兽药最高残留限量[Z].2002 Notice of the ministry of agriculture of the People's Republic of China. The maximum residue limits of veterinary drugs in animal products [Z].2002
[7]Caldas E D, Coelho R, Souza L C K R, et al. Organochlorine Pesticides in Water, Sediment, and Fish of Paranoá Lake of Brasilia, Brazil [J]. Bulletin of Environmental Contamination and Toxicology, 1999, 62(2): 199-206
[8]Omwenga M, Kanja L, Nguta J, et al. Assessment of organochlorine pesticide residues in farmed fish in Machakos and Kiambu Counties, Kenya [J]. Toxicology Letters, 2016,258: S176-S177
[9]Varol M, Sünbül M R. Organochlorine pesticide, antibiotic and heavy metal residues in mussel, crayfish and fish species from a reservoir on the Euphrates River, Turkey [J].Environmental Pollution, 2017, 230: 311-319
[10]Omwenga M, Kanja L, Nguta J, et al. Assessment of organochlorine pesticide residues in farmed fish in Machakos and Kiambu Counties, Kenya [J]. Toxicology Letters, 2016,258: S176-S177
[11]ayashree R, Vasudevan N. Organochlorine pesticide residues in ground water of Thiruvallur district, India [J].Environmental Monitoring & Assessment, 2007, 128(1-3):209-215
[12]Sankararamakrishnan N, Kumar S A, Sanghi R.Organochlorine and organophosphorous pesticide residues in ground water and surface waters of Kanpur, Uttar Pradesh,India [J]. Environment International, 2005, 31(1): 113-120
[13]Zhang Y, Zhang X, Jiao B. Determination of ten pyrethroids in various fruit juices: Comparison of dispersive liquid-liquid microextraction sample preparation and QuEChERS method combined with dispersive liquid-liquid microextraction [J].Food Chemistry, 2014, 159: 367-373
[14]陈剑刚,朱克先,张亦庸,等.固相萃取-气相色谱-质谱联用测定水体中拟除虫菊酯残留[J].现代预防医学,2005,32(6):648-650 CHEN Jian-gang, ZHU Ke-xian, ZHANG Yi-yong, et al.Determination of Pyrethroid pesticide residues in water by gas chromatography-mass spectrometry with sold phase extraction [J]. Modern Preventive Medicine, 2005, 32(6):648-650
[15]Raeppel C, Appenzeller B M, Millet M. Determination of seven pyrethroids biocides and their synergist in indoor air by thermal-desorption gas chromatography/mass spectrometry after sampling on Tenax TA® passive tubes [J]. Talanta, 2015,131: 309-314
[16]杨广,刘新,鄢铮,等.4种拟除虫菊酯农药的 GC-MS和GC-MS/MS检测[J].福建农业大学学报,2003,32(4):447-452 YANG Guang, LIU Xin, YAN Zheng, et al. Dtermination of 4 pyrethroids with GC-MS and GC-MS/MS [J]. Journal of Fujian Agriculture and Forestry University, 2003, 32(4):447-452
[17]Yu X, Yang H. Pyrethroid residue determination in organic and conventional vegetables using liquid-solid extraction coupled with magnetic solid phase extraction based on polystyrene-coated magnetic nanoparticles [J]. Food Chemistry, 2017, 217: 303-310
[18]Bagheri H, Yamini Y, Safari M, et al. Simultaneous determination of pyrethroids residues in fruit and vegetable samples via supercritical fluid extraction coupled with magnetic solid phase extraction followed by HPLC-UV [J].The Journal of Supercritical Fluids, 2016, 107: 571-580
[19]罗晓燕,林玉娜,周洪伟,等.反相高效液相色谱法检测水中五种拟除虫菊酯农药残留量[J].中国卫生检验杂志,2011,6:1371-1372 LUO Xiao-yan, LIN Yu-na, ZHOU Hong-wei, et al.Determination of sorts pyrethroid pesticides residue in water by RP-HPLC [J]. Chinese Journal of Health Laboratory Technology, 2011, 6: 1371-1372
[20]Cheng J, Liu M, Yu Y, et al. Determination of pyrethroids in porcine tissues by matrix solid-phase dispersion extraction and high-performance liquid chromatography [J]. Meat Science, 2009, 82(4): 407-412
[21]骆爱兰,余向阳,张存政,等.拟除虫菊酯类农药多残留酶免疫分析方法的建立[J].中国农业科学,2005,38(2):308-312 LUO Ai-lan, YU Xiang-yang, ZHANG Cun-zheng, et al.Development of Enzyme Immunoassays for Pyrethriods [J].Scientia Agricultura Sinica, 2005, 38(2): 308-312
[22]Savant R H, Banerjee K, Utture S C, et al. Multiresidue analysis of 50 pesticides in grape, pomegranate, and mango by gas chromatography-ion trap mass spectrometry [J].Journal of Agricultural & Food Chemistry, 2010, 58(3):1447-1454
[23]Gonzálezrodríguez R M, Canchogrande B, Simalgándara J.Multiresidue determination of 11 new fungicides in grapes and wines by liquid-liquid extraction/clean-up and programmable temperature vaporization injection with analyte protectants/gas chromatography/ion trap mass spectrometry [J]. Journal of Chromatography A, 2009,1216(32): 6033-6042
[24]Matuszewski B K, Constanzer M L, Chavezeng C M. Matrix effect in quantitative LC/MS/MS analyses of biological fluids:a method for determination of finasteride in human plasma at picogram per milliliter concentrations [J]. Analytical Chemistry, 1998, 70(5): 882
[25]Yadav M, Trivedi V, Upadhyay V, et al. Comparison of extraction procedures for assessment of matrix effect for selective and reliable determination of atazanavir in human plasma by LC-ESI-MS/MS [J]. Journal of Chromatography B, 2012, 885-886(5): 138-149
[26]王鹏,蒋学华,王凌.LC-MSn应用于生物样品检测中基质效应的评价[J].中国新药杂志,2011,20:1953-1956 WANG Peng, JIANG Xue-hua, WANG Ling. Assessment of matrix effect in quantitative bioanalytical methods based on LC-MSn[J]. Chinese Journal of New Drugs, 2011, 20:1953-1956
[27]Matuszewski B K, Constanzer M L, Chavezeng C M.Strategies for the assessment of matrix effect in quantitative bioanalytical methods based on HPLC-MS/MS [J].Analytical Chemistry, 2003, 75(13): 3019-3030
[28]陈跃,朱军,于忠山,等.超高效液相色谱-串联质谱法检测唾液中3种毒品及其代谢物[J].色谱,2012,30(11):1148-1152 CHEN Yue, ZHU Jun, YU Zhong-shan, et al. determination of three drugs and their metabolites in saliva by ultra-performance piquid chromatography-tandem mass spectrometry [J]. Chinese Journal of Chromatography, 2012,30(11): 1148-1152
[29]罗俊霞,符建伟,李德瑜,等.14种有机磷农药在9种蔬菜中的基质效应研究[J].湖北农业科学,2013,23:5858-5862 LUO Jun-xia, FU Jian-wei, LI De-yu, et al. Matrix effects of 14 organophosphorus pesticides on 9 kinds of vegetables [J].Hubei Agricultural Sciences, 2013, 23: 5858-5862
[30]李淑娟,于杰,高玉生,等.HPLC-MSMS测定果蔬中有机磷类农药的基质效应[J].食品工业科技,2017,38(6):49-53 LI Shu-juan, YU Jie, GAO Yu-sheng, et al. Matrix effects of multiple organophosphorus pesticide residues in fruits and vegetables by HPLC-MS/MS [J]. Science and Technology of Food Industry, 2017, 38(6): 49-53
[31]戚向阳.果蔬中 6种杀真菌剂残留的固相分散气相色谱检测及基质效应[J].中国食品学报,2012,12(7):178-185 QI Xiang-yang. Matrix solid-phase dispersion and gas chromatographic analysis and matrix effects in determination of 6 fungicides residues in fruits and vegetables [J]. Journal of Chinese Institute of Food Science and Technology, 2012,12(7): 178-185
[32]张利强,程盛华,李琪,等.气相色谱法测定谷物中 9种有机磷农药残留量的基质效应[J].理化检验(化学分册),2016,52(2):136-140 ZHANG Li-qiang, CHENG Sheng-hua, LI Qi, et al. Matrix Effect on GC Determinnation of 9 Organophosphorus Pesticides in Grains [J]. Physical Testing and Chemical Analysis Part B: Chemical Analgsis, 2016, 52(2): 136-140
[33]de Sousa F A, Guido Costa A I, de Queiroz M E L R, et al.Evaluation of matrix effect on the GC response of eleven pesticides by PCA [J]. Food Chemistry, 2012, 135(1): 179-185
[34]Chatterjee N S, Utture S, Banerjee K, et al. Multiresidue analysis of multiclass pesticides and polyaromatic hydrocarbons in fatty fish by gas chromatography tandem mass spectrometry and evaluation of matrix effect [J]. Food Chemistry, 2016, 196: 1-8
[35]Guedes J A C, Silva R D O, Lima C G, et al. Matrix effect in guava multiresidue analysis by QuEChERS method and gas chromatography coupled to quadrupole mass spectrometry[J]. Food Chemistry, 2016,199: 380-386
[36]Kruve A, Künnapas A, Herodes K, et al. Matrix effects in pesticide multi-residue analysis by liquid chromatography-mass spectrometry [J]. Journal of Chromatography A,2008,1187(1-2): 58-66
[37]Caldas S S, Rombaldi C, de Oliveira Arias J L, et al.Multi-residue method for determination of 58 pesticides,pharmaceuticals and personal care products in water using solvent demulsification dispersive liquid-liquid microextraction combined with liquid chromatographytandem mass spectrometry [J]. Talanta, 2016, 146: 676-688
[38]Matuszewski B K, Constanzer M L, Chavez-Eng C M.Strategies for the assessment of matrix effect in quantitative bioanalytical methods based on HPLC-MS/MS [J].Analytical Chemistry, 2003, 75(13): 3019-3030
[39]王立琦,曾振灵,束建花,等.液相色谱-电喷雾串联质谱测定猪组织中β-兴奋剂残留的基质效应[J].分析化学,2012,40(9):1445-1449 WANG Li-qi, ZENG Zhen-ling, SHU Jian-hua, et al. Matrix effect in analysis of agonist residue in swine tissues with liquid chromatography-tandem mass spectrometry [J].Analytical Chemistry, 2012, 40(9): 1445-1449
[40]Garrido F A, Martinez V J, Fernandez M J, et al.Compensation for matrix effects in gas chromatographytandem mass spectrometry using a single point standard addition [J]. J Chromatogr A, 2009, 1216(23): 4798-4808
[41]Li Y, Chen X, Fan C, et al. Compensation for matrix effects in the gas chromatography-mass spectrometry analysis of 186 pesticides in tea matrices using analyte protectants [J]. J Chromatogr A, 2012, 1266: 131-142
[42]Stahnke H, Reemtsma T, Alder L. Compensation of matrix effects by postcolumn infusion of a monitor substance in multiresidue analysis with LC-MS/MS [J]. Anal. Chem.,2009, 81(6): 2185-2192
[43]Gergov M, Nenonen T, Ojanpera I, et al. Compensation of matrix effects in a standard addition method for metformin in postmortem blood using liquid chromatography- electrospray-tandem mass spectrometry [J]. J Anal. Toxicol., 2015, 39(5):359-364
[44]平新亮,林媚,王燕斌,等.添加13种有机磷农药在4种果蔬中的回收率和基质效应[J].江西植保,2009,32(3):120-122 PING Xin-liang, LIN Mei, WANG Yan-bin, et al. The recovery and matrix effect of 13 kinds of organophosphorus pesticide by added to 4 kinds of fruit and vegetables [J].Jiangxi Plant Protection, 2009, 32(3): 120-122
[45]江燕玲,成秀娟,魏燕秋,等.有机磷农药残留量检测过程中基质效应研究[J].农药科学与管理,2012,33(2):25-29 JIANG Yan-ling, CHENG Xiu-juan, WEI Yan-qiu,et al.Matrix effect of organic phosphorus pesticide residues detection in vegetables [J]. Pesticide Science and Administration, 2009, 33(2): 25-29

