凝胶渗透色谱净化-气相色谱-质谱法测定黄油中6种激素的残留
赵超敏,古淑青,郑江,邓晓军,岳振峰,赖富饶,闵甜,刘绍杰
(1.上海出入境检验检疫局动植物与食品检验检疫技术中心,上海 200135)
(2.深圳出入境检验检疫局食品检验检疫技术中心,广东深圳 518045)
(3.华南理工大学食品科学与工程学院,广东广州 510640)(4.山东省莘县农业局,山东聊城 252400)
性激素是甾体激素的主要组成部分,包括雄激素、雌激素和孕激素。这些物质具有强的蛋白质同化作用,畜牧业中常被用作促生长剂,以大幅度提高动物养殖经济效益[1~5]。基于对动物源性食品中激素残留风险分析的深入研究,长期摄入此类激素类药物会导致消费者内分泌紊乱和性早熟,提高致癌、致畸的风险等[6~8]。我国农业部明确规定,不得在动物源性食品中检出睾酮和雌二醇[9]。睾酮、脱氢表雄酮和雄酮是主要的雄激素;雌二醇是活性最强的雌激素,与雌酮互为前体和代谢物;孕激素主要以孕酮为主,三类激素在代谢过程可相互转化(图1)。
目前关于动物源性食品中残留激素的研究报道,主要基质是动物肌肉组织(如猪肉、牛肉和羊肉等)、肝脏、牛奶、鸡蛋和水产品等[10~13],对黄油中激素残留的分析报道还很少。黄油因其营养价值成为人们生活中的重要食品之一,其质量安全关乎消费者的饮食健康。
黄油是高脂肪含量样品,传统的液液提取-固相萃取柱前处理净化技术难以有效去除油脂共提物,因此,本研究采用去除油脂效果良好的凝胶渗透色谱(GPC)净化技术,其根据分析物分子量大小不同而分离(色素和油脂分子量通常>600,而激素通常<500),可有效去除黄油中油脂和色素干扰。目前,常用的激素检测方法主要有液相色谱-串联质谱法(HPLC-MS/MS)和气相色谱-质谱法(GC/MS)。虽然 GC/MS法与HPLC-MS/MS法相比需要衍生化,灵敏度稍低,但是GC/MS仍然是检测类固醇激素的强有力工具,且在确证未知类固醇激素具有其不可替代的优势[14]。因此,本文采用GPC净化技术与GC/MS相结合,同时测定黄油中6种类固醇激素,所建方法净化效果好,回收率高和重现性好,满足药物残留分析要求。

图1 6种激素的结构式Fig.1 Structure formulas of six hormones
1 材料与方法
1.1 仪器与试剂
6890N型气相色谱配5975型质谱仪(GC/MS),美国Agilent公司;全自动凝胶净化系统(GPC),德国LCtech公司;漩涡振荡器,德国Heidolph公司;往复式振荡器,日本 Yamato公司;全自动氮吹仪,美国Caliper公司;恒温干燥箱,德国Binder公司;低温离心机,美国Sigma公司;移液器,法国Gilson公司。
激素标准品:睾酮(T)、雄酮(A)、脱氢表雄酮(DHEA)、孕酮(P)、雌酮(E1)、17β-雌二醇(β-E)(纯度≥96.0%)均购自德国Dr.Ehrenstorfer公司;甲醇、环己烷、乙酸乙酯、正己烷、丙酮、叔丁基甲醚和吡啶(HPLC级),购自美国TEDIA公司;乙酸酐(AR级),购自广州化学试剂厂。
黄油样品:市售进口黄油。
空白样品:选择没有激素检出或含量超低水平的样品为空白样,用以制备验证用加标样品。
1.2 标准溶液的制备
储备液:分别准确称取各激素标准物质5 mg(精确至0.1 mg),以甲醇配制浓度为500.0 mg/L的单标溶液,所有溶液于棕色瓶中-30 ℃储存。
单标工作液:现用现配,使用前分别移取10.0 μL 500.0 mg/L的激素单标溶液于2 mL样品瓶中,40 ℃氮气吹干甲醇溶剂,残留物依次用100 μL乙酸酐和100 μL吡啶溶解,涡旋约1 min充分混合,于70 ℃恒温干燥箱衍生化50 min,取出冷却至室温,40 ℃下氮气吹至尽干,用环己烷定容至1 mL,供GC/MS用。
混合标准工作液:现用现配,使用前分别移取20.0 μL 500.0 mg/L的各激素单标溶液于2 mL样品瓶中,40 ℃氮气吹干甲醇溶剂,残留物依次用200 μL乙酸酐和200 μL吡啶溶解,涡旋约1 min充分混合,于70 ℃恒温干燥箱衍生化 50 min,取出冷却至室温,40 ℃下氮气吹至尽干,用环己烷定容至1 mL,并用环己烷逐级稀释成所需浓度,供GC/MS用。
1.3 仪器参数
1.3.1 GPC条件
GPC色谱柱:40010型(300 mm×20 mm,高24 cm,24 g Bio-Beads SX-2填料);流动相:乙酸乙酯/环己烷(1:1,V/V);流速:4.7 mL/min;定量环:5.0 mL;紫外检测波长:254 nm;柱预洗时间:0.17 min;前运行时间10.67 min;主收集时间:33 min;尾洗时间:4 min;溶剂交换周期:3次。
1.3.2 GC条件
气相色谱柱:Agilent HP-5MS(30 m×0.25 mm,0.25 μm);进样量:2 μL;进样模式:不分流;前进样口温度:280 ℃;离子源温度:230 ℃;MS四级杆温度:150 ℃;辅助通道温度:280 ℃;色谱柱流量:1 mL/min;色谱柱升温程序:80 ℃(保持 1 min)→15 ℃/min→250 ℃(保持 2 min)→2 ℃/min→272 ℃(保持3 min);溶剂延迟时间:5 min。
1.3.3 MS条件
电子轰击(EI)能量:70 eV;载气:氦气(纯度99.999%);全扫描(Scan)质量范围:50~500m/z,选择离子扫描(SIM)参数如表 1;离子驻留时间:50 ms。

表1 类固醇激素衍生物的MS采集参数Table 1 Optimized mass spectrometer parameters of steroid hormone derivatives
1.4 样品处理
称取1 g样品(精确到0.01 g)于15 mL具塞离心管中,加入5 mL乙酸乙酯/环己烷(1:1,V/V)涡旋1 min,溶解后定容至8 mL,往复振荡提取15 min,于10000 r/min下离心5 min,收集上清液至GPC样品瓶中,经GPC净化、浓缩,收集2 mL浓缩液于收集瓶中,于40 ℃下氮气吹至约0.5 mL,移入2 mL进样品中,40 ℃下氮气吹至尽干,依次用200 μL乙酸酐和200 μL吡啶溶解残留物,涡旋约1 min,于70 ℃恒温干燥箱衍生化50 min,取出冷却至室温,40 ℃下氮气吹至尽干,用200 μL环己烷定容,过0.22 μm有机滤膜,供GC/MS测定。
2 结果与讨论
2.1 提取溶剂的选择
激素是低分子量的脂溶性物质,含量与样品脂含量成正比[15]。
黄油是高脂含量样品,提取效率的关键因素是选择合适的提取试剂和提取方法。选择具有脂溶性的丙酮、正己烷、乙酸乙酯、环己烷、叔丁基甲醚为提取试剂,结果显示,虽然5种提取试剂均可以溶解黄油,但是乙酸乙酯/环己烷(1:1,V/V)溶解效果最好,溶解液为澄清溶液,同时,乙酸乙酯/环己烷也是 GPC常用流动相,因为选择乙酸乙酯/环己烷(1:1,V/V)为提取试剂。
2.2 GPC净化条件的确定
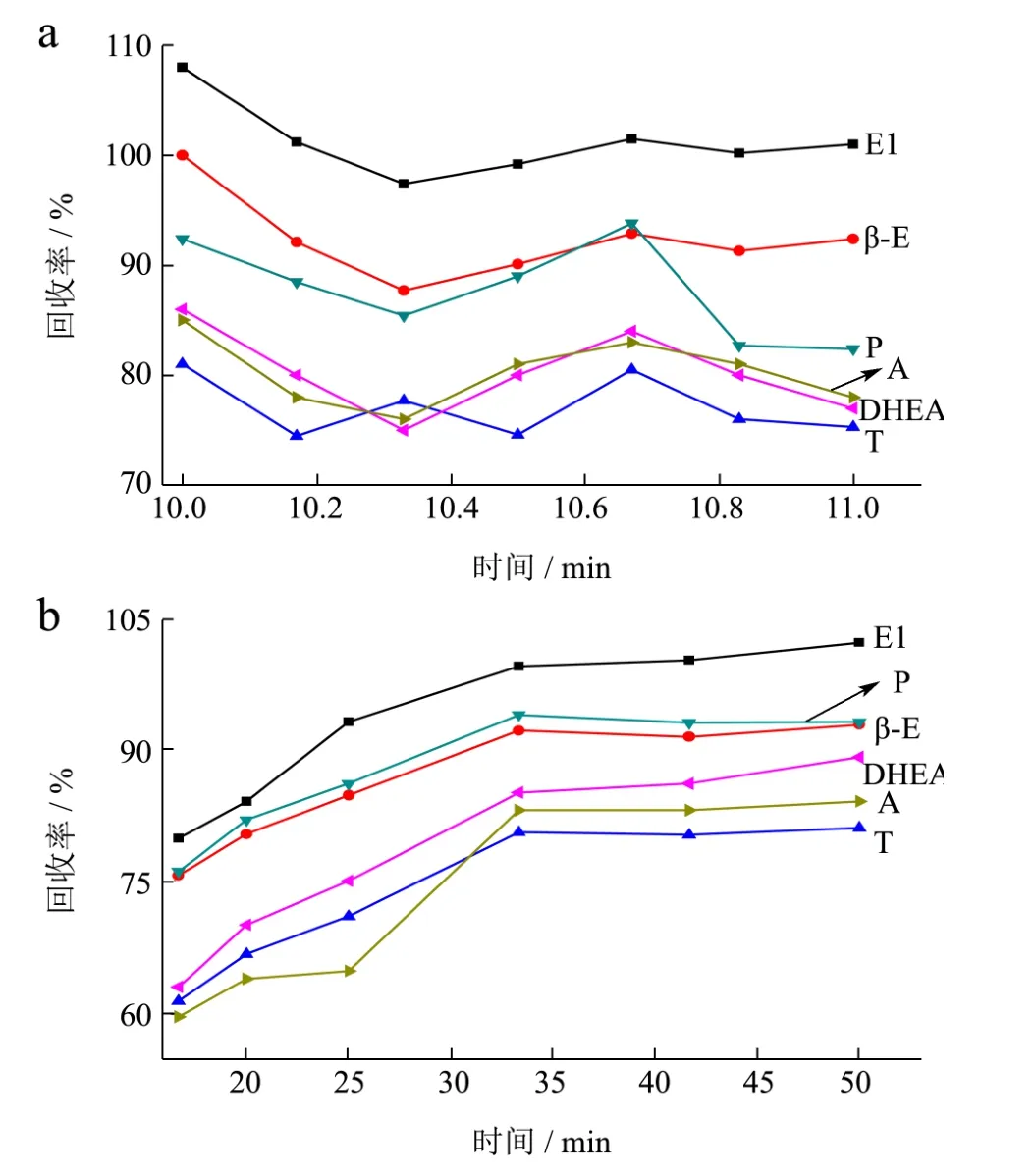
图2 GPC前运行时间(a)和主收集时间(b)对黄油中激素加标回收率的影响Fig.2 Influences of GPC-forerun time (a) and GPC-main fraction time (b) on the recovery of hormones in butter
油脂是检测黄油中激素主要的基质共提干扰物。GPC以多孔凝胶作为固定相,分离过程,色素和油脂等大分子物质不易进入凝胶颗粒孔内而分布在颗粒间,首先洗脱下来,激素等小分子物质不仅在颗粒间隙扩散,还进入凝胶颗粒微孔中,洗脱速度慢后流出,因此,净化效果好。同时,流动相乙酸乙酯和环己烷沸点一致,一定比例混合后洗脱条件稳定。
GPC净化效果的决定因素是基质共提干扰物与目标分析物切割点的选择。当流速为4.7 mL/min时,大分子物质油脂和色素在10 min时被洗脱去除。前运行时间设计为10、10.17、10.33、10.5、10.67、10.83、11 min;主收集时间设计为16.7、20、25、33、42、50 min。由图2A可知,前运行时间为10 min时加标回收率最高,但仍有部分油脂被接收,根据除脂效果和加标回收率,前运行时间为10.67 min;图2B所示随着主收集时间的延长加标回收率逐渐增大,当主收集时间延长至50 min时,加标回收率与33 min时相差不大,为减少分析时间和节约成本,选择主收集时间为33 min。优化流速(4.3、4.5、4.7 mL/min)结果显示,相近加标回收率时,增大流速,可以大大减少样品处理时间和减少试剂消耗,流速选择4.7 mL/min。
2.3 衍生条件的选择

图3 激素的衍生化公式Fig.3 Derivatization formulas of hormones
激素具有弱挥发性和热不稳定性,含有羟基和酮基等官能团,极性较大,沸点较高,直接用 GC/MS分析灵敏度较低,且峰型差,需要衍生化转化为极性较低热稳定性好的衍生化物,以提高检测灵敏度和改善色谱峰型。常用的衍生化法主要有硅烷化法和酰化法。硅烷化法主要采用三甲基硅烷衍生化技术(TMS),同时衍生激素结构中羟基和酮基而生成烯醇化-三甲基硅烷产物(如公式 1),而酰化试剂主要是酸酐类,衍生激素结构中的羟基而生成酯类物质(如公式 2)。TMS衍生物可能会堵塞气相色谱柱末端或用于反吹的毛细管,酰化衍生物对气相色谱毛细管柱影响小,因此,试验选择常用的酰化试剂乙酸酐和催化试剂吡啶作为衍生化试剂。
通过对比不同衍生化温度(50、60、70、80、90 ℃)和衍生化时间(20、30、40、50、60 min)时目标分析物的峰面积,结果显示,随着衍生化温度和衍生化时间的延长,目标分析物的峰面积增加,当70 ℃衍生化50 min时效果最好。
2.4 质谱条件的优化
为确证目标分析物的特征离子,首先采用 Scan扫描对0.5 mg/L的激素单标衍生物进行定性分析,根据目标分析物的全质谱图,选择干扰少、选择性好的离子作为特征离子进行 SIM 扫描,以相对丰度比为100的特征离子作为定量离子,另外选取2个相对丰度较高的特征离子作为定性离子,如图4所示。


图4 激素衍生物的Scan扫描(m/z 50~500)质谱图Fig.4 Mass spectrums of hormone derivatives in full-scan mode(m/z 50~500)
2.5 色谱条件的优化
激素衍生化物极性低,应选择非极性色谱柱进行分离,HP-5MS气相色谱柱是非极性的,且具有较低的柱流失,本实验选择HP-5MS为分析色谱柱。
为使目标分析物之间和基质共提干扰物之间获得良好的分离度,对气相色谱柱升温程序进行了优化,研究发现,在气相色谱检测分析过程中,气相色谱柱程序升温速度应<20 ℃/min,且柱温不能长时间在接近色谱柱最高温度时分析,程序升温太快或较高温度下检测分析,虽然大大缩短了分析时间且获得良好分离度,但是其基线波动大,稳定性差,并易产生大且无规律的干扰峰,导致检测灵敏度低和重复性差。经优化,建立的色谱柱升温程序为:初始温度为80 ℃,保持1 min,以15 ℃/min速度升至250 ℃,保持2 min,以2 ℃/min速度升至272 ℃,保持3 min。色谱柱流量选择0.8 mL/min、1.0 mL/min、1.2 mL/min,分析结果显示在1.0 mL/min时,目标分析物分离度好。同时,经优化前进样口温度为280 ℃,离子源温度为230 ℃,MS四级杆温度为150 ℃,辅助通道温度为280 ℃时,目标分析物灵敏度高、分离度好,色谱峰型窄而无拖尾(图5)。

图5 激素衍生物的SIM扫描总离子流色谱图(TIC)(浓度:0.5 mg/L,进样2 μL)Fig.5 Total ion current (TIC) chromatograms of hormone derivatives in selected ion monitoring (SIM) scan mode(concentration: 0.5 mg/L, injected volume: 2 μL)
2.6 线性范围和定量限
采用外标法定量。回归方程的获得是利用浓度范围为10~500 μg/kg的混合标准溶液,以浓度为横坐标(x,μg/kg)和定量离子对峰面积为纵坐标(y)进行线性回归计算,所得回归方程和相关系数见表 2,所得相关系数均大于0.999,线性关系良好。定量限根据信噪比S/N≥10确定,6种激素的LOQs为4~10 μg/kg。

表2 类固醇激素衍生物的线性方程、相关系数和LOQTable 2 Calibration equations, correlation coefficients and LOQ of steroid hormone derivatives
2.7 回收率与精密度
在空白样品中添加 10 μg/kg、50 μg/kg、200 μg/kg三个浓度水平进行回收试验,每个水平平行测定6次,结果见表 3,回收率为 77.2~112%,相对标准偏差为4.2~10%,方法的准确度和精密度符合国内外对激素残留分析的要求。

表3 空白样品中6种类固醇激素加标的回收率和精密度(n=6)Table 3 The recoveries and accuracies of 6 steroid hormones in spiked butter (n=6)
2.8 实际样品分析
采用所建方法对 4个市售黄油样品进行检测,4个样品均含有孕酮,其他激素未检出,范围为110~127 μg/kg,这与文献报道的黄油中孕酮含量值(132.9±5.1 μg/kg)相接近[16]。
3 结论
本文建立了黄油中雄酮、脱氢表雄酮、睾酮、孕酮、雌酮和17β-雌二醇的气相色谱-质谱(GC/MS)检测方法。所建凝胶渗透色谱前处理技术,操作简单、净化效果好,大大简化了高脂肪含量样品的前处理过程,提高了高脂肪含量样品中激素的提取效率,该方法准确可靠,满足高油脂样品中激素残留检测要求。
[1]Heinrich H D Meyer. Biochemistry and physiology of anabolic hormones used for improvement of meat production[J]. APMIS, 2001, 109(S103): S336-S344
[2]M N Sillence. Technologies for the control of fat and lean deposition in livestock [J]. The Veterinary Journal, 2004,167(3): 242-257
[3]Maarten F A Andringa, Frank J C M Van Eerdenburg, Elisa Fernández, et al. Comparison between two progesterone sources and two oestradiol formulations in a Heatsynch protocol for postpartum cycling dairy cows in pasture [J].Journal of Veterinary Science, 2013, 14(2): 161-166
[4]H F De Brabander, B Le Bizec, G Pinel, et al. Past, present and future of mass spectrometry in the analysis of residues of banned substances in meat-producing animals [J]. Journal of Mass Spectrometry, 2007, 42(8): 983-998
[5]D Courtheyn, B Le Bizec, G Brambilla, et al. Recent developments in the use and abuse of growth promoters [J].Analytica Chimica Acta, 2002, 473(1-2): 71-82
[6]W Yue, R J Santen, J P Wang, et al. Genotoxic metabolites of estradiol in breast: potential mechanism of estradiol induced carcinogenesis [J]. The Journal of Steroid Biochemistry and Molecular Biology, 2003, 86(3-5): 477-486
[7]Davaasambuu Ganmaa, Akio Sato. The possible role of female sex hormones in milk from pregnant cows in the development of breast, ovarian and corpus uteri cancers [J].Medical Hypotheses, 2005, 65(6): 1028-1037
[8]Nason F G, Nelson B E. Estrogen and progesterone in breast and gynecologic cancers. Etiology, therapeutic role, and hormone replacement [J]. Obstetrics and Gynecology Clinics of North America, 1994, 21(2): 245-270
[9]中华人民共和国农业部公告第235号. 2002 The Ministry of Agriculture Bulletin of PRC 235, 2002
[10]Lynn Vanhaecke, Julie Vanden Bussche, Klaas Wille, et al.Ultra-high performance liquid chromatography-tandem mass spectrometry in high-throughput confirmation and quantification of 34 anabolic steroids in bovine muscle [J].Analytica Chimica Acta, 2011, 700(1-2): 70-77
[11]P Marchand, Ble Bizec, C Gade, et al. Ultra trace detection of a wide range of anabolic steroids in meatby gas chromatography coupled to mass spectrometry [J]. 2000,867(1): 219-233
[12]E M Malonea, C T Elliott, D G Kennedy, et al. Rapid confirmatory method for the determination of sixteen synthetic growth promoters and bisphenol A in bovine milk using dispersive solid-phaseextraction and liquid chromatography-tandem mass spectrometry [J]. Journal of Chromatography B, 2010, 878(15-16): 1077-1084
[13]Quan-lin Wang, Ai-zhi Zhang, Xu Pan, et al. Simultaneous determination of sex hormones in egg products by ZnCl2depositing lipid, solid-phase extraction and ultra performance liquid chromatography/electrospray ionization tandem mass spectrometry [J]. Analytica Chimica Acta, 2010, 678(1):108-116
[14]Nils Krone, Beverly A Hughes, Gareth G Lavery, et al. Gas chromatography/mass spectrometry (GC/MS) remains a pre-eminent discovery tool in clinical steroid investigations even in the era of fast liquid chromatography tandem mass spectrometry (LC/MS/MS) [J]. Journal of Steroid Biochemistry and Molecular Biology, 2010, 121(3-5):496-504
[15]Sonja Hartmann, Markus Lacorn, Hans Steinhart. Natural occurrence of steroid hormones in food [J]. Food Chemistry,1998, 62(1): 7-20
[16]O J Ginther, L C Nuti, M C Garcia, et al. Factors affecting progesterone concentration in cow's milk and dairy products[J]. Journal of Animal Science, 1976, 42(1): 155-159

