中国人GRIN2B、SNCA基因多态性与帕金森病相关幻觉的关联分析
杨雅玲, 吴 钢, 胡志坚, 潘 浩, 魏慧星
幻觉既是抗帕金森病药物的一种副作用,也是疾病后期的一种表现。从病理生理上看,幻觉可能与中脑边缘系统多巴胺受体因药物治疗受到过度刺激,多巴胺/乙酰胆碱失衡及5-羟色胺能神经元变化,尾状核和壳核的谷氨酸、壳核的去甲肾上腺素代谢水平降低以及这些神经递质相互作用有关。
N-甲基-D-天冬氨酸(N-Methyl D-Aspartate,NMDA)受体亚基(GRIN1和GRIN2)表达改变可以调节谷氨酸能释放,导致黑质纹状体多巴胺能的死亡,促进PD进展[1,2]。Lee等[3]在马来西亚人群中发现GRIN2B rs7301328基因多态性与PD患者冲动控制和相关行为(Impulse Control and Related Behavior,ICRB)有关,研究表明CC基因型可能是ICRB的独立危险因素。GRIN2B位于12号染色体上,参与大脑谷氨酸介导的神经传递[4]。多项研究表明GRIN2B rs7301328在亚洲人群中突变率高[5,6],因此我们研究GRIN2B rs7301328基因多态性与PD相关幻觉是否存在关联。SNCA(Alpha-Synuclein,SNCA)广泛表达于中枢神经系统[7]。其正常功能尚未明瞭,但有证据表明它在神经传递,突触、神经可塑性和脂质代谢中发挥作用,可以帮助调节多巴胺释放。已有许多关于SNCA基因多态性与PD非运动症状的相关性研究[8],中国学者也发现SNCA rs894278与RBD相关联[9],有关该位点与PD患者幻觉症状的遗传多态性分析较为少见。
本课题研究GRIN2B rs7301328和SNCA rs894278位点突变在中国PD患者伴有幻觉和不伴幻觉者之间的分布特征,探讨这2个基因位点变异是否与PD幻觉症状的遗传易感性有关。
1 材料及方法
1.1 研究对象 100例受试者来自2014~2015 y福建医科大学附属第一医院门诊不伴痴呆且有连续就诊的患者,所有患者均符合UK脑库原发性帕金森病临床诊断标准。幻觉的诊断依据美国神经疾病与卒中协会(National Institute of Neurological Disease and Stroke,NINDS)和美国心理卫生研究协会(National Institute of Mental Health,NIMH)制定的帕金森病精神病性障碍的标准[10],为PD发生后接受多巴胺能药物治疗后出现;至少在诊断1 y后出现,幻觉症状反复发生,或持续1 m并排除其他疾病或非抗PD药物所致的幻觉。其中幻觉组53例,无幻觉组47例。本研究根据首次幻觉出现的时间长短划分幻觉早发型组和幻觉迟发型组,疾病持续时间不足5 y出现幻觉的划为幻觉早发型组;达5 y及以上才出现幻觉的划分为幻觉迟发型组,其中幻觉早发型组27例、幻觉迟发型组26例;设对照组:幻觉早发型对照组为PD发病5 y内从没出现过幻觉的PD患者,幻觉迟发型对照组为PD病程达8 y或以上从未出现过幻觉的PD患者。全部受试者均为中国汉族人群,来自于同一地域。本项研究获得福建医科大学附属第一医院伦理委员会批准。所有受试者均签署了知情同意书。
1.2 基因检测
1.2.1 GRIN2B多态分型检测 用TIANamp Blood DNA Kit抽提全血DNA。引物序列:F:TTCTCCCTGCAGCCCCTTTTTA和R:CGACCCAAAGAGCATCATCACC。PCR反应体系(10 μl):包含1x HotStarTaq buffer,3.0 mM Mg2+,0.3 mM dNTP,1 U HotStarTaq polymerase,1 μl样本DNA和1 μl多重PCR引物。PCR循环程序:95 ℃预变性2 min;94 ℃变性20 s,65 ℃退火40 s,72 ℃延伸1.5 min,11个循环;94 ℃变性20 s,59℃退火30 s,72 ℃延伸1.5 min,24个循环;72 ℃最后延伸2 min,4 ℃保存。将得到的PCR产物纯化后用SNaPshot进行多重单碱基延伸反应。延伸引物序列:SF:TTTTTTTTTTTTTTTTTTTTTTTTTTTTTTTTTTTTTTTTTTTTTCCCCGTGGATGCCCAGGAT。将延伸产物纯化后上ABI3730XL测序仪测序。编码样本进行基因分型确保对病例组和对照组未知。
1.2.2 SNCA多态分型检测 引物序列:F:CTGGGTGAAATATGGCGGACAG和R:GGCCAATTCCCTATGCCAGAA C。延伸引物:SF:TTTTTTTTTTTTTTTTTTTTTTTTTTTTTTTTTTTTTTTTGCAGATAAACCATCCCACTT。后续步骤同GRIN2B多态分型检测(见图1、图2)。
1.3 数据处理 采用SPSS 22.0软件包进行统计分析,设定P<0.05为差异具有统计学意义。本实验利用SNaPshot SNP分型技术对100个样本进行10个SNP位点分型。设4个分析模型,Condominant共显性、Dominant显性、Recessive隐性、Allele等位基因对每个位点进行卡方分析。Logistic regression以单个位点为单位,按3个假设模型,Dominan (频率低的等位基因为显性),Recessive(频率低的等位基因为隐性),Log-additive (叠加作用)进行关联分析。
2 结 果
2.1 临床基线资料的比较 幻觉组临床资料分析:幻觉组53例为46~86岁的PD患者,平均(68.55±8.77)岁,无幻觉组47例,33~76岁,平均(59.77±8.20)岁,幻觉组的年龄和起病年龄均较无幻觉组大(P<0.001;P<0.001);总体比较,PD患者幻觉有男性优势,但两组之间无显著性差异(P=0.087)。幻觉组日常生活能力和运动能力均较无幻觉组差,差异有显著性(P=0.013;P=0.028)。幻觉者伴慢性便秘较多(P<0.001),而较少出现异动症(P=0.003)(见表1)。
幻觉早发型组临床资料分析:幻觉早发型组27例,46~79岁,平均(66.78±8.28)岁,其对照组73例,33~86岁,平均(63.55±9.88)岁,两组的年龄无明显差异(t=1.513,P=0.134)。幻觉早发型组的起病年龄较对照组大(P=0.001);且疾病持续时间和治疗持续时间均少于对照组(P<0.001;P<0.001)。幻觉早发型组伴便秘者较多(P=0.018),且较少出现异动症(P=0.006)(见表1) 。
幻觉迟发型组的临床资料分析:幻觉迟发型组26例,53~86岁,平均(70.38±9.05)岁,其对照组19例,45~75岁,平均(59.21±7.52)岁,两组比较年龄差异有统计学意义(t=4.385,P<0.001)。幻觉迟发型组的起病年龄也大于对照组(P<0.001)。与对照组相比,幻觉迟发型组男性患者居多(P=0.018)。此外,幻觉迟发型组日常生活能力和睡眠状况均较对照组差(P=0.001;P=0.036),且较少出现异动症(P<0.001)(见表1)。
2.2 基因多态性 GRIN2B rs7301328和SNCA rs894278的基因型及等位基因频率在幻觉组、幻觉早发型组、幻觉迟发型组与各自的对照组之间均无显著差异(见表2、表3)。GRIN2B和SNCA 的基因频率在三组中的分布符合Hardy-Weinberg平衡(P>0.05)(除了SNCA 在幻觉迟发型组及其对照组中考虑受样本量影响出现偏差,P=0.003),提示研究对象来自大的群体,受自然选择等因素影响小,资料可靠。
2.3 关联分析
2.3.1 幻觉组与无幻觉组(见表4) 在Logistic regression校正幻觉组与无幻觉组之间具有显著差异的年龄、起病年龄、UPDRS-Ⅱ和UPDRS-Ⅲ这些对幻觉症状产生有影响的因素后,在隐性模型和叠加模型下,GRIN2B rs7301328的GG基因型是PD相关幻觉的保护因素(OR’=0.246,95%CI[0.071~0.848],P’=0.026);OR’=0.432,95%CI[0.208~0.895],P’=0.024),而在显性模型下未发现显著关联性(P’=0.132)。SNCA rs897278在三种遗传模型下校正后与PD相关幻觉风险无显著关联(P’=0.250;P’=0.078;P’=0.074)。
2.3.2 幻觉早发型组与幻觉早发型对照组(见表5) 在Logistic regression校正幻觉早发型组及其对照组之间具有显著差异的起病年龄、病程及治疗持续时间,在隐性模型下,SNCA rs894278 的GG基因型是PD幻觉早发型发生幻觉的危险因素(OR’=8.281,95%CI[1.217~56.334],P’=0.031),而在显性模型及叠加模型下未发现显著关联(P’=0.998,P’=0.253)。GRIN2B rs7301328在三种遗传模型下校正后与PD幻觉早发型的幻觉风险无显著关联(P’=0.637;P’=0.901;P’=0.817)。
2.3.3 幻觉迟发型组与幻觉迟发型对照组(见表6) 在Logistic regression校正幻觉迟发型组及其对照组之间具有显著差异的年龄、性别、起病年龄及UPDRS-Ⅱ后,在3种遗传模型下均没有发现相关的基因多态性增加幻觉的风险(GRIN2B rs7301328:P’=0.724,P’=0.095,P’=0.213;SNCA rs894278:P’=0.994,P’=0.129,P’=0.212)。
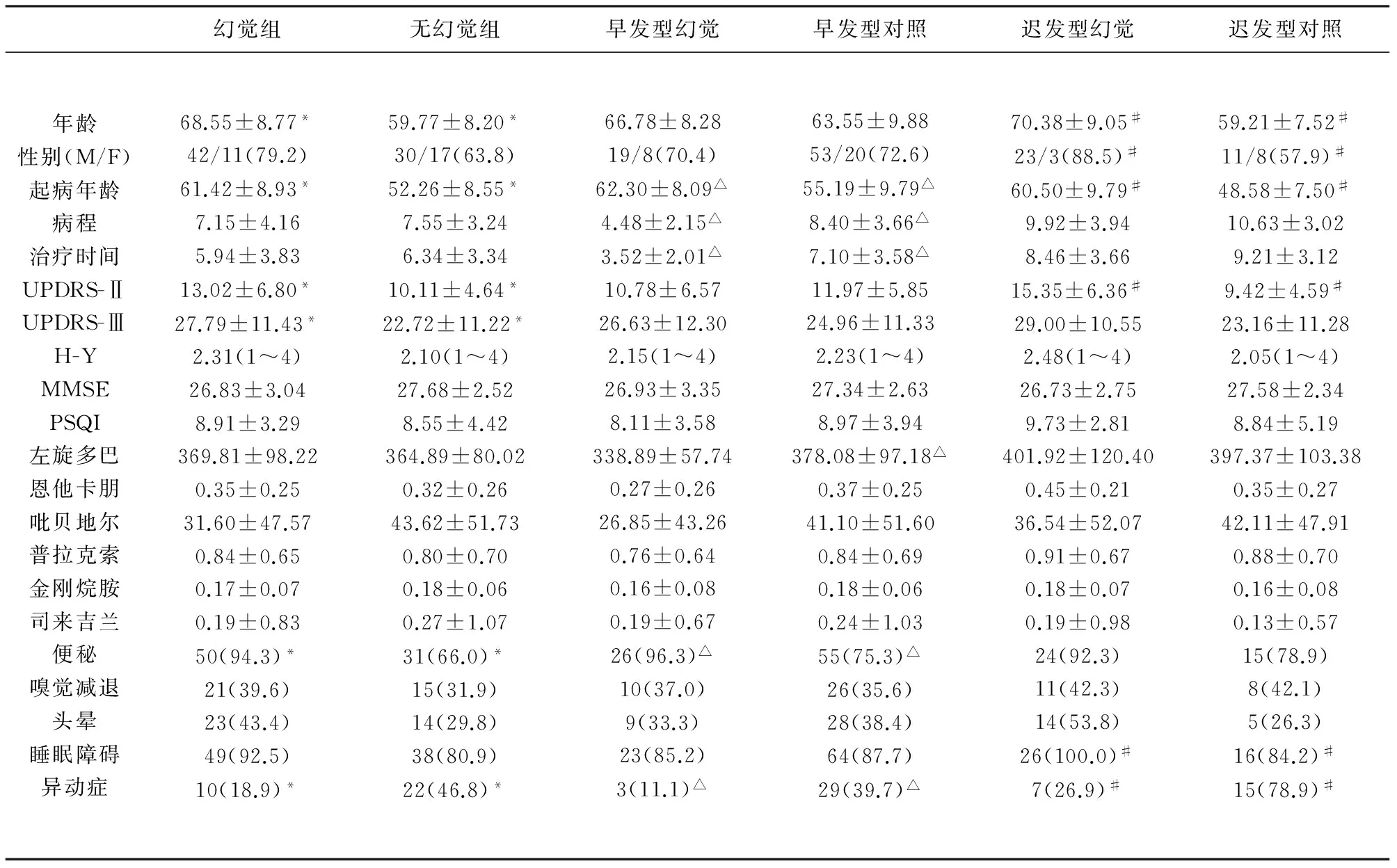
表1 PD患者幻觉组与无幻觉组、幻觉早发型及其对照组、幻觉迟发型及其对照组的临床参数比较
注:定量资料用t/t’检验;分类资料用χ2检验/Fisher确切概率法检验。各个因素所对应的统计值右上方标有*,表示幻觉组和无幻觉组之间差异具有统计学意义;标有△,表示幻觉早发型组及其对照组之间差异具有统计学意义;标有#,表示幻觉迟发型组及其对照组之间差异具有统计学意义。采用双侧检验,检验水准α=0.05,P<0.05有统计学意义
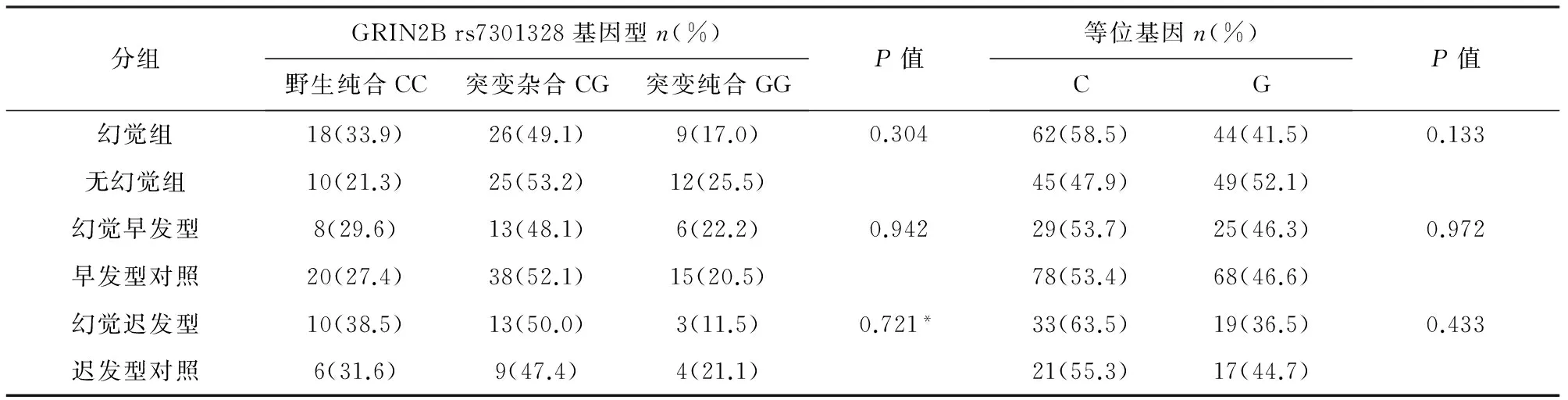
表2 幻觉组、幻觉早发型和幻觉迟发型组与各自对照组GRIN2B 基因多态性分布
注:右上方标有*号表示用Fisher确切概率法检验
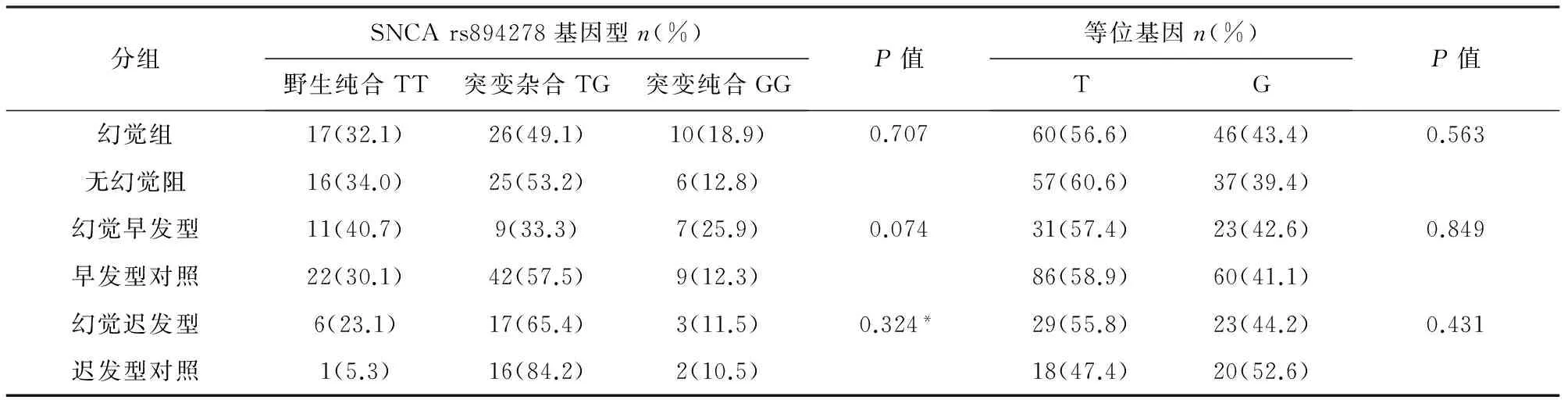
表3 幻觉组、幻觉早发型和幻觉迟发型组与各自对照组的SNCA 基因多态性分布
注:右上方标有*号表示用Fisher确切概率法检验
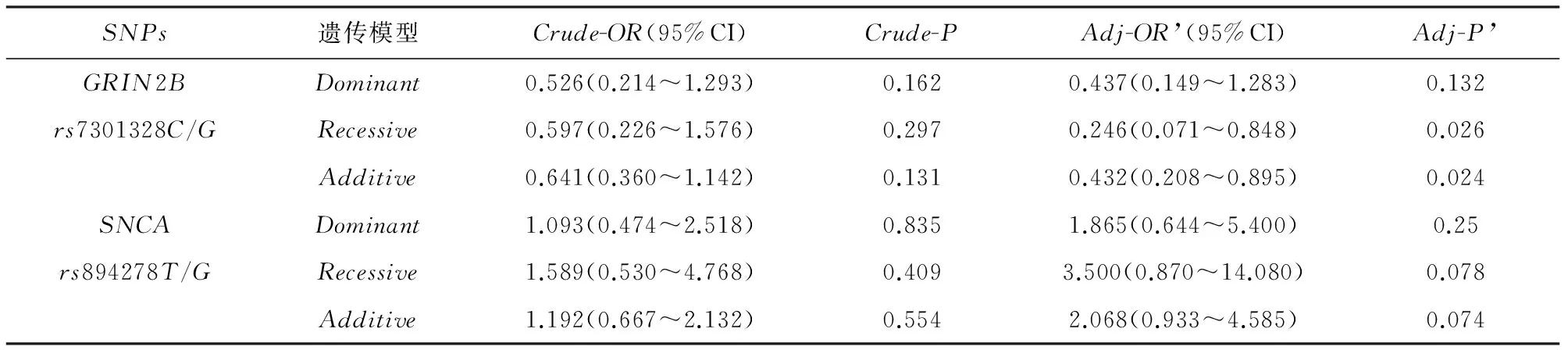
表4 幻觉组与无幻觉组PD患者的基因型多态性
注:Dominan:(突变纯合+突变杂合)VS野生纯合;Recessive:突变纯合VS(突变杂合+野生纯合);Additive:突变纯合VS野生纯合;CrudeOR(95%CI)和P值为用原始Logisticregression分析基因型与幻觉关联的统计值和95%可信区间;Adj-OR’(95%CI)和Adj-P’值为校正年龄、起病年龄、UPDRS-Ⅱ和UPDRS-Ⅲ后的统计参数和95%可信区间
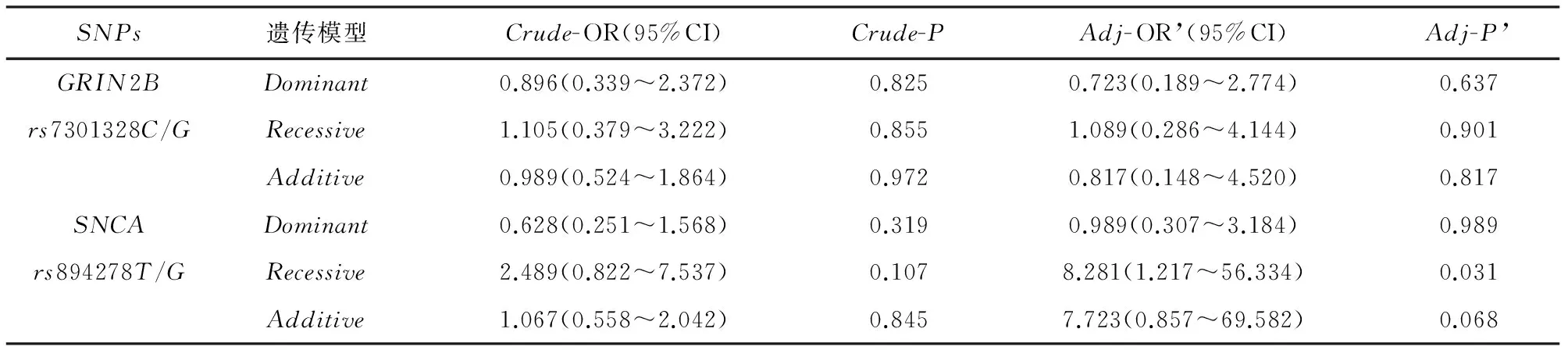
表5 早发幻觉组与早发幻觉对照组PD患者的基因型多态性
注:Dominan:(突变纯合+突变杂合)VS野生纯合;Recessive:突变纯合VS(突变杂合+野生纯合);Additive:突变纯合VS野生纯合;CrudeOR(95%CI)和P值为用原始Logisticregression分析基因型与幻觉关联的统计值和95%可信区间;Adj- OR’(95%CI)和Adj-P’为校正起病年龄、病程、治疗持续时间后的统计参数和95%可信区间
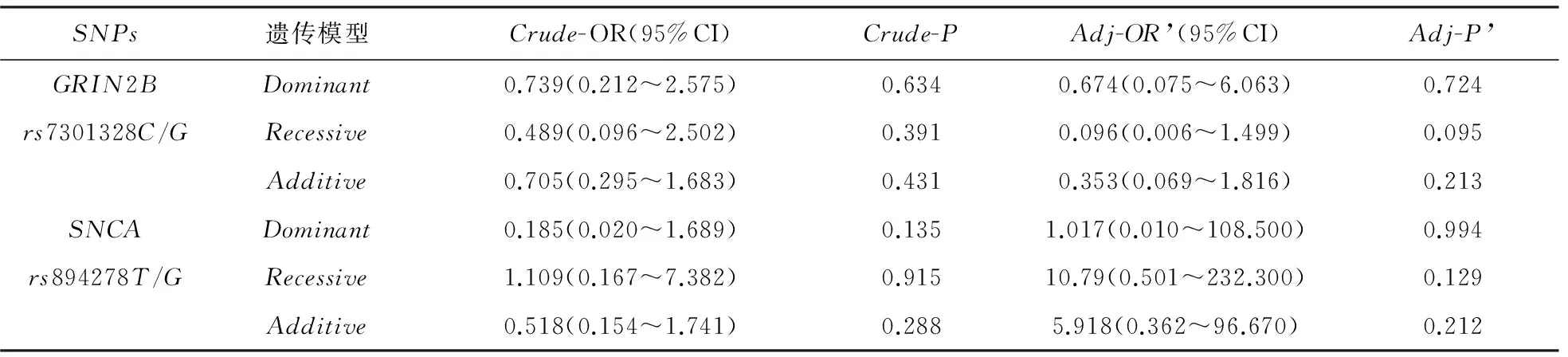
表6 迟发幻觉组与迟发幻觉对照组PD患者的基因型多态性
注:Dominan:(突变纯合+突变杂合)VS野生纯合;Recessive:突变纯合VS(突变杂合+野生纯合);Additive:突变纯合VS野生纯合;CrudeOR(95%CI)和P值为用原始Logisticregression分析基因型与幻觉关联的统计值和95%可信区间;Adj- OR’(95%CI)和Adj-P’为校正年龄、性别、起病年龄、UPDRS-Ⅱ后的统计参数和95%可信区间
图1 GRIN2B rs7301328位点检测图

图2 SNCA rs894278位点检测图
3 讨 论
有将近1/3长期接受多巴胺能治疗的PD患者会出现幻觉症状,以视幻觉多见,有报道PD患者视幻觉占全部幻觉类型的90%以上[11,12]。在PD诊治的临床实践中我们常常会发现有些患者由于出现精神异常,即使调整各种药物也很难避免,从而导致治疗失败,这些患者在遗传基因上具有什么特质这是我们开展本课题研究的思考背景。
随着PD持续时间的进展,许多PD患者最终也会出现幻觉症状。不能排除入选PD非幻觉者的成员随着疾病进展出现幻觉的可能,为此,我们将不伴幻觉的PD对照组中病程少于5y的排除(至2015年),以免降低检验效能。此外,我们还根据幻觉始发时的病程将幻觉组分为幻觉早发型组和幻觉迟发型组两个亚组以便进行进一步研究。
综合三组临床基线资料比较分析(见表1),年龄大和起病年龄大者易出现幻觉,幻觉症状受日常生活能力和运动能力的影响,而幻觉迟发症状还受睡眠状况影响。幻觉者伴慢性便秘和伴高血压者较多,而较少出现异动症,考虑差异是因为年龄亦是慢性便秘和高血压的危险因素,而异动症多见于年轻起病的PD患者[13]。因此,PD患者的幻觉症状除了与年龄、病程、抗PD药物剂量这些常常描述PD特征的因素有关,还受到起病年龄、日常生活能力、运动能力及睡眠质量的影响。
在本研究中,我们发现GRIN2Brs7301328的等位基因及基因型频率在3个对照组之间均无显著差异(见表2)。然而在调整混杂因素后我们发现GG基因型是PD相关幻觉的保护因素(见表4)。我们的研究首次报道了GRIN2Brs7301328多态性与PD患者幻觉风险相关,我们推测可能是由于CC基因型导致SNP中其他功能性变异以致连锁失衡。此外,NMDA受体亚基GRIN2B还被发现与酒精依赖(rs1806201)[14]、精神分裂症和双相情感障碍(rs1019385)[15]有关,表明谷氨酸信号通路参与调节情感性精神障碍[16,17]。然而在这些研究中发现GRIN2B基因突变增加精神疾病风险。从病理生理上看,双相情感障碍和精神症状可能与中枢兴奋性神经递质水平的改变和NMDAR在患者的表达、分布以及功能减少有关[18,19]。因此,参与NMDA受体通路的基因可能影响情感障碍和精神症状。
SNCArs894278在三个对照组间的等位基因及基因型频率也均无显著差异(见表3)。然而在调整混杂因素后我们发现SNCArs894278位点增加PD患者早发幻觉风险(见表5)。1997年时研究发现SNCA基因突变引起帕金森病[20,21]。大多数研究表明SNCA突变常见于幻觉早发型帕金森病,且患者多表现为各种非运动症状,如自主神经功能异常、RBD(快速眼动睡眠行为障碍)、幻觉(视幻觉多见)和认知功能障碍。只有少数病例表现为PD的典型表现,以致误诊为多系统萎缩[22]。我们的发现对于协助诊断以非运动症状中幻觉早期出现的幻觉早发型帕金森病有益。当然,我们需要更多良好匹配的大样本来准确判断基因型与表型的相关性。
结论:在中国人不伴痴呆帕金森病人群中,GRIN2Brs7301328的GG基因型可能是PD相关幻觉的保护因素。而SNCArs894278的GG基因型可能是幻觉早发型PD患者发生幻觉的危险因素。
[参考文献]
[1]MandelS,GrunblattE,MaorG,etal.EarlyandlategenechangesinMPTPmicemodelofParkinson’sdiseaseemployingcDNAmicroarray[J].NeurochemicalResearch,2002,27:1231-1243.
[2]MartiM,MelaF,BianchiC,etal.Striataldopamine-NMDAreceptorinteractionsinthemodulationofglutamatereleaseinthesubstantianigraparsreticulatainvivo:oppositeroleforD1andD2receptors[J].Neurochemical,2002,83:635-644.
[3]LeeJY,LeeEK,ParkSS,etal.AssociationofDRD3andGRIN2BwithimpulsecontrolandrelatedbehaviorsinParkinson’sdisease[J].MoventDisorder,2009,24:1803- 1810.
[4]HessS,DaggettL,CronaJ,etal.CloningandfunctionalcharacterizationsofhumanheteromericN-methyl-D-aspartatereceptor[J].PharmacologyandExperimentalTherapeutics,1996,278:808-816.
[5]LiouYJ,WangYC,ChenJY,etal.AssociationanalysisofpolymorphismsintheN- -methyl-D-aspartate(NMDA)receptorsubunit2B(GRIN2B)geneandtardivedyskine-siainschizophrenia[J].PsychiatryResearch,2007,153:271-275.
[6]OhtsukiT,SakuraiK,DouH,etal.MutationanalysisoftheNMDAR2B(GRIN2B)geneinschizophrenia[J].MolecularPsychiatry,2001,6:211-216.
[7]SolanoSM,MillerDW,AugoodSJ,etal.Expressionofalpha-synuclein,parkinandubiquitincarboxy-terminalhydrolaseL1mRNAinhumanbrain:genesassociatedwithfamilialParkinson’sdisease[J].AnnalsofNeurology,2000,47(2):201-210.
[8]ChaudhuriKR,TolosaEduardo,SchapiraHV.Non-MotorSymptomsofParkinson’sDisease[J].LancetNeurology,2006,5(3):235-245.
[9]吴国平,万大勇,康文岩,等.α-突触核蛋白基因多态性与帕金森病非运动症状的关联 [J]. 中华神经科杂志,2015,48(10):870-875.
[10]RavinaB,MarderK,FernandezHH,etal.DiagnosticcriteriaforpsychosisinParkinson’sdisease:reportofanNINDS,NIMHworkshop[J].MovDisord,2007,22:1062-1068.
[11]CummingsJL.NeuropsychiatriccomplicationsofdrugtreatmentofParkinson'sdisease,inParkinson’sDisease:NeurobehavioralAspects[M].NewYork:OxfordUniversitypress,USA,1992. 313-327.
[12]RamosS,OrtollJR,PaulsonGW.VisualhallucinationsassociatedwithParkinson’sdisease[J].ArchivesofNeurology,1996,53:1265-1268.
[13]MiocinovicS,SomayajulaS,ChitnisS,etal.History,applicationa,andmechanismsofdeepbrainstimulation[J].JAMANeurol,2013,70(2):29-34.
[14]KimJH,ParkM,YangSY,etal.AssociationstudyofpolymorphismsinN-methyl-D-aspartatereceptor2Bsubunits(GRIN2B)genewithKoreanalcoholism[J].NeuroscienceResearch,2006,56:220-223.
[15]LiD,HeL.AssociationstudybetweentheNMDAreceptor2Bsubunitgeneandschizophrenia:AHugereviewandmeta-analysis[J].GeneteticMedcine,2007,9:4-8.
[16]MundoE,TharmalinghamS,NevesPereiraM,etal.EvidencethattheN-methyl-D-aspartatesubunit1receptorgene(GRIN1)conferssusceptibilitytobipolardisorder[J].MolecularPsychiatry,2003,8(2):241-245.
[17]FallinMD,LasseterVK,AvramopoulosD,etal.Bipolardisorderandschizophrenia:a440-singlenucleotidepolymorphismscreenof64candidategenesamongAshkenaziJewishcase-parenttrios[J].AmericanJournalHumanGenetic,2005,77:918-936.
[18]CoyleJT.Theglutamatergicdysfunctionhypothesisforschizophrenia[J].HarvardReviewofPsychiatry,1996,3(5):241-253.
[19]JavittDC,ZukinSR.Recentadvancesinthephencyclidinemodelofschizophrenia[J].TheAmericanJournalofPsychiatry,1991,148(10):1301-1308.
[20]SingletonAB,FarrerM,JohnsonJ,etal.Alpha-SynucleinlocustriplicationcausesParkinson’sdisease[J].Science,2003,302(5646):841.
[21]DudaJE,GiassonBI,MabonME,etal.ConcurrenceofalphasynucleinandtaubrainpathologyintheContursikindred[J].ActaNeuropathologica,2002,104(1):7-11.
[22]KonnoT,RossOA,PuschmannA,etal.AutosomaldominantParkinson’sdiseasecausedbySNCAduplications[J].ParkinsonismRelatateDisorder,2016,22:S1-S6.

