白及蔗糖合酶基因结构与功能的生物信息学分析
罗才林 ,徐德林,钱 刚,潘胤池,陈红波,谢 欣,上官燕妮,李 林
(遵义医学院 医学细胞生物学教研室,贵州 遵义 563099)
白及[Bletillastriata(Thunb.) Reichb . f.]是兰科白及属草本单子叶植物,又名甘根、白根、良姜、紫兰等,主要分布于我国贵州、四川、云南、湖南、安徽等省份。白及是我国重要中药材之一,主要功效有收敛止血、消肿生肌[1]等作用。由于白及含胶状成分,具有较好的止血作用,可显著缩短凝血时间[2],可以治疗咯血、吐血、外伤出血、疮疡肿毒、皮肤皲裂等症状[3],具有可观的药用价值和应用前景。现代药理学研究表明白及中含有丰富的联苯类、菲类、二氢菲类等,其具有抗肿瘤、抗菌、抗炎镇痛、促进伤口愈合等作用[4-6],这些化学成分被认为可能是白及发挥抗肿瘤、抗炎和抗菌活性的物质基础[7]。
蔗糖合酶(sucrose synthase)是植物的光合作用产物蔗糖进入各种代谢途径所必需的关键酶之一,蔗糖合酶的独特之处在于它可以催化蔗糖代谢的可逆反应,更重要的是,蔗糖合酶催化蔗糖的合成和分解时几乎不消耗能量的方式,在不需要其他酶的参与下,允许蔗糖从“库”快速转化为“源”[8]。这些特点使蔗糖合酶在植物的生长发育过程中发挥了重要的作用。已有研究表明蔗糖合酶参与淀粉合成[9]、纤维细胞分化[10]、细胞壁合成[11]和抗逆性[12]等生命活动,还能为机体提供核苷单糖供体,可使蔗糖合酶基因作为一个催化成分而影响核苷单糖的生物合成过程,具有广泛的应用前景。
目前已在花生[13]、甜高粱[14]、甜瓜[15]和铁皮石斛[16]等多种高等植物中分离得到了蔗糖合酶基因,但有关白及蔗糖合酶基因结构与功能的研究还未见报道。本研究通过从构建的白及转录组数据库中挑取出蔗糖合酶基因序列,运用生物信息学软件,分析该基因序列的结构、预测编码蛋白的理化性质及功能结构域特点,为在分子水平上分析高等植物的蔗糖合酶的保守结构域研究提供基础资料,对揭示蔗糖合酶在白及中的生物学功能以及了解其在整个糖代谢具有重要意义,也为深入分析其它物种蔗糖合酶的结构与功能关系提供参考。
1 材料与方法
1.1 材料 本研究所用的白及为本课题组采集自获得“国家地理保护标志产品”的“白及之乡”贵州省正安县的地方大规模种植品系“正安白及”,收获田间自由散粉所结的蒴果,在实验室组培出幼苗后移栽至室外。
1.2 白及转录组数据库的构建 提取白及不同生育阶段根、茎、叶、花、蒴果的总RNA进行质和量的测定后进行5G数据量的mRNA转录组测序。Trinity Method对测序结果进行denovo组装,进一步将unigene序列进行信息学注解,从中挑选出被初步注解为蔗糖合酶的序列,电子克隆后进行后续分析。
1.3 序列的生物信息学分析 根据测序结果,运用NCBI的BLAST在线分析软件进行白及蔗糖合酶核苷酸序列比对分析,并利用ORF finder分析蔗糖合酶核苷酸序列的开放阅读框;采用Expasy Prot Param分析白及蔗糖合酶的分子量、等电点和氨基酸组成;使用在线工具SOPMA 分析白及蔗糖合酶基因的二级结构,并用软件SWISS MODEL进行序列结构的三维建模;在线软件EBI分析其蛋白质保守结构域,运用DNAMAN(6.0)对多物种氨基酸序列比对;使用MEGA6.0软件的邻接法(Neighbor-joining)构建多物种的蔗糖合酶氨基酸序列的系统发生树;应用在线工具Psort对亚细胞进行定位分析,在线工具Profun进行功能分类预测。
2 结果
2.1 蔗糖合酶序列与氨基酸理化性质特征分析 从白及转录组数据库中挑选出初步注解为蔗糖合酶的unigene,将其与NCBI数据库中的已知核酸序列比对,发现与不同物种中的蔗糖合酶序列高度相似。该序列全长为2 957 bp,ORF finder(http://www.ncbi.nlm.nih.gov/gorf/ orfig.cgi)查找开放阅读框(ORF)发现,该序列包含一个完整的开放阅读框,全长2 451 bp,共编码816个氨基酸残基。Expasy Prot param (http://web.expasy.org/prot-param)软件预测显示白及蔗糖合酶由20种氨基酸组成,其中Leu和Ser含量最高,分别为11.2%和8.3%,不含Pyl和Sec。该蛋白分子量为93.09 kDa,理论等电点(pI)为5.97,原子组成为C4211H6532N1128O1212S23,负电荷残基(Asp + Glu)109个,正电荷残基(Arg + Lys)90个,不稳定系数为31.51,表明该蛋白质结构稳定。将该基因序列提交NCBI数据库(GI:ANW09660.1)。
2.2 二级结构预测分析 对白及蔗糖合酶的二级结构用SOPMA (https://npsa-prabi.ibcp.fr/ cgi-bin/ npsa_automat.pl? page=npsa_sopma.html)进行预测,分析表明主要的结构元件是α-螺旋和无规则卷曲,符合SuSy蛋白的典型特征(见图1)。分布比例上看,该基因816个氨基酸残基中,396个氨基酸残基(占48.53%)为α-螺旋结构( Alpha helix),129个氨基酸残基(15.81%)为线状结( Extended strand),201个氨基酸残基(24.63%)为无规则卷曲结构(Random coil),90个氨基酸残(11.03%)为β-转角(Beta turn)。从分布位点上来看,C端和N端富含α-螺旋,而无规则卷曲、延伸链和β-转角则散布于整个蛋白质中。
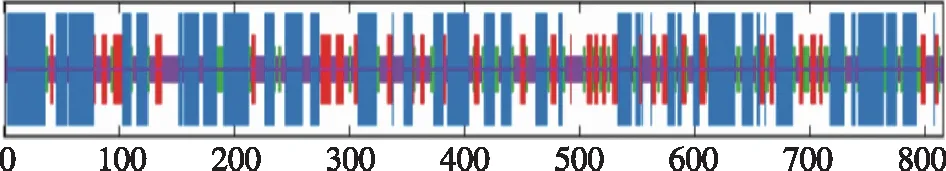
蓝色代表α-螺旋; 红色代表延伸链; 绿色代表β-转角; 紫色代表不规则卷曲。图1 白及蔗糖合酶二级结构预测
2.3 结构域与三维结构预测分析 利用在线工具EBI(http://www.ebi.ac.uk/interpro/)分析氨基酸序列的结构域发现,白及蔗糖合酶包括蔗糖合酶功能域(N端)和糖基转移功能域(C端)。蔗糖合成相关的功能区域(sucrose_synth)在第9个氨基酸到第555个氨基酸,糖基转移功能域(glycos transf 1)在第561个氨基酸到第741个氨基酸是与转运相关的区域(见图3)。在Swiss-Model显示,白及SuSy蛋白序列与拟南芥的SuSy蛋白同源性为74.75%。以拟南芥的结构为模板,构建白及SuSy蛋白的三维结构,结果见图2。
2.4 氨基酸序列同源性分析 以白及(GI:ANW09660.1)及其近缘属植物的铁皮石斛(GI:ALS55906.1)、双子叶的模式植物甜菜(GI:AAK65960.1)氨基酸序列进行Alignment多重比对(见图3)。比对发现,白及蔗糖合酶与铁皮石斛蔗
糖合酶的氨基酸序列表现出高度同源性,达91.54%,从全序列差异位点来看,主要的差异位点在N端,铁皮石斛有约40个氨基酸残基的缺失,在氨基酸序列长度上短于其他两种材料。另外,白及蔗糖合酶与甜菜的氨基酸序列相比,同源性为69.45%,他们在N端、C端的保守性较差,而在其他区域具有较高的相似度。三种材料的蔗糖合酶氨基酸序列相比,中部仍然存在大量完全一致的区段,这说明蔗糖合酶基因在亲缘关系较近的植物中的氨基酸序列表现出较高的保守性。
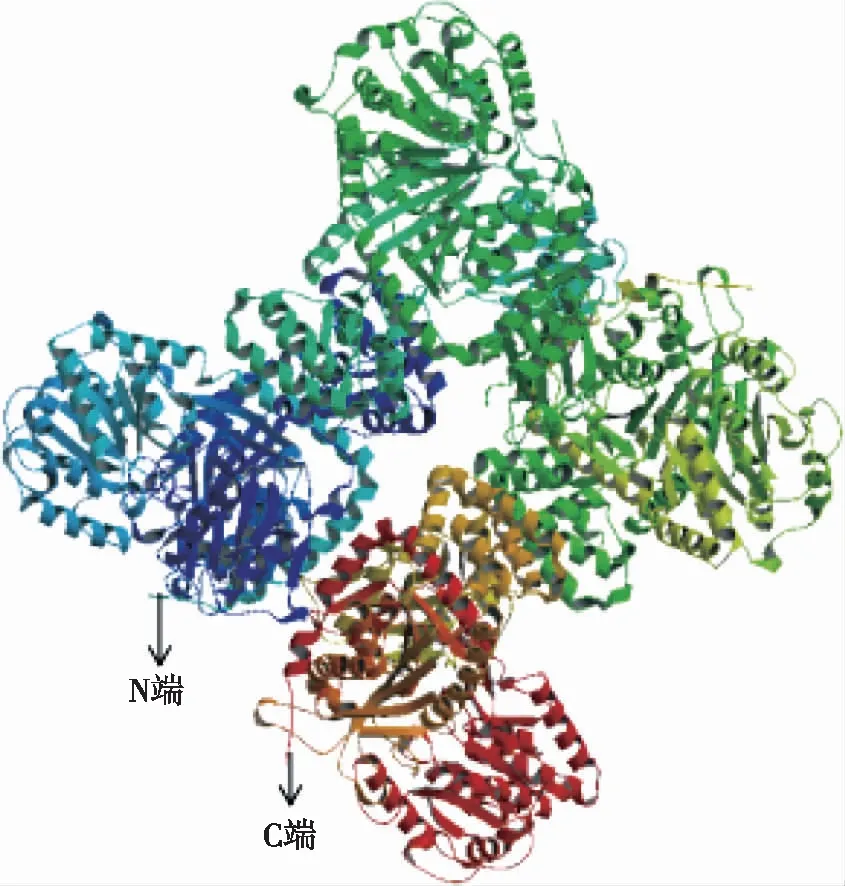
图2 白及蔗糖合酶的三维结构预测

黑色背景表示同源性为100%,蓝色背景表示同源性为66.7%,“·”表示氨基酸缺失ANW09660.1 :紫花白及;ALS55906.1:铁皮石斛;AAK65960.1:甜菜。图3 白及蔗糖合酶和铁皮石斛及甜菜氨基酸序列同源性比对
2.5 亚细胞定位及功能预测 采用Psort(http://psort.nibb.acform)在线软件对白及蔗糖合酶的表达部位进行预测,结果为:定位于细胞质中的概率为47.8%,细胞核中的概率为26.1%,线粒体中的概率为26.1%,表明该酶主要存在细胞质中。采用ProtFun (http://www.cbs. dtuices/ProtFun/)对白及蔗糖合酶的功能预测,则表明该蛋白具有信号转导(40.2%)、转录(39.3%)、生长因子(38.1%)功能的概率较高(见表1)。
2.6 白及蔗糖合酶系统进化分析 选取16种单子叶植物和双子叶植物的蔗糖合酶氨基酸序列构建进化树,比较分析不同物种中该基因的进化与亲缘关系。从构建的进化树中可见,16条氨基酸序列分为单子叶植物组、双子叶植物组2个分支,如图4所示。白及蔗糖合酶归于单子叶植物组,与铁皮石斛、金蝶兰、绿竹在一个大分支下,这说明该基因在进化上与这三者的亲缘关系较近,尤其是与铁皮石斛的进化上具有最高的亲缘关系。氨基酸序列保守结构域分析表明各序列均有相同的motif数目,在序列上的位置稍有不同。
表1蔗糖合酶功能预测结果
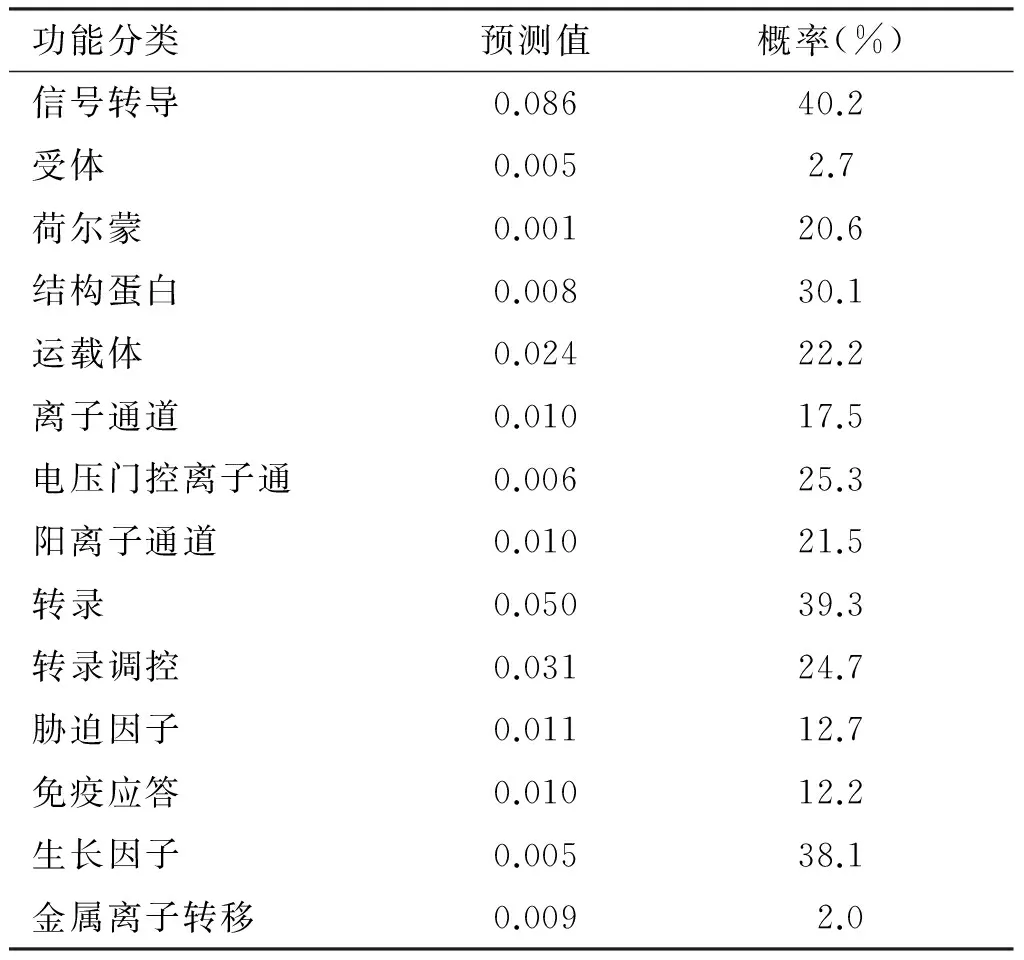
功能分类预测值概率(%)信号转导0.08640.2受体0.0052.7荷尔蒙0.00120.6结构蛋白0.00830.1运载体0.02422.2离子通道0.01017.5电压门控离子通0.00625.3阳离子通道0.01021.5转录0.05039.3转录调控0.03124.7胁迫因子0.01112.7免疫应答0.01012.2生长因子0.00538.1金属离子转移0.0092.0
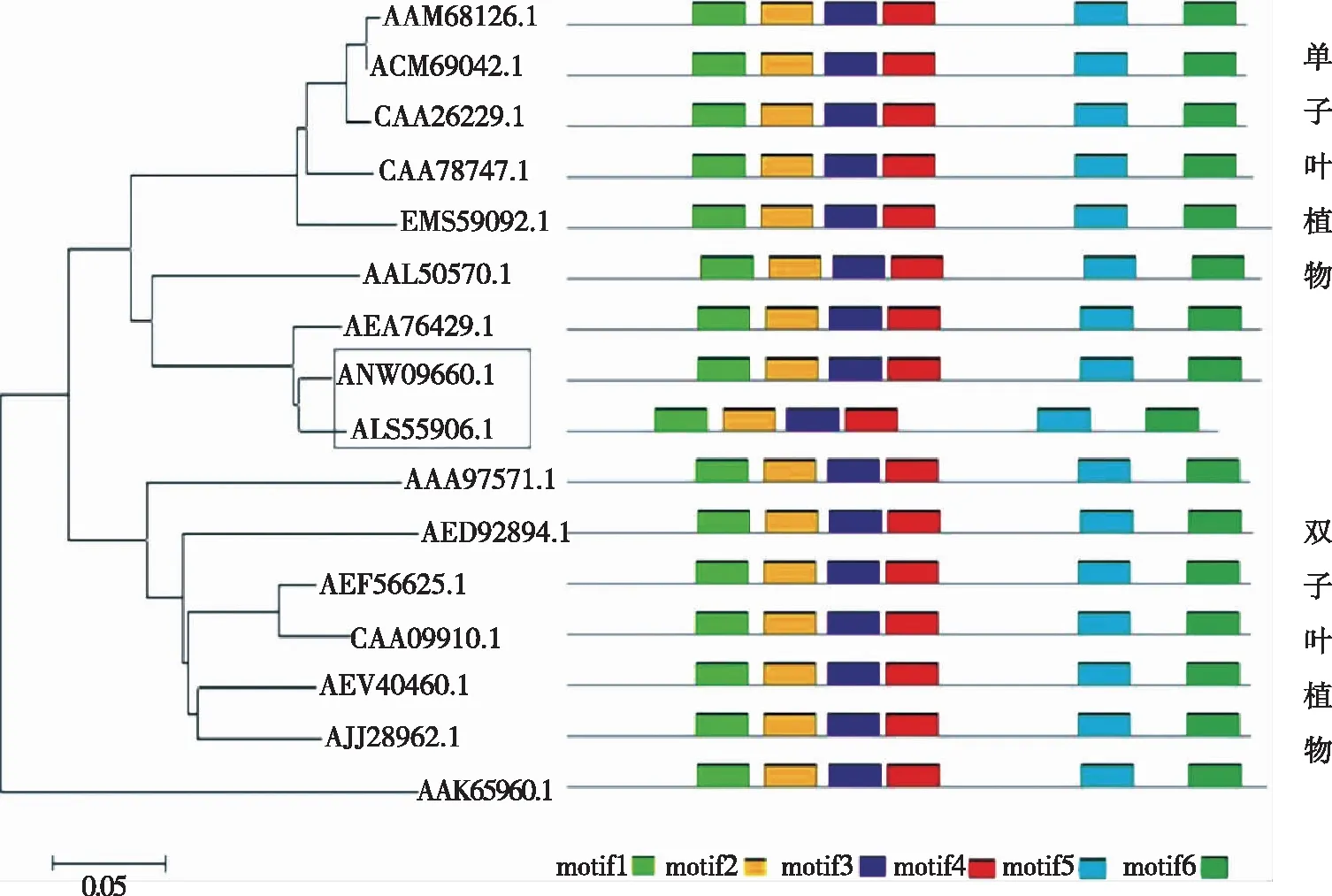
AAM68126.1:甘蔗;ACM69042.1:高粱;CAA26229.1:玉米;CAA78747.1:水稻;EMS59092.1:小麦;AAL50570.1:绿竹;AEA76429.1:金蝶兰;ANW09660.1:白及;ALS55906.1:铁皮石斛;AAA97571.1:马铃薯;AED92894.1:拟南芥;AEF56625.1:花生;CAA09910.1:豌豆;AEV40460.1:木棉;AIJ28962.1:木薯;AAK65960.1:甜菜。图4 白及蔗糖合酶系统进化分析
3 讨论
参与植物体内蔗糖代谢的酶有3种:蔗糖磷酸合成酶( Sucrose Phosphate Synthase, SPS)、蔗糖合酶( Sucrose Synthase, SuSy)、转化酶( Invertase, Ivr)[17],植物中广泛存在的一种糖基转移酶是蔗糖合酶[18],也是催化蔗糖代谢反应的关键酶。在UDP存在时,蔗糖合酶可催化蔗糖分解生成UDP-葡萄糖和果糖的可逆反应[19]。而UDP-葡萄糖则作为糖基供体,为生物合成糖苷、寡糖、多糖和糖蛋白等含糖基化合物提供糖基[20]。这些特点使蔗糖合酶能影响植物的呼吸、碳水化合物的生物合成及利用等过程,因此研究植物蔗糖合酶及其功能是揭示植物生长发育规律的重要内容,而且已经有了较大进展[21]。对白及的蔗糖合酶序列进行生物信息学分析,有利于进一步了解白及蛋白所发挥的生理作用与代谢功能。
用蛋白质的氨基酸序列构建的遗传进化树分支能显示物种间的亲缘关系,还能评价蛋白功能的相关性,由于植物在长期适应环境的进化过程中,相关生理功能的基因因其保护作用而表现得相对保守[22]。本研究对蔗糖合酶进行系统进化分析,结果显示白及与亲缘关系较近的铁皮石斛同处于一个分支上,其核苷酸序列同源性高达91%。进一步选择与白及亲缘关系差异较大和较小的2个物种进行蔗糖合酶氨基酸序列的多序列比对,发现与铁皮石斛有高度同源性(91.54%),说明植物蔗糖合酶氨基酸序列的一致性很高,是相对保守的结构蛋白。而近年来的多种研究分析也表明蔗糖合酶基因在不同的物种中具有功能的保守性。
预测白及蔗糖合酶氨基酸序列的结构域发现其具有典型的蔗糖合酶结构,蔗糖合酶基因都有蔗糖合成酶和糖基转移酶结构域,基本单位结构域是以α-螺旋结构、无规则卷曲结构、线状结构和β-转角相互作用形成的复杂结构,进一步折叠形成蛋白质的三级结构。蔗糖合成酶在以下反应中催化蔗糖的合成:UDP-葡萄糖+ D-果糖= UDP +蔗糖,而蔗糖合酶的羧基末端区域属于糖基转移酶家族。蔗糖转运酶能催化糖部分从激活的供体分子转移到特定的受体分子,从而形成糖苷键。由此可以说明蔗糖合酶在植物的代谢网络中起着至关重要的作用。
蛋白质的亚细胞可以决定其功能,植物的蔗糖合酶基因主要以可溶性形式存在于细胞质中,蔗糖合酶能迅速变化其在细胞中的存在方式来行使不同的生理功能。当蔗糖合酶存在于细胞质中以可溶性形式时,主要为细胞的能量代谢和淀粉的合成提供蔗糖分解的产物[23],本文推测的白及蔗糖合酶是存在于细胞质中的可溶性稳定蛋白,而在大麦和黄瓜等植物中也发现了定位在细胞质中的蔗糖合酶[24-25]。白及蔗糖合酶的功能预测主要是信号转导,因为蔗糖是重要的信号分子,可以参与植物的生长发育过程,并且蔗糖合酶通过介导的蔗糖代谢反应释放的己糖,其作为信号分子直接感知或者通过能量和代谢物之间的改变间接感知上游信号从而触发信号转导[26]。本研究首次对白及蔗糖合酶基因进行了生物信息学分析,为进一步阐明蔗糖合酶的作用机制及功能应用奠定了理论基础,为植物白及蔗糖合酶基因的分子研究提供了理论依据及基础资料。
[参考文献]
[1] 万大群,赵仁全,刘海,等. 白及的成分、药理作用和临床应用研究进展[J].中国药业,2017,26(2):93-96.
[2] 吴宗德, 刘汉君, 孙颖媛. 白芨粉治疗消化性溃疡60例疗效观察[J]. 遵义医学院学报, 2004,27(3):255-256.
[3] 国家药典委员会.中华人民共和国药典(一部) [S].北京:中国医药科技出版社, 2015.
[4] 汤逸飞,阮川芬,应晨,等.白及属植物化学成分与药理作用研究进展[J].中草药,2014,45(19) : 2864.
[5] 寇泽琪,闫德彪,冯锋.天然联苄类化合物研究进展[J].海峡药学,2013,25(9):1-6.
[6] 孙爱静,庞素秋,王国权.白及化学成分与抗肿瘤活性研究[J].中国药学杂志,2016,51(2):101-104.
[7] 马先杰,崔保松,韩少伟等.中药白及化学成分的研究[J].中国中药杂志,2017,42(8):1578-1584.
[8] Fu H, Park W D.Sink- and vascular-associated sucrose synthase functions are encoded by different gene classes in potato[J]. Plant Cell, 1995, 7(9):1369-1385.
[9] Chourey P S, Nelson O E. Theenzymatic deficiency conditioned by the shrunken-1 mutations in maize [J].Biochemical Genetics, 1976, 14(11-12):1041-1055.
[10]Fujii S, Hayashi T,Mizuno K. Sucrosesynthase is an integral component of the cellulose synthesis machinery [J].Plant and Cell Physiology, 2010, 51(2):294-301.
[11]Coleman H D, Yan J, Mansfield S D. Sucrose synthase affects carbon partitioning to increase celluloseproduction and altered cell wall ultrastructure [J].PNAS,2009,106(31):13118-13123.
[12]Marana C, Garcia-Olmedo F, Carbonelo P. Different expressionof twotypes of sucrose synthaseencoding genes in wheat inresponse to anaerobiosis, cold shock and light[J].Gene,1990, 88(2):167-172.
[13]何美敬,刘立峰,穆国俊,等.花生蔗糖合酶基因(SuSy)的克隆和干旱胁迫表达分析[J].作物学报, 2012, 38(12): 2139-2146.
[14]刘洋,赵香娜,岳美琪,等.甜高粱蔗糖合成酶基因(Susy2)的克隆及结构和功能分析[J].农业生物技术学报,2010,18(1):24-29.
[15]Wen X, Zhang W, Feng Y, et al. Cloning and characterization ofa sucrose synthase-encoding gene from muskmelon[J]. MolBiol Rep, 2010, 37(2):695-702.
[16]孟衡玲,段承俐,萧凤回,等.铁皮石斛蔗糖合成酶基因的克隆及表达分析[J].中国中药杂志,2011,36(7):833-837.
[17]张明方,李志凌.高等植物中与蔗糖代谢相关的酶[J].植物生理学通讯,2002,38(3):289-295.
[18]Klotz K L,Haagenson D M.Wounding, anoxia and cold induce sugarbeet sucrose synthase transcriptional changes that are unrelated to protein expression and activity[J]. J Plant Physiol, 2008, 16(4):423-434.
[19]Persia D, Cai G, Del Casino C,et al.Sucrose synthase is associated with the cell wall of tobacco pollen tubes[J]. Plant Physiol, 2008, 147(4) :603-618.
[20]李丽娜,孔建强.植物蔗糖合酶的结构、功能及应用[J].中国生物化学与分子生物报,2015,31(9):904-913.
[21]Baier M C, Keck M, Gödde V, et al. Knockdown of the symbiotic sucrose synthase MtSucS1 affects arbuscule maturation and maintenance in mycorrhizal roots of Medicago truncatula[J]. Plant Physiology, 2010, 152(2):1000-1014.
[22]钱刚,平军娇,张珍,等.三种棱型大麦脱水素6(DHN6)的性质与蛋白质进化分析[J].基因组学与应用生物学, 2011,30(3):322-329.
[23]房经贵,朱旭东,贾海锋,等.植物蔗糖合酶生理功能研究进展[J].南京农业大学学报,2017,40(5):759-768.
[24]Barrero-Sicilia C, Hernando-Amado S, González-Melendi P, et al. Structure, expression profile and subcellular localisation of four different sucrose synthase genes from barley[J]. Planta, 2011, 234(2):391-403.
[25]Ruan Y L,Llewellyn D J,Furbank R T.Suppression of sucrose synthase gene expression represses cotton fiber cell initiation,elongation,andseed development[J].The Plant Cell,2003,15(4):952-964.
[26]Li L,Sheen J. Dynamic and diverse sugar signaling[J].Current Opinion in Plant Biology,2016,33:116-125.
- 遵义医科大学学报的其它文章
- MUC2和TFF3在结肠腺瘤和腺癌组织的表达及意义
- 宫颈套扎术在IB2/IIA2期局部晚期宫颈癌先期处理中的运用
- 纳米铜硅胶膜厚度对MAS-IUS控释效果影响的实验研究
- Asymmetric reduction of chroman-4-one and its derivate by whole cell of Pseudomonas plecoglossicida
- 金钗石斛在SD大鼠体内的药代动力学研究
- Effects of morroniside on oxidative stress and cardiomyocyte apoptosis in rats with acute myocardial infarction

