昆仑雪菊多酚对花生油氧化稳定性的影响
白云慧,王国义,温海超,张 磊,倪元颖,李景明,*
(1.中国农业大学食品科学与营养工程学院,北京 100083;2.北京物资学院物流学院,北京 101149;3.新疆农业大学科研管理处,新疆 乌鲁木齐 830091)
花生油,也称花生仁油,花生(Archis hypogaea L.)为原料制得,花生油是世界上第六大植物油,次于棕榈油、大豆油、菜籽油、葵花籽油和棕榈仁油,大量生产于中国、印度和美国,我国是花生油的第一大生产国[1]。花生油的主要成分为甘油三酯[2],花生油的不饱和脂肪酸含量为80.29%,其中,46.97%为不饱和脂肪酸,33.21%为多不饱和脂肪酸,油酸和亚油酸是花生油的主要脂肪酸[3],不饱和脂肪酸在加热及长期贮存过程中易生成酸、醇、醛、酮、内酯等氧化产物[4],不仅影响食品风味[5],某些氧化产物还具有神经毒性[6],破坏细胞的亚结构,影响细胞功能[7],长期食用损伤肝脏[8]。
通过氮气保存[9]、改良包装材料[10]、添加抗氧化剂[11]和选育优良品种[12]能够有效延缓油脂氧化。我国允许在食用油中添加天然抗氧化剂和合成抗氧化剂[13]。合成抗氧化剂能有效提高油脂的氧化稳定性,然而,有研究报道,合成抗氧化剂破坏DNA的双螺旋结构[14]、具有细胞毒性[15]、致癌[16],过量食用会抑制生长[17],其中,丁基羟基茴香醚被国际癌症研究中心评定为2B级致癌物质,此外,特丁基对苯二酚等合成抗氧化剂高温条件下易发生分解[18],没食子酸自身的苦涩味影响食品感官品质[14]。
天然抗氧化剂作为合成抗氧化剂的替代品,由于其来源无害,广泛受到消费者和研究人员的关注,我国目前允许使用的天然抗氧化剂包括茶多酚、甘草抗氧化物、抗坏血酸棕榈酸酯、磷脂、迷迭香提取物、VE和竹叶抗氧化物[13]。昆仑雪菊(Kunlun chrysanthemum),学名为两色金鸡菊(Coreopsis tinctoria Nutt.),系菊科(Compositae)金鸡菊属(Coreopsis),原产于北美地区,在我国大量分布于新疆南部地区[19]。研究表明昆仑雪菊提取物富含酚类化合物,包括黄酮类和原花青素,其抗氧化效果显著[20-21]。昆仑雪菊多酚经纯化后,其羟自由基清除能力、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除能力和还原能力显著高于VC[22],昆仑雪菊中的奥卡宁、异甘草素、海生菊苷、花旗松素和异奥卡宁的DPPH自由基清除能力高于VE[23]。
昆仑雪菊多酚作为有效的天然抗氧化剂,其用于延缓食用油脂氧化的研究鲜见报道。本研究以花生油为氧化基质,以昆仑雪菊为原料制备多酚,将制备得到的多酚作为天然抗氧化剂添加到食用油中,通过加速氧化的方法,探究昆仑雪菊多酚对花生油氧化稳定性的影响,为昆仑雪菊多酚在食用油中的应用提供一定的实验依据。
1 材料与方法
1.1 材料与试剂
昆仑雪菊购自新疆和田地区,烘干后,经螺纹式粉碎机粉碎成粉末,真空包装,-40 ℃条件下贮存;花生油,物理压榨工艺制备,采自北京市顺义区花旗食用油加工厂,-20 ℃保存。
冰乙酸、三氯甲烷、异辛烷、碘化钾、对-甲氧基苯胺、甲醇、五水合硫代硫酸钠(均为分析纯) 国药集团化学试剂有限公司;三吡啶基三嗪(tripyridyltriazine,TPTZ)、水溶性维生素(Trolox)(均为色谱纯)美国Sigma-Aldrich上海贸易有限公司。
1.2 仪器与设备
DHG-9140A型电热鼓风干燥箱 上海一恒科学仪器有限公司;T6型紫外分光光度计 北京普析通用仪器有限公司;KY-003型真空包装机 东莞大朗开姆电器厂;LGJ-12型冷冻干燥机 北京益德益华科技发展有限公司;RE52-99型旋转蒸发器 上海亚荣生化仪器厂;SK5200H超声波清洗器 上海科导超声仪器有限公司;TBD-2000型紫外检测器 上海金达生化仪器有限公司;892型油脂氧化稳定性测定仪 瑞士万通有限公司;456 GC气相色谱仪 布鲁克(北京)科技有限公司;HP-INNOWAX毛细管色谱柱(30 m×0.32 mm,0.25 μm) 美国安捷伦科技有限公司。
1.3 方法
1.3.1 昆仑雪菊多酚的提取与纯化
甲醇为提取溶剂,采用超声辅助溶剂提取法,准确称取10.00 g昆仑雪菊粉,加入100 mL甲醇混匀,于室温条件下超声30 min,超声功率为340 W,提取2 次,合并提取液,昆仑雪菊多酚提取液经8 倍水稀释,调节pH值为4.0,用AB-8大孔树脂纯化,上样流速为3 BV/h,最大上样量为160 mL,吸附时间为2 h,经蒸馏水洗脱至无色后,用洗脱剂洗脱,洗脱剂为70%乙醇溶液,洗脱速率为5 BV/h,洗脱剂用量为5 BV。得到洗脱液,真空旋蒸,去除乙醇,冻干,得到昆仑雪菊多酚,经福林-肖卡方法[24]测定其总酚质量分数为82.96%。
1.3.2 花生油中总酚含量测定
按照100(Cor.100)、200(Cor.200)、400(Cor.400)mg/kg和700(Cor.700)mg/kg的不同含量,将昆仑雪菊添加到花生油中,搅拌并振荡混匀,在室温条件下静置24 h后,取上层植物油测其多酚含量。花生油中多酚提取方法参考Monaco等[25]的方法,准确称取5.00 g花生油,加入5 mL甲醇-1% HCl溶液,涡旋混合,剧烈振荡2 min,在37 ℃、150 r/min条件下磁力搅拌30 min,4 ℃、4 000 r/min离心15 min,保留上清液至试管中,铝箔包裹,冰上保存并分析。
多酚含量测定参考Laouini等[24]的方法。结果以没食子酸当量(gallate acid equivalent,GAE)表示(mg GAE/kg)。
1.3.3 昆仑雪菊多酚对花生油氧化稳定性的影响
采用Schaal烘箱法加速花生油氧化,以添加200 mg/kg的二丁基羟基甲苯(butylated hydroxy toluene,BHT)为阳性对照(BHT组),空白组不添加任何抗氧化剂,昆仑雪菊多酚添加含量分别为100、200、400 mg/kg和700 mg/kg,以过氧化值(peroxide value,PV)、p-茴香胺值(p-anisidine value,p-AnV)、总氧化值(total oxidation value,TOTOX)为基本理化指标,评价昆仑雪菊多酚添加量对花生油氧化稳定性的影响;通过测定PV、p-AnV、TOTOX和硫代巴比妥酸值(thiobarbituric acid value,TBAV)4 个指标,评价添加含量为700 mg/kg的昆仑雪菊多酚对花生油抗氧化能力的影响。
PV测定方法参考AOCS Official Method Cd 8-53[26];p-AnV参考AOCS Official Method Cd 18-90[27];TOTOX根据公式TOTOX=2PV+p-AnV计算;TBAV参考AOCS Official Method Cd 19-90[28]。
1.3.4 花生油DPPH自由基清除能力和铁离子还原能力(ferric reducing antioxidant power, FRAP)测定
DPPH自由基清除能力测定方法参考Condellin等[29]的方法并做改动,以Trolox和BHT为阳性对照,Trolox和BHT在花生油中的含量为200 mg/kg,昆仑雪菊多酚在花生油中的含量为700 mg/kg,Schaal烘箱法氧化后,测定添加不同抗氧化剂花生油氧化过程中的DPPH自由基清除能力,称取50~250 mg的样品,空白组不添加样品,测定其吸光度(A0),加入5 mL 0.5 mmol/L DPPH-甲醇溶液和5 μL吐温-20,振荡混匀,室温暗处反应60 min,反应结束后,在波长515 nm处测定吸光度(A)。DPPH自由基清除率按下式计算:

FRAP测定参考Müller等[30]的方法并做改动,用40 mmol/L盐酸配制10 mmol/L的TPTZ,制备20 mmol/L的FeCl3·6H2O和0.3 mol/L的醋酸缓冲液(pH 3.6),将TPTZ溶液、FeCl3溶液和醋酸缓冲液以1∶1∶10的体积比混合,得到FRAP试剂,于37 ℃保温30 min备用;准确称取一定质量的花生油并溶于正己烷,配成质量浓度为0.0~2.5 mg/mL的溶液,混匀,准确吸取500 μL的样品溶液于反应试管中,加入3.0 mL的FRAP试剂,混匀,室温条件下振荡混匀,反应6 min,每隔1 min振荡20 s,反应结束后于4 ℃、1 000×g离心1 min,于波长595 nm处测定下层反应液的吸光度,空白组以正己烷代替样品溶液,设置3 个平行。
1.3.5 花生油诱导期(induction period,IP)测定
IP测定参考Farhoosh等[31]的方法并做改动,样品上样量为3 g,气体流速为20 L/h,温度分别设为100、110、120 ℃和130 ℃;在IP的基础上,采用抗氧化系数(protection factor,PF)来评价昆仑雪菊多酚的抗氧化能力,PF=IP(含抗氧化剂)/IP(空白组),PF小于1说明该物质促进油脂氧化,PF等于1说明该物质对油脂氧化无影响,1<PF≤2说明该物质具有抗氧化活性,2<PF≤3说明该物质有明显的抗氧化活性,PF大于3说明该物质有很强的抗氧化活性;并根据氧化酸败仪自带软件推算油脂货架期。
1.3.6 花生油脂肪酸组成检测
脂肪酸甲酯化方法参考AOCS Official Method Ce 2-66[32];
脂肪酸甲酯气相色谱条件:采用HP-INNOWAX毛细管色谱柱(30 m×0.32 mm,0.25 μm);载气(He)流速1.0 mL/min;进样口温度260 ℃;分流进样,分流比80∶1;进样量1 μL;升温程序:150 ℃保持3 min,以2 ℃/min升温至200 ℃,保持5 min,以20 ℃/min升温至230 ℃,保持2 min。
定性方法:根据脂肪酸标准品出峰的保留时间定性。定量方法:采用峰面积归一化法,得到各脂肪酸的相对含量。
2 结果与分析
2.1 昆仑雪菊多酚添加量对花生油总酚含量的影响
在花生油中添加量为100~700 mg/kg的昆仑雪菊多酚,静置24 h后,测定花生油中的总酚含量。经过24 h的静置后,部分昆仑雪菊多酚未溶解到花生油中,会在杯壁上析出。昆仑雪菊多酚添加量越多,花生油中总酚含量越高。如图1所示,花生油的初始总酚含量为20.52 mg GAE/kg,刘慧敏[3]测定花生油中总酚含量为26.07 mg GAE/kg。昆仑雪菊多酚添加量在700 mg/kg时,花生油中的总酚含量可达到544.06 mg GAE/kg。添加多酚能够直接有效提高植物油总酚含量[11],通过植物油直接浸提天然产物同样能提高植物油中的总酚含量[33]。

图1 昆仑雪菊多酚添加量对花生油总酚含量的影响Fig. 1 Effect of Kunlun chrysanthemum polyphenols on the total phenols content of peanut oil
2.2 昆仑雪菊多酚添加量对花生油氧化稳定性的影响

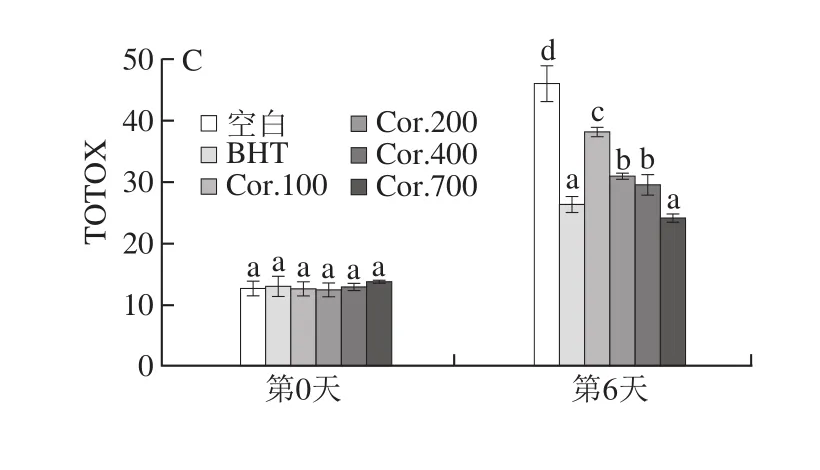
图2 昆仑雪菊多酚添加含量对花生油PV(A)、p-AnV(B)和TOTOX(C)的影响Fig. 2 Effect of Kunlun chrysanthemum polyphenols on PV (A),p-AnV (B) and TOTOX (C) of peanut oil during accelerated oxidation
如图2所示,在氧化至第6天时,空白组花生油的PV、p-AnV和TOTOX明显上升,合成抗氧化剂BHT能有效延缓PV、p-AnV和TOTOX的增加,同样的,添加了昆仑雪菊多酚的花生油,PV、p-AnV和TOTOX低于空白组,且含量越高,抗氧化效果越好,茶多酚、芝麻饼和橄榄饼等的提取物添加在油脂中,同样呈现添加量和抗氧化效果呈正相关的结果[11,34]。昆仑雪菊多酚和BHT添加量相同时,其抗油脂氧化能力显著弱于BHT,然而添加量为700 mg/kg时,其抗氧化能力同BHT相当(P>0.05)。
2.3 昆仑雪菊多酚对花生油氧化稳定性的影响

图3 昆仑雪菊多酚对花生油加速氧化过程中PV(A)、p-AnV(B)、TOTOX(C)和TBAV(D)的影响Fig. 3 Effects of Kunlun chrysanthemum polyphenols on PV (A), p-AnV (B),TOTOX (C) and TBAV (D) of peanut oil during accelerated oxidation
以PV、p-AnV、TOTOX和TBAV为理化指标,评价昆仑雪菊多酚添加量为700 mg/kg时,对花生油氧化稳定性的影响,结果如图3所示。花生油在加速氧化过程中,PV显著增加(图3A),由最初的5.47 meq O2/kg上升到40.27 meq O2/kg,在氧化至第3天到第12天时,昆仑雪菊组和阳性对照组的过氧化值显著低于空白组,而氧化至第12天时,昆仑雪菊组的PV显著低于空白组和阳性对照组(P<0.05),说明昆仑雪菊多酚能够持续稳定地延缓花生油氧化过程中过氧化物的生成。
油脂氧化过程中首先生成过氧化物,过氧化物稳定性差,进一步分解为醛酮类化合物,p-AnV用于表示植物油中的非挥发性二级氧化产物的生成情况。如图3B所示,在12 d的加速氧化过程中,花生油的p-AnV由最初的1.74上升到2.89,二级氧化产物总量发生显著增加,在氧化至第9天时,添加了抗氧化剂(BHT和昆仑雪菊多酚)花生油的p-AnV显著低于空白组(P<0.05),在氧化至第12天时,昆仑雪菊多酚组和BHT组的p-AnV无显著性差异(P<0.05),说明该添加量条件下,昆仑雪菊多酚抑制油脂二级氧化产物的生成能力同BHT相当。
TOTOX被广泛地用于评价油脂氧化酸败程度,该指标综合了油脂氧化的初级和二级氧化产物生成情况,更全面地评价油脂氧化程度。如图3C所示,在12 d的加速氧化过程中,空白组的总氧化值发生了显著增加,总氧化值由最初的12.67上升到83.42,同PV和p-AnV趋势相同,添加了抗氧化剂(BHT和昆仑雪菊多酚)的花生油其TOTOX显著低于空白组,在氧化至第12天时,添加了昆仑雪菊多酚的花生油其总氧化值为42.01,显著低于阳性对照组47.58,说明昆仑雪菊多酚能够有效延缓油脂氧化的进行,且随着花生油氧化的进一步进行,其抗氧化能力显著高于BHT(P<0.05)。
油脂酸在氧化过程中会分解产生醛、酸类化合物,丙二醛是分解产物之一,硫代巴比妥酸还原法是检测丙二醛含量的方法之一,可用于评价油脂氧化程度。如图3D所示,在12 d的加速氧化过程中,未添加抗氧化剂(BHT和昆仑雪菊多酚)的花生油,TBAV增加趋势显著,从最初的6.09增加到8.29,而添加了BHT和昆仑雪菊多酚的花生油中的TBAV无显著增加,BHT和昆仑雪菊多酚能够有效抑制油脂氧化过程中丙二醛的生成,两者的抗氧化能力无显著性差异(P>0.05)。
2.4 昆仑雪菊多酚对花生油DPPH自由基清除能力和FRAP的影响

图4 昆仑雪菊多酚对花生油DPPH自由基清除能力(A)和FRAP(B)的影响Fig. 4 DPPH radical-scavenging capacity (A) and ferric ion reducing antioxidant power (B) of Kunlun chrysanthemum polyphenols in peanut oil
DPPH自由基清除能力和FRAP是评价抗氧化剂抗氧化能力的常用方法,其基本原理为单电子转移。如图4所示,发生氧化的花生油,其抗氧化能力显著低于未发生氧化的花生油(P<0.05)。昆仑雪菊多酚能够提高花生油的初始抗氧化能力,发生氧化后,由于部分抗氧化剂参与抗氧化过程,因此,其抗氧化能力降低,添加昆仑雪菊多酚的花生油发生氧化后仍保持显著的抗氧化能力(P<0.05)。植物油中多酚类化合物含量同其抗氧化能力呈正相关,总酚含量越高,抗氧化能力越强[35]。研究表明,昆仑雪菊多酚具有较强的自由基清除能力[22],昆仑雪菊中含有原花青素、酚酸和黄酮等多酚类化合物[19,21,23],奥卡宁等单体物的抗氧化能力显著高于VE[23]。昆仑雪菊多酚添加到植物油中后,提高了植物油中的总酚含量,进一步提高了植物油的自由基清除能力。
2.5 昆仑雪菊多酚对花生油IP和货架期的影响
采用Rancimat方法,测定花生油在100、110、120 ℃和130 ℃条件下的IP,探究昆仑雪菊多酚对花生油高温条件下氧化稳定性的影响,见表1。花生油的IP同加速氧化温度相关,同等条件下,温度越高IP越短,100 ℃条件下,花生油的IP为18.21 h,BHT组的IP为19.68 h,添加了昆仑雪菊多酚的花生油氧化IP显著高于空白组和BHT组(P<0.05),110、120 ℃和130 ℃条件下同样存在这一规律,说明昆仑雪菊多酚和BHT在高温条件下仍能发挥抗氧化能力,且在该添加量条件下,昆仑雪菊多酚的抗氧化能力优于BHT,经氧化酸败仪自带软件推算货架期,空白组的货架期在10.9 个月左右,添加了BHT花生油的货架期可以达到12 个月左右,添加了昆仑雪菊多酚花生油的货架期可以达到48 个月左右。有研究表明,BHT为挥发性酚类化合物,同时热稳定性差,在100 ℃即挥发分解,而咖啡酸、阿魏酸等天然抗氧化剂的热稳定性优于合成抗氧化剂[36]。如表2所示,在4 个温度条件下,添加了BHT的花生油在1~2之间,说明抗氧化剂能够有效延缓油脂氧化,昆仑雪菊多酚PF在3.7~4.2范围内,高于BHT组,说明昆仑雪菊具有极强的抗氧化能力。

表1 昆仑雪菊多酚对花生油IP的影响Table 1 Effect of Kunlun chrysanthemum polyphenols on induction period of peanut oil

表2 昆仑雪菊多酚对花生油PF的影响Table 2 Effect of Kunlun chrysanthemum polyphenols on oxidation protection factor of peanut oil
2.6 花生油氧化过程中总酚含量的变化

图5 花生油氧化过程中总酚含量Fig. 5 Total phenols content in peanut oil during accelerated oxidation
如图5所示,花生油在加速氧化过程中总酚含量在不断下降,在经过12 d的氧化后,花生油中的总酚含量由20.52 GAE mg/kg降低至7.18 GAE mg/kg,BHT不能够有效地延缓花生油氧化过程中总酚含量的降低;添加昆仑雪菊多酚后,花生油中总酚含量由最初的20.52 GAE mg/kg升高至544.06 GAE mg/kg,经过12 d的氧化后,由于一部分昆仑雪菊多酚参与清除油脂氧化过程中产生的自由基,总酚含量显著降低至410.12 GAE mg/kg(P<0.05),橄榄油在贮存过程中总酚含量的变化也呈现相同的规律[37]。

表3 花生油中总酚含量同氧化稳定性指标的Pearson相关系数Table 3 Pearson correlation coefficient between total phenols content and oxidative stability index in peanut oil
如表3所示,对花生油中总酚含量同氧化稳定性指标采用Pearson进行相关性分析。花生油氧化过程中总酚含量同花生油的氧化稳定性显著相关,随着氧化的进行,PV、p-AnV、TOTOX和TBAV上升,说明油脂产生过氧化物及二级氧化产物,使油脂氧化酸败,而花生油中添加昆仑雪菊多酚可参与抑制油脂氧化反应,总酚含量呈下降的趋势,同时PV、p-AnV、TOTOX和TBAV下降,减少了花生油的氧化酸败。
2.7 昆仑雪菊多酚对花生油脂肪酸的影响

表4 昆仑雪菊多酚对花生油氧化过程中脂肪酸组成的影响Table 4 Effect of Kunlun chrysanthemum polyphenols on the fatty acid composition of peanut oil during storage
将花生油在60 ℃条件下进行加速氧化,对花生油氧化过程中的主要脂肪酸(棕榈酸、硬脂酸、油酸、亚油酸和亚麻酸)进行分析,如表4所示。虽然花生油氧化过程中亚麻酸等个别不饱和脂肪酸的相对含量降低具有显著性(P<0.05),但总体而言,在本实验较短的催化氧化实验过程中,多数脂肪酸含量的变化并不十分显著。有研究发现,在油脂氧化过程中,过氧化值的变化明显早于脂肪酸组成的变化,在针对植物油氧化稳定性的研究中发现,在7 d内(过氧化值低于60 meq O2/kg),脂肪酸组成变化不显著,经过8 d以后,过氧化值升至134 meq O2/kg,脂肪酸组成才会发生显著变化[38-39]。本实验虽然经过了12 d加速氧化,空白组花生油过氧化值为40.27 meq O2/kg,但而多数脂肪酸组成的变化并不十分显著,这与已有研究报道发现的规律基本一致。
3 结 论
本实验以纯化后昆仑雪菊多酚为天然抗氧化剂,探究对花生油的抗氧化效果。研究证明,昆仑雪菊多酚对花生油具有显著的抗氧化效果,添加700 mg/kg昆仑雪菊多酚能够显著抑制花生油氧化过程中PV、p-AnV、TOTOX和TBAV等指标的升高(P<0.05),显著提高花生油的DPPH自由基清除能力和FRAP(P<0.05),能够延长花生油货架期至48 个月,昆仑雪菊多酚可作为一种天然、无毒的抗氧化剂用于食用油脂抗氧化。
参考文献:
[1]Oilseeds: world markets and trade[R]. USDA, 2017.
[2]CARRÍN M E, CARELLI A A. Peanut oil: compositional data[J].European Journal of Lipid Science and Technology, 2010, 112:697-707. DOI:10.1002/ejlt.200900176.
[3]刘慧敏. 不同植物油微量成分与抗氧化能力的相关性研究[D].无锡: 江南大学, 2015: 8-13.
[4]GOLCOECHEA E, GUILLÉN M D. Volatile compounds generated in corn oil stored at room temperature. Presence of toxic compounds[J].European Journal of Lipid Science and Technology, 2014, 116: 395-405. DOI:10.1002/ejlt.201300244.
[5]KRISHNAMURTHY R G, SMOUSE T H, MOOKHERJEE B D, et al.Identification of 2-pentyl furan in fats and oils and its relationship to the reversion flavor of soybean oil[J]. Journal of Food Science, 1967,32: 372-374. DOI:10.1111/j.1365-2621.1967.tb09687.x.
[6]LOVELL M A, XIE C S, MARKESBERY W R. Acrolein is increased in Alzheimer’s disease brain and is toxic to primary hippocampal cultures[J]. Neurobiology of Aging, 2001, 22: 187-194. DOI:10.1016/s0197-4580(00)00235-9.
[7]MIGLIETTA A, GABRIEL L, GADONI E. Microtubular protein impairment by pentanal and hexanal[J]. Cell Biochemistry and Function, 1987, 5: 189-194. DOI:10.1002/cbf.290050306.
[8]HU W W, FENG Z H, EVELEIGH J, et al. The major lipid peroxidation product, trans-4-hydroxy-2-nonenal, preferentially forms DNA adducts at codon 249 of human p53 gene, a unique mutational hotspot in hepatocellular carcinoma[J]. Carcinogenesis, 2002, 23(11):1781-1789. DOI:10.1093/carcin/23.11.1781.
[9]何海艳. 大豆油氮气储存氧化稳定性研究[D]. 南京: 南京财经大学,2012: 35-39.
[10]GARGOURI B, ZRIBI A, BOUAZIZ M. Effect of containers on the quality of Chemlali olive oil during storage[J]. Journal of Food Science and Technology, 2015, 52(4): 1948-1959. DOI:10.1007/s13197-014-1273-2.
[11]TAGHVAEI M, JAFARI S M, MAHOONAK A S, et al. The effect of natural antioxidants extracted from plant and animal resources on the oxidative stability of soybean oil[J]. LWT-Food Science and Technology, 2014, 56(1): 124-130. DOI:10.1016/j.lwt.2013.11.009.
[12]郑畅, 杨湄, 周琦, 等. 高油酸花生油与普通油酸花生油的脂肪酸、微量成分含量和氧化稳定性[J]. 油脂化学, 2014, 39(11): 40-43.
[13]国家卫生和计划生育委员会. 食品添加剂使用标准: GB 2760—2014[S]. 北京: 中国标准出版社, 2014: 7-111.
[14]DOLATABADI J E N, KASHANIAN S. A review on DNA interaction with synthetic phenolic food additives[J]. Food Research International,2010, 43: 1223-1230. DOI:10.1016/j.foodres.2010.03.026.
[15]KOBAYASHI H, OIKAWA S, HIRAKAWA K, et al. Metal-mediated oxidative damage to cellular and isolated DNA by gallic acid, a metabolite of antioxidant propyl gallate[J]. Mutation Research, 2004,558: 111-120. DOI:10.1016/j.mrgentox.2003.11.002.
[16]BOTTERWECK A A M, VERHAGEN H, GOLDBOHM R A, et al.Intake of butylated hydroxyanisole and butylated hydroxytoluene and stomach cancer risk: results from analyses in the Netherlands cohort study[J]. Food and Chemical Toxicology, 2000, 38: 599-605.DOI:10.1016/s0278-6915(00)00042-9.
[17]VORHEES C V, BUTCHER R E, BRUNNER R L, et al. Development neurobehavioral toxicity of butylated hydroxyanisole (BHA) in rats[J]. Neurobehavioral Toxicology and Teratology, 1981, 3: 321-329.DOI:10.1016/0015-6264(81)90351-5.
[18]HIROSE M, MASUDA A, TSUDA H, et al. Enhancement of BHA-induced proliferative rat forestomach lesion development by simulaneous treatment with other antioxidants[J]. Carcinogenesis,1987, 8(11): 1731-1735. DOI:10.1093/carcin/8.11.1731.
[19]YAO L, LI L L, LI X X. The anti-inflammatory and antifibrotic effects of Coreopsis tinctoria Nutt on high-glucose-fat diet and streptozotocininduced diabetic renal damage in rats[J]. BMC Complementary and Alternative Medicine, 2015, 15(7): 314-326. DOI:10.1186/s12906-015-0826-x.
[20]ZĂLARU C, CRIŞAN C C, CĂLINESCU I, et al. Polyphenols in Coreopsis tinctoria Nutt. fruits and the plant extracts antioxidant capacity evaluation[J]. Central European Journal of Chemistry, 2014,12(8): 858-867. DOI:10.2478/s11532-014-0539-x.
[21]JING S Q, ZHANG X M, YAN L J. Antioxidant activity, antitumor effect, and antiaging property of proanthocyanidins extracted from Kunlun chrysanthemum flowers[J]. Oxidative Medicine and Cellular Longevity, 2015: 1-10. DOI:10.1155/2015/983484.
[22]YAO X C, GU C Z, TIAN L P, et al. Comparative study on the antioxidant activities of extracts of Coreopsis tinctoria flowering tops from Kunlun Mountains, Xinjiang, north-western China[J]. Natural Product Research, 2015, 30(4): 429-432. DOI:10.1080/14786419.2015.1015019.
[23]WANG W, CHEN W, YANG Y S, et al. New phenolic compounds from Coreopsis tinctoria Nutt. and their antioxidant and angiotensin I-converting enzyme inhibitory activities[J]. Journal of Agricultural and Food Chemistry, 2015, 63: 200-207. DOI:10.1021/jf504289g.
[24]LAOUINI S E, SEGNI L, GHERRAF N, et al. Scavenging activity, anti-inflammatory and diabetes related enzyme inhibition properties of ethanol leaves extract of Phoenyx dactylifera[J].Journal of Fundamental and Applied Sciences, 2015, 5(2): 171-181.DOI:10.4314/jfas.v5i2.5.
[25]MONACO G D, OFFICIOSO A, D’ANGELO S, et al. Characterization of extra virgin olive oils produced with typical Italian varieties by their phenolic profile[J]. Food Chemistry, 2015, 184: 220-228.DOI:10.1016/j.foodchem.2015.03.071.
[26]American Oil Chemists Society. Peroxide value acetic acid-chloroform method: AOCS official method Cd 8-53[S]. Champaign, IL: AOCS Press, 1997: 1-2.
[27]American Oil Chemists Society. p-Anisidine value: AOCS official method Cd 18-90[S]. Champaign, IL: AOCS Press, 2011: 1-2.
[28]American Oil Chemists Society. 2-Thiobarbituric acid value direct method: AOCS official method Cd 19-90[S]. Champaign, IL: AOCS Press, 2009: 1-2.
[29]CONDELLI N, CARUSO M C, GALGANO P, et al. Prediction of the antioxidant activity of extra virgin olive oils produced in the Mediterranean area[J]. Food Chemistry, 2015, 177: 233-239.DOI:10.1016/j.foodchem.2015.01.001.
[30]MÜLLER L, FRÖHLICH K, BÖHM V. Comparative antioxidant activities of carotenoids measured by ferric reducing antioxidant power (FRAP), ABTS bleaching assay (αTEAC), DPPH assay and peroxyl radical scavenging assay[J]. Food Chemistry, 2011, 129: 139-148. DOI:10.1016/j.foodchem.2011.04.045.
[31]FARHOOSH R, HOSEINI-YAZDI S-Z. Shelf-life prediction of olive oils using empirical models developed at low and high temperatures[J]. Food Chemistry, 2013, 141: 557-565. DOI:10.1016/j.foodchem.2013.03.024.
[32]American Oil Chemists Society. Preparation of methyl esters of fatty acids: AOCS official method Ce 2-66[S]. Champaign, IL: AOCS Press, 1997: 1-2.
[33]JABRI-KAROUI I, MARZOUK B. Bioactive compounds, antioxidant activities and heat stability of corn oil enriched with Tunisian Citrus aurantium L. peel extract[J]. Journal of the American oil Chemists’Society, 2014, 91(8): 1367-1375. DOI:10.1007/s11746-014-2485-3.
[34]TAGHVAEI M, JAFARI S M. Application and stability of natural antioxidants in edible oils in order to substitute synthetic additives[J].Journal of Food Science and Technology, 2015, 52(3): 1272-1282.DOI:10.1007/s13197-013-1080-1.
[35]BALLUS C A, MEINHART A D, CAMPOS F A D S, et al. Total phenolics of virgin olive oils highly correlate with the hydrogen atom transfer mechanism of antioxidant capacity[J]. Journal of the American Oil Chemists’ Society, 2015, 92(6): 843-851. DOI:10.1007/s11746-015-2629-0.
[36]SANTOS N A, CORDEIRO A M T M, DAMASCENO S S, et al.Commercial antioxidants and thermal stability evaluations[J]. Fuel,2012, 97: 638-643. DOI:10.1016/j.fuel.2012.01.074.
[37]GÓMEZ-ALONSO S, MANCEBO-CAMPOS V, SALVADOR M D, et al. Evolution of major and minor components and oxidation indices of virgin olive oil during 21 months storage at room temperature[J]. Food Chemistry, 2007, 100(1): 36-42. DOI:10.1016/j.foodchem.2005.09.006.
[38]NAVAS P B, CARRASQUERO-DURÁN A, FLORES I. Effect of black tea, garlic and onion on corn oil stability and fatty acid composition under accelerated oxidation[J]. International Journal of Food Science and Technology, 2006, 41(3): 243-247. DOI:10.1111/j.1365-2621.2005.01056.x.
[39]SHEN N, DUVICK S, WHITE P, et al. Oxidative stability and aromascan analyses of corn oils with altered fatty acid content[J].Journal of the American Oil Chemists’ Society, 1999, 76(12): 1425-1429. DOI:10.1007/s11746-999-0179-z.

