牛栏山大曲可培养微生物多样性分析
朱婷婷
(北京顺鑫农业股份有限公司牛栏山酒厂,北京101301)
中国白酒作为世界六大蒸馏酒之一,具有悠久的历史和深厚的酒文化内涵[1],其酿造过程以大曲为糖化发酵剂,经糖化、发酵、蒸馏和贮存等步骤制得。白酒制曲技术是我国特有的民族遗产,代表了一个时代的进步,当制曲技术出现后,酒业就得到了规模化、规范化的发展,从此酒就离不开曲,曲决定酒[2]。俗语说“有美酒必有佳曲[3]”“曲为酒之骨[4]”,可见酒曲在白酒酿造中的重要性。
大曲是一种富含微生物菌系、酶系和曲香物质的微生态制品,具有糖化、发酵、生香等功能[5]。牛栏山二锅头属于清香型白酒,采用低温大曲进行酿造生产,其大曲主要以豌豆、大麦、小麦为原料,粉碎混合后加水踩曲制成曲块,经过卧曲、上霉、晾霉、潮火、干火、后火、养曲、贮曲等环节[6]。其生产过程是依靠从自然界中带入的各种微生物在淀粉质原料中进行富集生长并繁殖扩大,不同的微生物形成了大曲的菌系结构,因此认识大曲中微生物群落结构与差异,对于研究牛栏山二锅头白酒发酵具有十分重要的意义。
本研究利用传统分离方法,对大曲中酵母菌、丝状真菌、乳酸菌、芽孢杆菌、放线菌这5类微生物进行系统分离,确定了大曲微生物比例关系,同时结合PCR测序及鉴定,获得大曲中微生物多样性分布。
1 材料与方法
1.1 实验材料
牛栏山酒厂清香型大曲。
1.2 主要仪器与试剂
BSC-1100ⅡA2型生物安全柜,北京东联哈尔仪器制造有限公司;梯度C1000快速梯度基因扩增仪,美国BIORAD公司;基础型水平电泳仪,美国BIORAD公司;全自动凝胶成像仪,美国BIORAD公司;1-14k高速冷冻离心机,德国Eppendorf公司;YXQ-LS-75Ⅱ型数显立式压力蒸汽灭菌器,上海博迅;SPX-320型生化培养箱,宁波江南;PLR-100 64℃实验室冰箱,赛墨飞世尔。
1.3 分离培养基
酵母分离培养基:YPD培养基:yeast extract 10 g,蛋白胨20 g,葡萄糖20 g,琼脂20 g,水1 L。
乳酸菌分离培养基:MRS培养基:牛肉膏10 g,酪蛋白胨30 g,酵母提取物5 g,葡萄糖20 g,乙酸钠5 g,柠檬酸氢二胺,吐温80 1 mL,K2HPO42 g,MgSO4·7H2O 0.58 g,MnSO4·H2O 0.25 g,琼脂 12 g,水1 L。
芽孢杆菌分离培养基:肉汁培养基:蛋白胨10 g,牛肉膏3 g,NaCl 5 g,琼脂15 g,水1 L。
放线菌分离培养基:ISP2培养基:Yeast extract 4 g,Malt extract 5 g,Dextrose 4 g,Agar 18 g,水1 L,pH 7.3。
孙学峰[36]提出目前有关“帖学”和“碑学”的界定很多,论说也不尽相同,总的说来,二者的区别在于是否取法魏晋名家书迹,尤其是二王书迹,是否追求传统的“中和”审美情趣。
常规丝状真菌分离培养基:孟加拉红培养基,奥博兴外购。
耐高温丝状真菌培养基:PDA培养基:马铃薯浸提液500 mL,葡萄糖20 g,琼脂20 g,水500 mL。
1.4 实验方法
1.4.1 微生物分离、培养、计数及保藏
分离:称取牛栏山大曲10 g于90 mL无菌水混匀,拟定为10-1浓度,吸取1 mL于9 mL无菌水中,为 10-2,依次稀释为 10-3、10-4、10-5、10-6梯度。吸取不同梯度液0.1 mL,分别涂布相应平板中,涂布梯度见表1。

表1 微生物分离方法
培养:根据分离微生物的不同设定不同培养条件,酵母28℃,常规丝状真菌30℃,耐高温丝状真菌50℃,芽孢杆菌、常规细菌、乳酸菌及放线菌均为35℃。培养时间根据菌落的生长情况而定,一般为24~48 h。
计数及挑菌:根据培养结果挑选菌落数在30~300的平板进行计数,乘以稀释倍数计算不同微生物的种群数量。为获得大曲内可培养微生物准确数量关系,挑菌方法:挑选菌落数在10~100之间的梯度平板,挑取平板内所有微生物,其余梯度随机挑选多样性菌落。挑取的菌落接种到相应培养基中,培养3 d后进行分子鉴定。
1.4.2 分子生物学鉴定

表2 PCR引物及反应条件
酵母和细菌DNA提取方法:挑取少量活化的菌体,于已灭过菌的1.5 mL离心管内;加入100 μL裂解液(100 mM Tris,30 mM EDTA,0.5%SDS,pH 8.0,15磅灭菌30 min备用);100℃水浴15 min;加入100 μL 2.5 M的醋酸钾溶液,冰浴60 min;4℃下13000 r/min离心5 min,取上清液200 μL至0.5 mL离心管中;加入等体积的氯仿-异戊醇(24∶1),剧烈振荡 10 min,13000 r/min离心15 min,移取100 μL上清液至0.5 mL离心管中;加入100 μL预冷的异丙醇,混匀后-20℃下放置20 min;13000 r/min离心15 min,弃去上清液;用70%的酒精洗涤沉淀2次;沉淀过夜自然干燥;加入50 μL已灭菌的超纯水,室温下溶解1 h,-20℃冰箱储藏备用。
丝状真菌DNA提取方法:FastDNA SPIN Kit for Soil试剂盒提取。PCR产物及反应条件见表2。
2 结果与分析
2.1 大曲微生物数量关系
采用传统微生物分离方法,获得酵母菌、丝状真菌、乳酸菌、芽孢杆菌和放线菌的菌群数量,由于酵母菌形态差异较大,根据形态特征及数量分布,将大曲酵母菌分为扣囊覆膜酵母和其余酵母(酿酒酵母和生香酵母)两类进行分析[7-8],见表3和图1。

表3 牛栏山大曲微生物数量统计
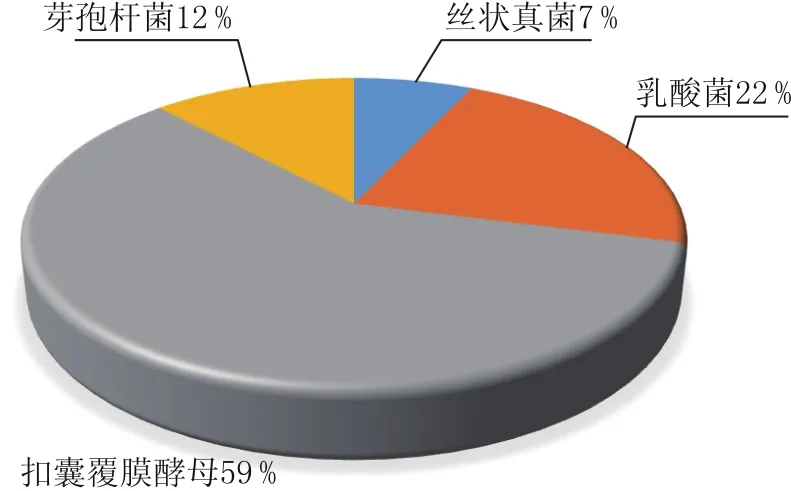
图1 牛栏山二锅头大曲菌系分布情况
由表3和图1可看出,在大曲微生物组成中,扣囊覆膜酵母可占大曲微生物总数的59%,是大曲中最多的微生物,乳酸菌和芽孢杆菌属于细菌类微生物,分别占大曲微生物总数的22%和12%,丝状真菌可占大曲微生物总数7%,其余酵母和放线菌虽然能够分离出来,但数量相对较少。
2.2 大曲微生物多样性
2.2.1 酵母菌多样性(表4)

表4 大曲酵母菌种类
大曲中酵母菌主要以扣囊覆膜酵母为主,而除扣囊覆膜酵母外,大曲中还存在一些其余酵母(生香酵母及酿酒酵母),这些酵母在大曲中含量较低,只能在10-3或10-4梯度才能够分离到。
如表4所示,本研究从大曲中共分离出101株酵母菌(由于扣囊覆膜酵母可用肉眼鉴定,故未进行挑菌及分子鉴定),分别为东方伊萨酵母、异常汉逊酵母、弗比恩毕赤酵母和酿酒酵母。其中东方伊萨酵母数量较多,为55株,其次为异常汉逊酵母,弗比恩毕赤酵母和酿酒酵母数量较少。
2.2.2 丝状真菌多样性(表5)
本研究从大曲中共分离丝状真菌41株,其中常温丝状真菌36株,耐高温丝状真菌5株。
如表5所示,常温丝状真菌主要由4种组成,分别为分支横梗霉、微小根毛霉、产黄青霉、伞枝横梗霉,其中分支横梗霉数量较多,是大曲中主要常温丝状真菌,其次是微小根毛霉及伞枝横梗霉,产黄青霉数量较少,而耐高温丝状真菌中只分离到嗜热子囊菌一种耐高温丝状真菌。
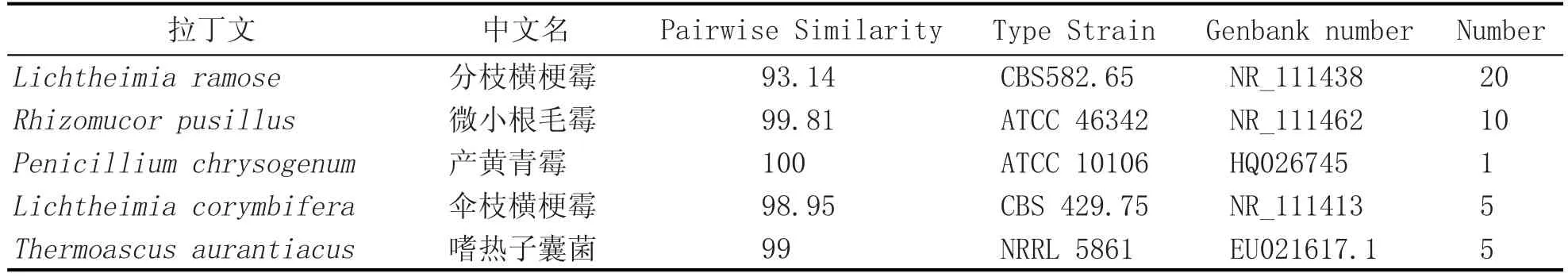
表5 大曲丝状真菌种类
2.2.3 芽孢杆菌多样性(表6)

表6 大曲芽孢杆菌种类
如表6所示,牛栏山大曲中共分离到119株芽孢杆菌,分为7个种,其中地衣芽孢杆菌和沙福芽孢杆菌为主要芽孢杆菌,分离数量分别为85株和20株,而其余芽孢杆菌数量相对较少。
2.2.4 乳酸菌(表7)
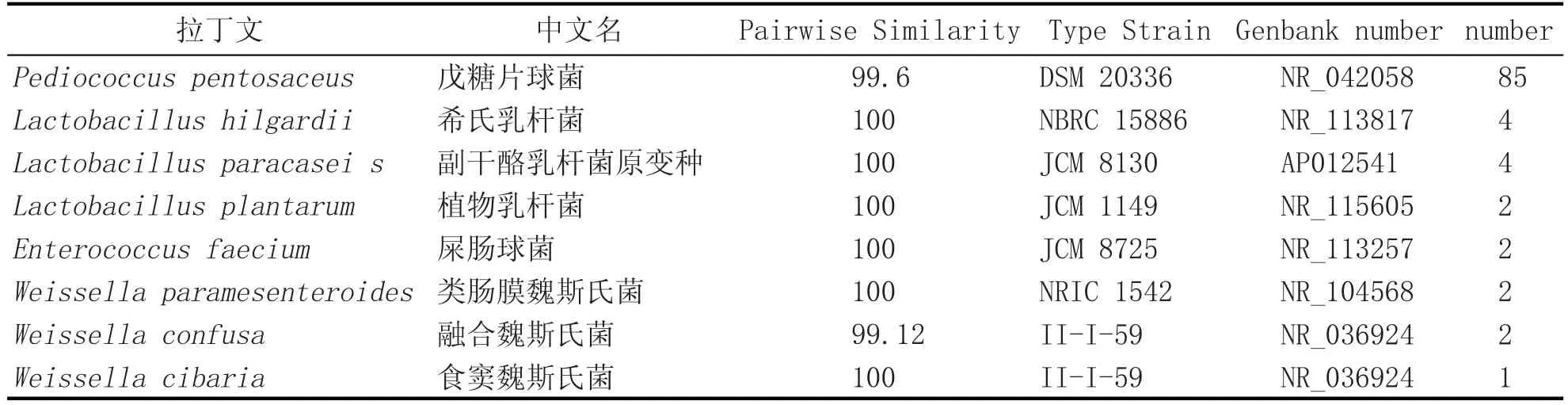
表7 大曲乳酸菌种类
牛栏山大曲中乳酸菌优势较为明显,见表7。如表7所示,从牛栏山大曲中共分离到102株乳酸菌,由8种组成,其中戊糖片球菌数量较多,占85株,是牛栏山大曲中的主要乳酸菌,其余乳酸菌,如希氏乳酸菌、植物乳杆菌等所占数量较少。
2.2.5 放线菌(表8)

表8 大曲放线菌种类
放线菌是细菌家族中的一个独特的分支,因菌体呈放射线状生长而得名,如表8所示,大曲中共分离49株放线菌,种类较少,只分离到白色链霉菌和可可链霉菌两类链霉菌,数量较为接近,
3 结论
本研究利用传统分离方法结合PCR测序技术,从酵母菌、乳酸菌、芽孢杆菌、丝状真菌、放线菌5个方面入手,系统分析了牛栏山大曲微生物的群落组成及多样性。
结果表明,扣囊覆膜酵母是牛栏山大曲的主要微生物,可占大曲整体微生物数量的59%,芽孢杆菌和乳酸菌同属于细菌类,可占整体微生物的34%,丝状真菌数量较少可占7%,放线菌、生香酵母、酿酒酵母虽然能够分离到,但数量相对较少。
在微生物多样性方面,共从牛栏山大曲中获得27种微生物,在真菌方面,酵母菌除主体扣囊覆膜酵母外,还分离到了4种酵母菌,主要以东方伊萨酵母和异常汉逊酵母为主,酿酒酵母数量较少;丝状真菌共分离到5种,主要为分支横梗霉、微小根毛霉,同时分离到少量嗜热真菌——嗜热子囊菌;细菌方面乳酸菌、芽孢杆菌和放线菌共分离出17种微生物,虽然种类较多,但主体较为明显,其中地衣芽孢杆菌、沙福芽孢杆菌,戊糖片球菌,白色链霉菌和可可链霉菌分别为芽孢杆菌、乳酸菌和放线菌的主体微生物,占据明显的数量优势。
大曲作为白酒酿造的主要菌群来源,在白酒酿造过程中具有重要作用,系统研究大曲微生物的数量关系和微生物多样性,有助于解析白酒酿造微生物的变化规律,同时也为今后菌剂的选取和添加提供指导作用。
[1]胡佳音,周森,赵卫鹏,等.清、浓、酱三种大曲真菌多样性初步分析[J].酿酒科技,2016(8):87-90.
[2]沈婷.检测白酒的质量[J].中小企业管理与科技,2014(4):306-307.
[3]徐占成.中国名酒剑南春的独特酒体风味质量及经典工艺特色[J].酿酒科技,2010(11):53-56.
[4]万自然.大曲培养过程中微生物及酶的变化[J].酿酒科技,2004(4):25-26.
[5]明红梅,周建,朱莉莉,等.大曲传统质量指标体系与新指标体系的对比研究[J].酿酒科技,2015(4):32-36.
[6]王广峰.清香型大曲工艺特点及其质量改进[J].酿酒,2011,38(2):60-61.
[7]陈倩.民间酵面及相关基物中酿酒酵母菌的遗传多样性和群体分化研究[D].哈尔滨:黑龙江大学,2012.
[8]魏金旺.浅谈牛栏山二锅头酒生产中的微生物[J].中国酿造,2017,36(4):1-5.

