2-三氟甲基-2,3-二氢-1,3,4-噁二唑衍生物的合成
黄丹凤,张兴虎,王克虎,苏瀛鹏,胡雨来
(西北师范大学 化学化工学院,甘肃省高分子材料重点实验室,甘肃 兰州 730070)
1,3,4-噁二唑化合物是一类非天然存在的五元芳杂环化合物,由于其显著的药物和生理活性以及引人注目的光物理性质,被广泛应用于药物化学[1-3]和材料科学[4]中.作为1,3,4-噁二唑化合物的重要衍生物,3-乙酰基-2,3-二氢-1,3,4-噁二唑化合物也表现出很好的生物活性,具有抗细菌、抗肿瘤、抗结核、抗氧化和抑制单胺酶氧化[5]以及免疫抑制活性[6]等性质.这类化合物一般是在乙酰氯或乙酸酐中,通过酰腙的酰化和分子内环化而得到[7].另一方面,将含氟基团引入到有机物分子中可以极大地改变有机物的亲油性、代谢稳定性和生物活性[8].其中,含三氟甲基的杂环化合物在医药、农药和材料科学中具有重要作用[9].一般说来,向杂环化合物分子中引入三氟甲基基团的方法主要有杂环化合物的直接三氟甲基化[10]和三氟甲基合成砌块的环化法[11].
本小组在氟化学研究中发现[12-13],三氟甲基酰腙非常稳定,可以通过价廉易得的三氟乙醛甲基半缩醛或三氟甲基酮和N-酰肼反应而制备.据此,可以发展一种以三氟甲基酰腙作为三氟甲基合成砌块来构建三氟甲基化合物,特别是含三氟甲基的杂环化合物[14].目前,由三氟乙醛甲基半缩醛得到的三氟甲基醛酰腙已被成功用于合成含三氟甲基的杂环化合物,如1,3-噻二唑酮[15]、1,3,4-噁二唑啉[15]、1,2,4-三唑啉[16]、1,2,3-噻二唑啉[17]和1,2,4,5-四嗪[18]等.但是,以三氟甲基酮酰腙作为三氟甲基合成砌块,构筑含三氟甲基的杂环化合物的研究报道较少.文中报道以三氟甲基酮和N-酰肼生成的三氟甲基酮酰腙为原料,在乙酸酐作用下,合成2-三氟甲基-3-乙酰基-2,3-二氢-1,3,4-噁二唑化合物的反应(图1).通过该反应得到了一系列新的2,5-二取代的2-三氟甲基-3-乙酰基-2,3-二氢-1,3,4-噁二唑衍生物,为进一步研究此类化合物的生物和药理活性奠定了基础.
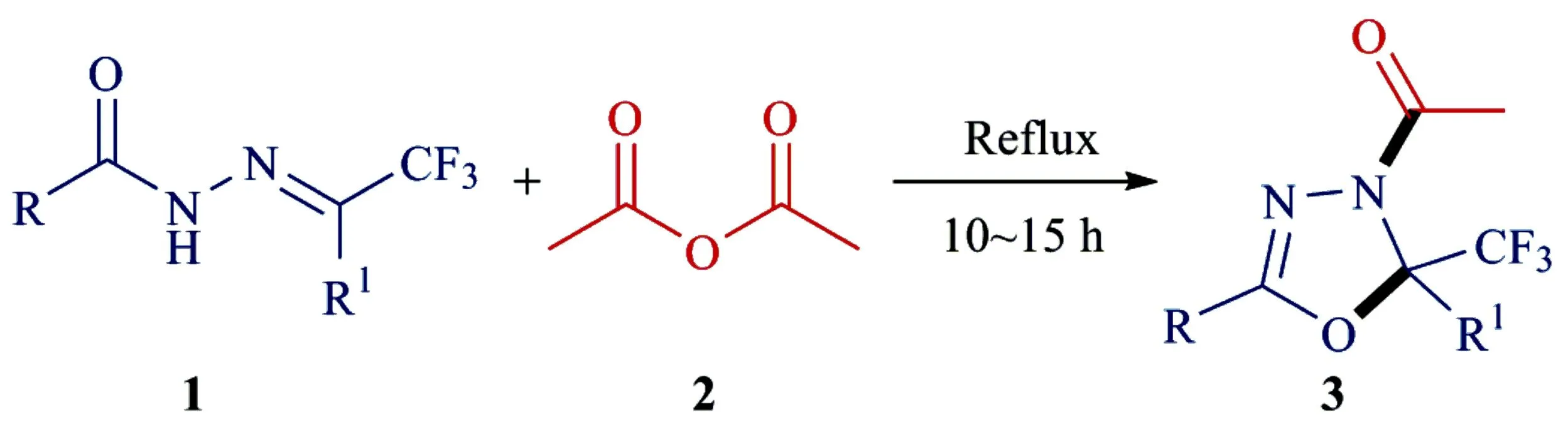
图1 三氟甲基取代的3-乙酰基-2,3-二氢-1,3,4-噁二唑衍生物的合成
1 实验部分
1.1 仪器和试剂
核磁共振谱用Varian Mercury 400 Plus或Agilent DD 2600型核磁共振仪测定,以氘代氯仿为溶剂,TMS为内标;高分辨质谱用Bruker APEX Ⅱ傅里叶变换离子回旋共振质谱仪,ESI源;熔点测定用显微熔点测定仪测定.
所用试剂均为国产分析纯,石油醚、乙酸乙酯为重蒸的工业级试剂.以下叙述中石油醚以PE表示,乙酸乙酯以EA表示.
1.2 实验步骤
2-三氟甲基-3-乙酰基-2,3-二氢-1,3,4-噁二唑类化合物3的合成.在25 mL圆底烧瓶中,依次加入三氟甲基酮酰腙(1a,0.088 mg,0.3 mmol)和过量的乙酸酐(2 mL),在回流条件下搅拌反应.薄层色谱检测反应完全后,用饱和碳酸氢钠溶液将混合物调至中性,再加入大量的冰水,快速搅拌,直到有固体出现,抽滤得到固体.将固体溶解在乙酸乙酯中,用无水硫酸镁干燥,蒸去溶剂后,进行柱层析分离得目标产物3a.化合物3b~3s的合成同3a.化合物3的表征数据如下.
2,5-二苯基-2-三氟甲基-3-乙酰基-2,3-二氢-1,3,4-噁二唑(3a).白色固体,90 mg,产率90%,m.p.73~77 ℃;1HNMR(400 MHz,CDCl3)δ: 7.91~7.87(m,2H),7.69~7.67(m,2H),7.52(t,J=7.6 Hz,1H),7.47~7.39(m,5H),2.39(s,3H);13CNMR(150 MHz,CDCl3)δ: 167.6,153.3,132.1,131.6,130.5,128.8,128.6,127.0,126.9,123.3,122.3(q,JC-F=288.8 Hz),97.8(q,JC-F=33.8 Hz),22.9;19FNMR(376 MHz,CDCl3)δ: -80.6(s); HRMS(ESI)m/z: C17H14F3N2O2[M+H]+理论值335.100 2,实测值335.099 9.
2-苯基-5-(4-甲氧基苯基)-2-三氟甲基-3-乙酰基-2,3-二氢-1,3,4-噁二唑(3b).白色固体,97 mg,产率89%,m.p.90~93 ℃;1HNMR(600 MHz,CDCl3)δ: 7.83(d,J=9.0 Hz,2H),7.68~7.67(m,2H),7.46~7.41(m,3H),6.96(d,J=9.0 Hz,2H),3.87(s,3H),2.38(s,3H);13CNMR(150 MHz,CDCl3)δ: 167.4,162.6,153.3,131.7,130.4,128.8,128.5,126.9,122.3(q,JC-F=289.0 Hz),115.5,114.3,97.5(q,JC-F=33.6 Hz),55.5,23.0;19FNMR(376 MHz,CDCl3)δ: -75.4(s); HRMS(ESI)m/z: C18H15F3N2O3Na[M+Na]+理论值387.092 7,实测值387.092 2.
2-苯基-5-(4-甲苯基)-2-三氟甲基-3-乙酰基-2,3-二氢-1,3,4-噁二唑(3c).白色固体,90 mg,产率87%,m.p.74~76 ℃;1HNMR(600 MHz,CDCl3)δ: 7.78(d,J=8.4 Hz,2H),7.68(d,J=7.8 Hz,2H),7.50~7.41(m,3H),7.27(d,J=7.8 Hz,2H),2.42(s,3H),2.39(s,3H);13CNMR(150 MHz,CDCl3)δ: 167.5,153.4,142.7,131.7,130.4,129.5,128.5,127.0,126.8,122.3(q,JC-F=288.6 Hz),120.4,97.6(q,JC-F=31.8 Hz),22.9,21.7;19FNMR(376 MHz,CDCl3)δ: -75.5(s); HRMS(ESI)m/z: C18H16F3N2O2[M+H]+理论值349.115 8,实测值349.115 6.
2-苯基-5-(3-甲苯基)-2-三氟甲基-3-乙酰基-2,3-二氢-1,3,4-噁二唑(3d).无色油状液体,73 mg,产率70%;1HNMR(600 MHz,CDCl3)δ: 7.71(s,2H),7.68~7.65(m,2H),7.46~7.42(m,3H),7.37~7.34(m,2H),2.41(s,3H),2.39(s,3H);13CNMR(150 MHz,CDCl3)δ: 167.5,153.4,138.7,132.9,131.6,130.4,128.7,128.6,127.5,126.9,124.2,123.2,122.2(q,JC-F=288.6 Hz),97.9(q,JC-F=40.0 Hz),22.9,21.3;19FNMR(376 MHz,CDCl3)δ: -75.4(s); HRMS(ESI)m/z: C18H15F3N2O2Na[M+Na]+理论值371.097 8,实测值371.097 4.
2-苯基-5-(2-甲苯基)-2-三氟甲基-3-乙酰基-2,3-二氢-1,3,4-噁二唑(3e).无色油状液体,67 mg,产率65%;1HNMR(600 MHz,CDCl3)δ: 7.84(d,J=7.8 Hz,1H),7.70~7.69(m,2H),7.47~7.40(m,4H),7.33~7.25(m,2H),2.64(s,3H),2.39(s,3H);13CNMR(150 MHz,CDCl3)δ: 167.6,153.2,138.9,131.7,131.6,131.5,130.4,128.9,128.6,126.9,126.1,122.7(q,JC-F=288.8 Hz),122.1,96.6(q,JC-F=34.0 Hz),23.0,22.3;19FNMR(376 MHz,CDCl3)δ: -75.5(s); HRMS(ESI)m/z: C18H15F3N2O2Na[M+Na]+理论值371.097 8,实测值371.097 1.
2-苯基-5-(4-氟苯基)-2-三氟甲基-3-乙酰基-2,3-二氢-1,3,4-噁二唑(3f).白色固体,79 mg,产率75%,m.p.72~74 ℃;1HNMR(600 MHz,CDCl3)δ: 7.91~7.89(m,2H),7.67(d,J=7.2 Hz,2H),7.47~7.43(m,3H),7.16(t,J=8.4 Hz,2H),2.39(s,3H);13CNMR(150 MHz,CDCl3)δ: 167.5,165.0(d,JC-F=252.6 Hz),152.5,131.5,130.5,129.3(d,JC-F=8.8 Hz),128.6,126.9,122.2(q,JC-F=288.6 Hz),119.5(d,JC-F=3.0 Hz),116.2(d,JC-F=22.4 Hz),98.0(q,JC-F=33.4 Hz),22.9;19FNMR(376 MHz,CDCl3)δ:-75.4(s),-106.4(s); HRMS(ESI)m/z:C17H12F4N2O2Na[M+Na]+理论值375.072 7,实测值375.072 5.
2-苯基-5-(4-氯苯基)-2-三氟甲基-3-乙酰基-2,3-二氢-1,3,4-噁二唑(3g).白色固体,65 mg,产率59%,m.p.103~105 ℃;1HNMR(600 MHz,CDCl3)δ: 7.83(d,J=8.4 Hz,2H),7.66(d,J=7.2 Hz,2H),7.48~7.43(m,5H),2.39(s,3H);13CNMR(150 MHz,CDCl3)δ: 167.5,152.5,138.3,131.4,130.6,129.2,128.6,128.3,126.8,122.2(q,JC-F=288.6 Hz),121.8,98.0(q,JC-F=40.0 Hz),22.9;19FNMR(376 MHz,CDCl3)δ:-75.4(s); HRMS(ESI)m/z: C17H12ClF3N2O2Na [M+Na]+理论值391.043 2,实测值391.042 6.
2-苯基-5-(4-溴苯基)-2-三氟甲基-3-乙酰基-2,3-二氢-1,3,4-噁二唑(3h).白色固体,76 mg,产率62%,m.p.110~111 ℃;1HNMR(400 MHz,CDCl3)δ: 7.77~7.74(m,2H),7.67~7.65(m,2H),7.62(t,J=2.0 Hz,1H),7.60~7.59(m,1H),7.48~7.41(m,3H),2.39(s,3H);13CNMR(150 MHz,CDCl3)δ: 167.5,152.6,132.2,131.4,130.6,128.6,128.4,126.9,126.8,122.2(q,JC-F=288.8 Hz),122.2,98.1(q,JC-F=34.0 Hz),22.9;19FNMR(376 MHz,CDCl3)δ: -75.4(s); HRMS(ESI)m/z: C17H13BrF3N2O2[M+H]+理论值413.010 7,实测值413.011 0.
2-苯基-5-(4-硝基苯基)-2-三氟甲基-3-乙酰基-2,3-二氢-1,3,4-噁二唑(3i).白色固体,22 mg,产率20%,m.p.109~112 ℃;1HNMR(600 MHz,CDCl3)δ: 8.33(d,J=9.0 Hz,2H),8.08(d,J=9.0 Hz,2H),7.66(d,J=7.2 Hz,2H),7.50~7.45(m,3H),2.43(s,3H);13CNMR(150 MHz,CDCl3)δ: 167.6,151.4,149.7,131.0,130.8,129.1,128.7,127.9,126.8,124.1,122.1(q,JC-F=288.6 Hz),98.7(q,JC-F=34.2 Hz),22.9;19FNMR(376 MHz,CDCl3)δ: -75.3(s); HRMS(ESI)m/z: C17H12F3N3O4Na[M+Na]+理论值402.067 2,实测值402.066 6.
2-苯基-5-(2-呋喃基)-2-三氟甲基-3-乙酰基-2,3-二氢-1,3,4-噁二唑(3j).无色油状液体,63 mg,产率65%;1HNMR(600 MHz,CDCl3)δ: 7.66~7.63(m,3H),7.47~7.43(m,3H),7.04(d,J=3.6 Hz,1H),6.57~6.56(m,1H),2.39(s,3H);13CNMR(150 MHz,CDCl3)δ: 167.5,146.4,146.3,138.5,131.2,130.6,128.6,126.8,122.1(q,JC-F=288.6 Hz),115.5,112.0,98.7(q,JC-F=34.0 Hz),22.9;19FNMR(376 MHz,CDCl3)δ: -80.0(s); HRMS(ESI)m/z: C15H12F3N2O3[M+H]+理论值325.079 5,实测值325.080 1.
2-(4-甲苯基)-5-苯基-2-三氟甲基-3-乙酰基-2,3-二氢-1,3,4-噁二唑(3k).无色油状液体,67 mg,产率65%;1HNMR(600 MHz,CDCl3)δ: 7.90(d,J=8.4 Hz,2H),7.56~7.52(m,3H),7.48~7.45(m,2H),7.26~7.23(m,2H),2.39(s,3H),2.37(s,3H);13CNMR(150 MHz,CDCl3)δ: 167.5,153.3,140.7,132.0,129.3,128.8,128.6,127.0,126.8,123.4,122.3(q,JC-F=288.8 Hz),97.7(q,JC-F=43.2 Hz),22.9,21.2;19FNMR(376 MHz,CDCl3)δ: -80.3(s); HRMS(ESI)m/z:C18H16F3N2O2[M+H]+理论值349.115 8,实测值349.116 6.
2-(3-甲苯基)-5-苯基2-三氟甲基-3-乙酰基-2,3-二氢-1,3,4-噁二唑(3l).白色固体,62 mg,产率60%,m.p.66~68 ℃;1HNMR(600 MHz,CDCl3)δ: 7.90(d,J=8.4 Hz,2H),7.52(t,J=7.8 Hz,1H),7.48~7.44(m,4H),7.32(t,J=7.8 Hz,1H),7.26~7.23(m,1H),2.40(s,3H),2.38(s,3H);13CNMR(150 MHz,CDCl3)δ: 167.5,153.3,138.4,132.0,131.5,131.3,128.8,128.5,127.3,127.0,124.0,123.4,122.3(q,JC-F=288.0 Hz),97.9(q,JC-F=33.4 Hz),22.9,21.6;19FNMR(376 MHz,CDCl3)δ: -75.3(s); HRMS(ESI)m/z: C18H16F3N2O2[M+H]+理论值349.115 8,实测值349.115 4.
2-(4-甲氧基苯基)-5-苯基-2-三氟甲基-3-乙酰基-2,3-二氢-1,3,4-噁二唑(3m).白色固体,65 mg,产率60%,m.p.105~107 ℃;1HNMR(600 MHz,CDCl3)δ: 7.89(d,J=7.2 Hz,2H),7.61(d,J=8.4 Hz,2H),7.53(t,J=7.8 Hz,1H),7.46(t,J=7.8 Hz,2H),6.94(d,J=9.0 Hz,2H),3.81(s,3H),2.39(s,3H);13CNMR(150 MHz,CDCl3)δ: 167.6,161.0,153.2,132.0,128.8,128.5,128.4,127.0,123.4,122.3(q,JC-F=288.6 Hz),113.9,97.8(q,JC-F=40.0 Hz),55.3,23.0;19FNMR(376 MHz,CDCl3)δ: -75.7(s); HRMS(ESI)m/z: C18H16F3N2O3[M+H]+理论值365.110 8,实测值365.110 6.
2-(3-氯苯基)-5-苯基-2-三氟甲基-3-乙酰基-2,3-二氢-1,3,4-噁二唑(3n).无色油状液体,80 mg,产率73%;1HNMR(600 MHz,CDCl3)δ: 7.90(d,J=7.2 Hz,2H),7.64~7.61(m,2H),7.57~7.54(m,1H),7.48(t,J=7.8 Hz,2H),7.44~7.42(m,1H),7.38(t,J=7.8 Hz,1H),2.40(s,3H);13CNMR(150 MHz,CDCl3)δ: 167.6,153.2,134.7,133.5,132.2,130.7,129.8,128.9,127.2,127.0,125.4,123.0,122.0(q,JC-F=290.2 Hz),97.1(q,JC-F=34.0 Hz),22.9;19FNMR(376 MHz,CDCl3)δ: -76.4(s); HRMS(ESI)m/z: C17H13ClF3N2O2[M+H]+理论值369.061 2,实测值369.060 9.
2-(4-溴苯基)-5-苯基-2-三氟甲基-3-乙酰基-2,3-二氢-1,3,4-噁二唑(3o).无色油状液体,97 mg,产率78%;1HNMR(600 MHz,CDCl3)δ: 7.89(d,J=7.8 Hz,2H),7.59~7.54(m,5H),7.48(t,J=7.8 Hz,2H),2.39(s,3H);13CNMR(150 MHz,CDCl3)δ: 167.6,153.2,132.3,132.2,131.8,128.9,128.7,127.0,125.1,124.0(q,JC-F=288.6 Hz),123.0,96.5(q,JC-F=31.8 Hz),22.9;19FNMR(376 MHz,CDCl3)δ: -80.5(s); HRMS(ESI)m/z: C17H13BrF3N2O2[M+H]+理论值413.010 7,实测值413.011 7.
2-(2-萘基)-5-苯基-2-三氟甲基-3-乙酰基-2,3-二氢-1,3,4-噁二唑(3p).白色固体,69 mg,产率60%,m.p.77~79 ℃;1HNMR(600 MHz,CDCl3)δ: 8.19(s,1H),7.93(d,J=7.2 Hz,2H),9.91~7.88(m,2H),7.84(d,J=7.8 Hz,1H),7.69(d,J=8.4 Hz,1H),7.56~7.51(m,3H),7.49~7.47(m,2H),2.42(s,3H);13CNMR(150 MHz,CDCl3)δ: 167.6,153.4,133.9,132.4,132.1,129.0,128.9,128.7,128.6,127.6,127.5,127.3,127.1,126.7,123.3,123.2,122.3(q,J=277.8 Hz),98.0(q,J=35.0 Hz),23.0;19FNMR(376 MHz,CDCl3)δ: -75.2(s); HRMS(ESI)m/z: C21H16F3N2O2[M+H]+理论值385.115 8,实测值385.115 6.
2-对甲苯基-5-(4-溴苯基)-2-三氟甲基-3-乙酰基-2,3-二氢-1,3,4-噁二唑(3q).白色固体,95.9 mg,产率75%,m.p.123~125 ℃;1HNMR(600 MHz,CDCl3)δ: 7.75(d,J=8.4 Hz,2H),7.60(d,J=8.4 Hz,2H),7.53(d,J=8.4 Hz,2H),7.24(d,J=7.8 Hz,2H),2.38(s,3H),2.37(s,3H);13CNMR(150 MHz,CDCl3)δ: 167.5,152.6,140.8,132.2,129.3,128.4,126.8,126.7,126.7,122.3,122.2(q,JC-F=288.8 Hz),98.1(q,JC-F=33.8 Hz),22.9,21.2;19FNMR(376 MHz,CDCl3)δ: -76.4(s); HRMS(ESI)m/z: C18H15BrF3N2O2[M+H]+理论值427.026 4,实测值427.025 8.
2-(4-甲氧基苯基)-5-(4-甲苯基)-2-三氟甲基-3-乙酰基-2,3-二氢-1,3,4-噁二唑(3r).无色油状液体,85 mg,产率75%;1HNMR(600 MHz,CDCl3)δ: 7.78(d,J=7.8 Hz,2H),7.60(d,J=9.0 Hz,2H),7.27(d,J=7.8 Hz,2H),6.93(d,J=9.0 Hz,2H),3.82(s,3H),2.42(s,3H),2.38(s,3H);13CNMR(150 MHz,CDCl3)δ: 167.5,160.9,153.4,142.6,129.5,128.5,127.0,123.5,122.3(q,J=288.8 Hz),120.5,113.9,96.4(q,J=38.2 Hz),55.3,23.0,21.7;19FNMR(376 MHz,CDCl3)δ: -75.7(s); HRMS(ESI)m/z: C19H18F3N2O3[M+H]+理论值379.126 4,实测值379.126 2.
2-(3,5-二氯苯基)-5-(3-甲苯基)-2-三氟甲基-3-乙酰基-2,3-二氢-1,3,4-噁二唑(3s).无色油状液体,28 mg,产率23%;1HNMR(600 MHz,CDCl3)δ: 7.70(s,2H),7.58~7.56(m,2H),7.45(t,J=1.8 Hz,1H),7.38~7.37(m,2H),2.43(s,3H),2.41(s,3H);13CNMR(150 MHz,CDCl3)δ: 167.7,153.4,138.9,135.4,134.7,133.2,130.7,128.9,127.5,125.8,124.3,122.6,121.8(q,JC-F=289.0 Hz),96.4(q,JC-F=34.4 Hz),22.9,21.3;19FNMR(376 MHz,CDCl3)δ: -76.5(s); HRMS(ESI)m/z: C18H14Cl2F3N2O2[M+H]+理论值417.037 9,实测值417.037 4.
2 结果与讨论
2.1 2-三氟甲基-3-乙酰基-2,3-二氢-1,3,4-噁二唑的合成
首先尝试了2,2,2-三氟苯乙酮和苯甲酰肼形成的酰腙和乙酸酐的反应,回流反应10 h后,以90%的产率得到了目标产物3a.然后,又尝试了其他三氟基酮酰腙和乙酸酐的反应,具体结果见表1.由表1可知,2,2,2-三氟苯乙酮和大多数芳香酰肼、杂环芳香酰肼生成的三氟甲基酮酰腙,都能与乙酸酐发生反应,生成2-三氟甲基-3-乙酰基-2,3-二氢-1,3,4-噁二唑衍生物(序号 1~12).对于芳香酰肼来说:① 苯环上连有供电子基团的酰肼形成的酰腙都比连有吸电子基团的反应活性高(序号 2~5,6~11).例如,4-甲氧基苯甲酰肼形成的酰腙为底物反应时,3b的产率可达89%;而4-氯苯甲酰肼形成的酰腙反应时,3g的产率只有59%.② 取代基在苯环上的位置对反应的产率也有影响,无论取代基的性质如何,对位取代的酰肼形成的酰腙都比邻位和间位的反应活性高(序号 3~5,6,7).例如,4-甲基苯甲酰肼形成的酰腙反应时,3c产率为87%,而3-甲基苯甲酰肼和2-甲基苯甲酰肼形成的酰腙反应时,3d和3e的反应产率分别降为70%和65%(序号 3~5).对于脂肪酰肼,如乙酰肼、特戊酰肼和环己基甲酰肼形成的酰腙作为底物反应时,没有得到目标产物[13](序号 13~15).产生这种结果的原因可能有两点:a)脂肪酰肼形成的酰腙不如芳香酰肼形成的酰腙稳定;b)脂肪族烃基不利于反应过程中产生的三氟甲基亚胺正离子中间体4的稳定性.③ 考察了苯甲酰肼和各种三氟甲基酮形成的酰腙的反应.结果表明,苯环上连有吸电子基团的比连有供电子基团的2,2,2-三氟苯乙酮与苯甲酰肼形成的酰腙反应活性高(序号 16~20).例如,1-(4-甲氧苯基)-2,2,2-三氟乙基酮形成的酰腙反应时,3m的产率为60%;而1-(4-溴苯基)-2,2,2-三氟乙基酮形成的酰腙反应时,3o的产率为78%(序号 18,20).此外,1-(2-萘基)-2,2,2-三氟乙酮形成的酰腙反应都能顺利进行,产率良好(序号 21).令人遗憾的是,脂肪族的三氟甲基酮,如1,1,1-三氟-2-戊酮和苯甲酰肼形成的酰腙也不能发生反应(序号 22),这可能是由于烷基不如芳基更能稳定亚胺正离子中间体4的缘故.④ 尝试了取代的苯甲酰肼和取代的三氟甲基苯乙酮形成的酰腙的反应(序号 23,24).由表1可知,反应都能顺利进行,产率良好.但是,1-(3,5-二氯苯基)-2,2,2-三氟乙酮形成的酰腙反应活性低,产物产率只有23%(序号 25).
2.2 反应机理
在文献[7]报道的基础上,认为该反应的机理如下(图2):① 三氟甲基酮酰腙1和乙酸酐发生酰化反应生成亚胺正离子中间体4;② 中间体4发生环化反应得到产物3,同时生成一分子乙酸.
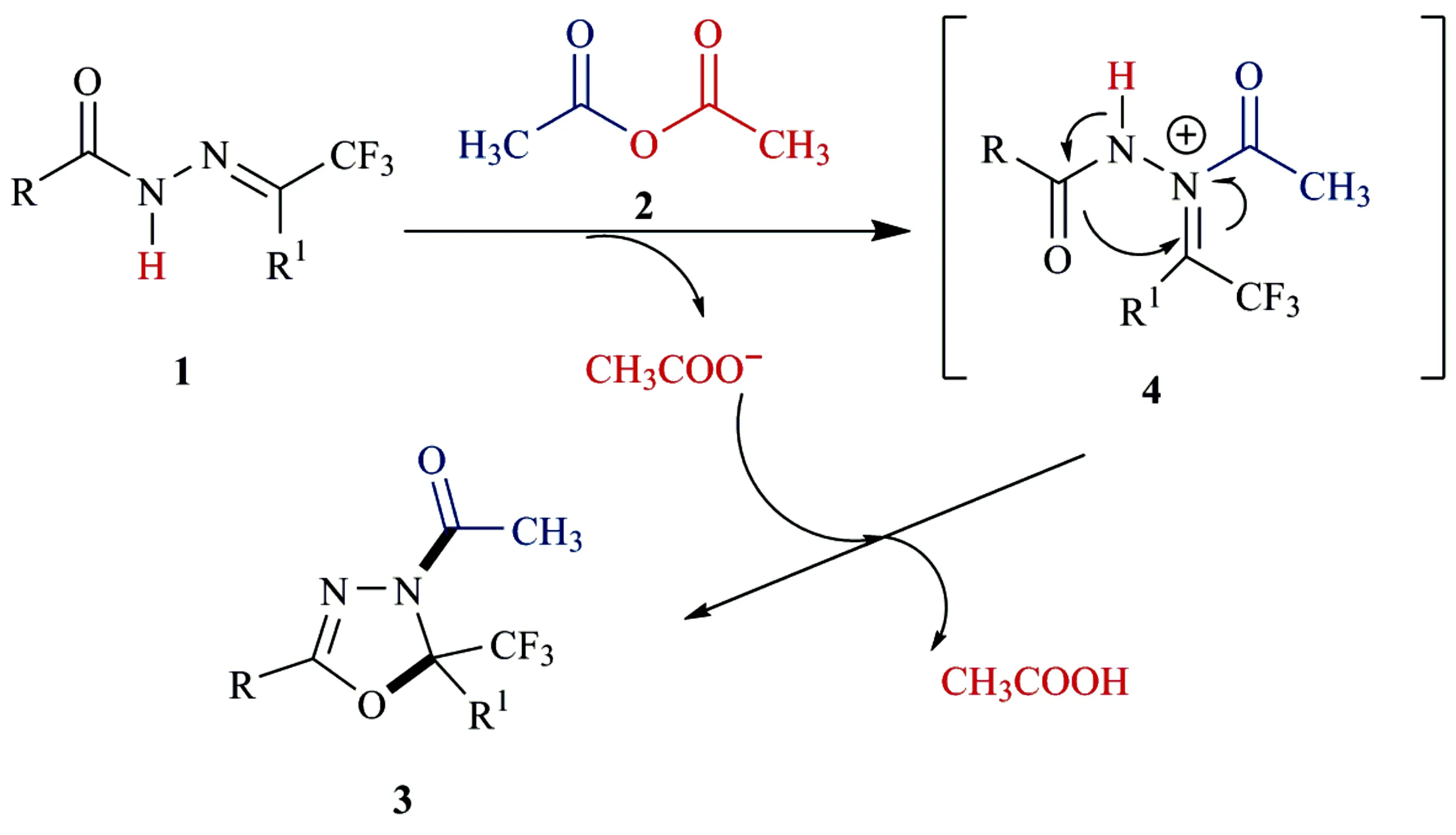
图2 反应机理
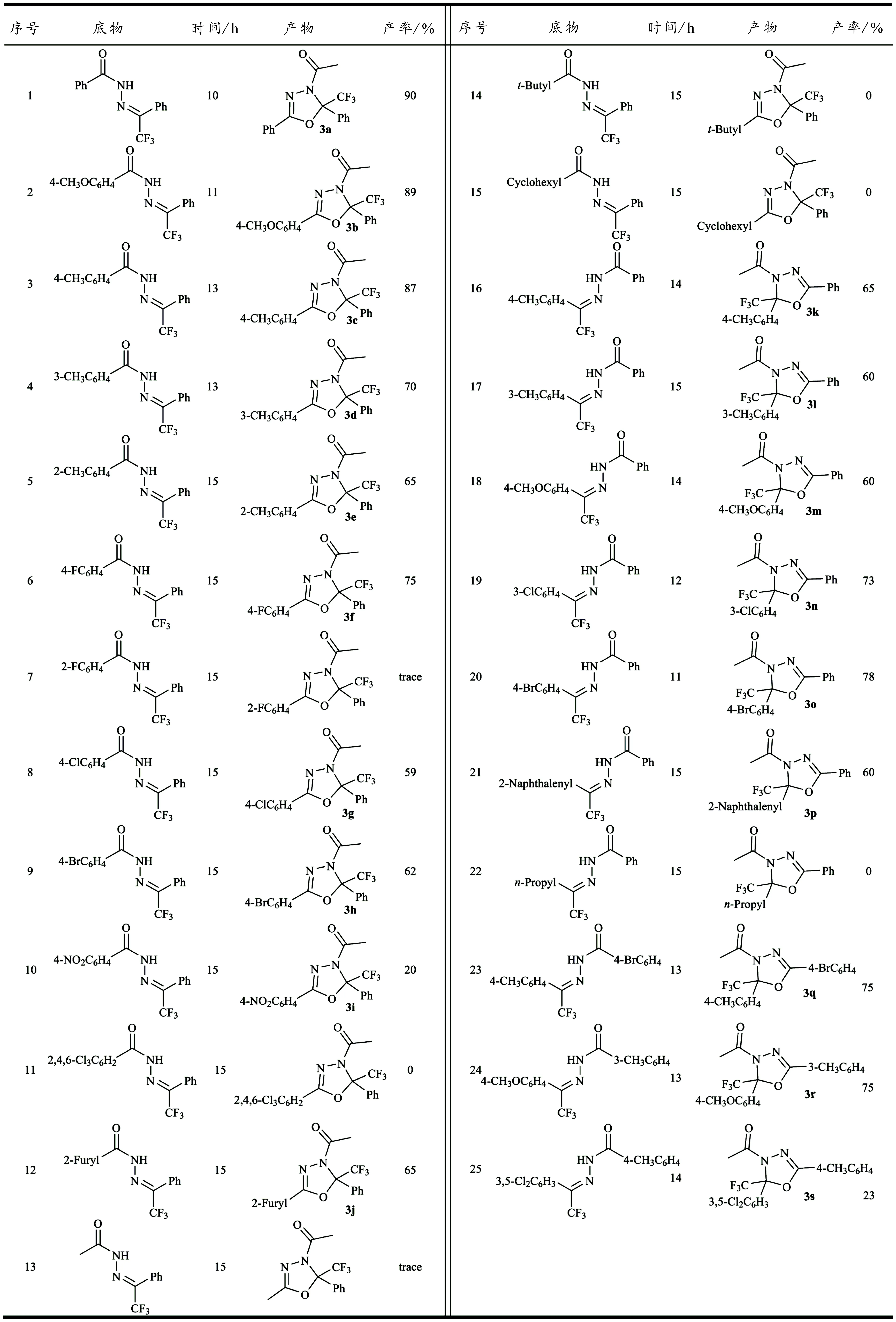
a反应条件:1a(0.3 mmol),乙酸酐2(2 mL);b反应温度:130 ℃.
3 结束语
用廉价易得的三氟甲基酮酰腙作为三氟甲基合成砌块,在无催化剂条件下,通过三氟甲基酮酰腙和乙酸酐的酰化环化反应,合成了一系列的2-三氟甲基-3-乙酰基-2,3-二氢-1,3,4-噁二唑衍生物.该方法具有反应步骤短、产率高、操作简单等特点,为三氟甲基取代1,3,4-噁二唑化合物的合成提供了一种简单、高效的方法.
参考文献:
[1] NIEDDU V,PINNA G,MARCHESI I,et al.Synthesis and antineoplastic evaluation of novel unsymmetrical 1,3,4-oxadiazoles[J].JMedChem,2016,59(23):10451.
[2] 崔紫宁,杨琳,李希晨,等.2,5-二取代-1,3,4-噁二唑类化合物的合成及其昆虫生长调节活性的研究进展[J].有机化学,2006,26(12):1647.
[3] 李政,石景宏,杨靖亚.三组分一锅法合成2-(3,5-二芳基-4,5-二氢吡唑-1-基)-5-苯基-1,3,4-噁二唑[J].西北师范大学学报(自然科学版),2012,48(5):67.
[4] CHEN H,LIU Z,ZHAO Z,et al.Synthesis,structural characterization,and field-effect transistor properties of n-channel semiconducting polymers containing five-membered heterocyclic acceptors:superiority of thiadiazole compared with oxadiazole[J].ACSApplMaterInterfaces,2016,8(48):33051.
[5] EL SADEK M M,ABD EL-DAYEM N S,HASSAN S Y,et al.Antioxidant and antitumor activities of new synthesized aromatic C-nucleoside Derivatives[J].Molecules,2014,19(4):5163.
[6] YAN R,ZHANG Z M,FANG X Y,et al.Synthesis,molecular docking and biological evaluation of 1,3,4-oxadiazole derivatives as potential immunosuppressive agents[J].BioorgMedChem,2012,20(4):1373.
[7] ROLLAS S,KARAAKUS S.The synthesis and biological activities of 3-acyl-2,3-dihydro-1,3,4-oxadiazole/3-acyl-1,3,4-oxadiazoline derivatives obtained from hydrazide-hydrazones[J].MarmaraPharmJ,2012,16:120.
[8] ZHOU Y,WANG J,GU Z,et al.Next generation of fluorine-containing pharmaceuticals,compounds currently in phase Ⅱ-Ⅲ clinical trials of major pharmaceutical companies:new structural trends and therapeutic areas[J].ChemRev,2016,116(2):422.
[9] 李冬梅.含氟杂环化合物合成新进展[J].化工生产与技术,2009,16(5):4.
[10] NI C,HU M,HU J.Good partnership between sulfur and fluorine:sulfur-based fluorination and fluoroalkylation reagents for organic synthesis[J].ChemRev,2015,115(2):765.
[11] GUO R,ZHENG Y,MA J A.Electrophilic reaction of 2,2,2-trifluorodiazoethane with the in situ generated N-heterocyclic carbenes:access to N-aminoguanidines[J].OrgLett,2016,18(17):4170.
[12] 王克虎,王雅琳,殷雪娇,等.锡粉促进“一锅法”合成芳基三氟甲基取代高烯丙基酰肼类化合物[J].有机化学,2017,37(7):1764.
[13] 李军,杨天宇,黄丹凤,等.铟粉促进下“一锅法”合成三氟甲基高烯丙基酰肼化合物[J].有机化学,2017,37(4):925.
[14] PENG X,HUANG D,WANG K H,et al.Synthesis of trifluoromethylated pyrazolidines by [3+2]cycloaddition[J].OrgBiomolChem,2017,15(29):6214.
[15] MLOSTO G,URBANIAK K,JACASZEK N,et al.Exploration of fluoral hydrazones derived from carbohydrazides for the synthesis of trifluoromethylated heterocycles[J].Heterocycles,2014,88(1):387.
[16] PILGRAM K H,SKILES R D.Ring closures withα-chloroazines[J].JHeterocyclChem,1987,24(5):1265.
[17] PILGRAM K H,SKILES R D.Synthesis and ring-opening reactions of functionalized spiro-3-1,2,3-thiadiazoline 1-oxides and 1,1-dioxides:a new approach to unsymmetrically disubstitutedα-chloro azines[J].JOrgChem,1982,47(20):3865.
[18] PILGRAM K H,SKILES R D.Unsymmetrically 3,6-disubstituteds-tetrazines:synthesis of 3-aryl-6-(perfluoroalkyl)-1,2,4,5-tetrazines and 1,2-dihydro derivatives[J].JOrgChem,1976,41(21):3392.

