靶向Cyclin D1基因RNA干扰对肝癌细胞增殖和Mdm2等基因表达影响的研究*
张弘英,胡树根,胡利琳,丁 浩△
(1.南昌大学第二附属医院消化内科,南昌 330006;2.江西省南昌市新建区人民医院 330100; 3.南昌大学医学院,南昌330006)
细胞周期蛋白D1(Cyclin D1)是调控细胞周期G1期的关键蛋白之一,已被证明与包括肝癌在内的多种恶性肿瘤的发生、发展相关[1]。Mdm2和Mdm4在许多肿瘤中都存在着过度表达的现象[2]。肝细胞癌(hepatocellular carcinoma,HCC)因其恶性程度较高,预后差,被称为“癌中之王”[3],其在我国发病率和病死率均较高[4],然而针对HCC的治疗方法均不是很理想。本文研究靶向Cyclin D1基因RNA干扰对肝癌细胞增殖和Mdm2、Mdm4、P53和P21基因表达的影响。
1 材料与方法
1.1材料 人肝癌细胞株Hep3B由本研究组保存;培养基MEM和胎牛血清(美国Gibco);Cyclin D1-siRNA和NC-siRNA(上海吉凯),Cyclin D1-siRNA序列的抑制效果在本研究组以往实验中得到了证实;Trizol及脂质体LipofectamineTM(美国Invitrogen);2×Taq PCR MasterMix(北京天根生物);细胞活力检测试剂MTT(上海索莱宝生物);TUNEL凋亡原位检测试剂盒(上海生工生物工程);蛋白提取试剂盒(上海碧云天生物);逆转录试剂盒(大连宝生生物TaKaRa);引物(上海吉玛);Ⅰ抗Cyclin D1、Mdm2、Mdm4、P53、P21及β-actin(美国Santa Cruz);Ⅱ抗HRP-Goat anti Mouse IgG(北京中杉金桥)。
1.2方法
1.2.1细胞培养和siRNA转染 把Hep3B细胞放在含有100 μg/mL的链霉素、100 U/mL的青霉素及10%胎牛血清的MEM培养基的细胞培养瓶内,并置于饱和空气湿度、温度37 ℃及5%CO2孵箱里培养。细胞以1×106个/孔的密度平铺在六孔板内。孵育24 h后细胞融合率大约为90%。使用脂质体LipofectamineTM2000将Cyclin D1-siRNA和NC-siRNA转染细胞。Cyclin D1-siRNA序列:5′ACAAACAGATCATCCGCAA3′,NC-siRNA序列:5′-UUCUCCGAACGUGUCACGUTT-3′。siRNA浓度为100 nmol/L,脂质体每孔5 μL介导转染,转染后48 h收获细胞。实验分为空白对照组、阴性对照siRNA(NC-siRNA)组、Cyclin D1-siRNA组。实验每组重复6次。
1.2.2RT-PCR检测Cyclin D1、Mdm2、Mdm4、P53、P21 mRNA的表达 配制PCR反应体系:2×Taq PCR MasterMix 12.5 μL,上游引物1 μL,下游引物1 μL,cDNA 500 ng,补充三蒸水至终体积25 μL。PCR反应条件:1个循环预变性,95 ℃ 5 min;36个循环PCR反应,95 ℃ 40 s,55 ℃ 40 s,72 ℃ 60 s;延伸 72 ℃ 8 min。每个基因取同等量的PCR产物置于琼脂糖凝胶孔中进行电泳,利用暗箱式紫外透射仪(上海精科)观察电泳结果并拍照。最终数据以目的条带/β-actin的灰度值表示,结果用BANDLEAD 3.00软件分析。基因引物序列及产物大小见表1。
1.2.3Western blot检测Cyclin D1、Mdm2、Mdm4、P53和P21蛋白的表达 提取总蛋白使用放射免疫沉淀试验法,检测蛋白质浓度使用二喹啉甲酸法。提取20 μg蛋白质进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳。蛋白转移至NC膜上,然后用5 g/100 mL脱脂奶粉液于4 ℃封闭过夜。NC膜用相应的Ⅰ抗(1∶200比例稀释) 于4 ℃孵育过夜,继以Ⅱ抗孵育2 h,最终用DAB显色照相。结果以目的条带/β-actin的灰度值表示,用软件Quantity One分析。

表1 各基因引物序列和产物大小
1.2.4流式细胞仪检测细胞周期 获得上述各组细胞,使用流式细胞仪(美国Beckman公司)分析得出细胞各周期的百分率。
1.2.5MTT检测细胞活力 细胞平铺于96孔板内,其中空白调零孔只加不含细胞的培养基MEM。对细胞进行处理后,每孔细胞加入5 mg/mL MTT液20 μL,接着孵育4 h,弃上清液后加入150 μL 的二甲基亚砜,剧烈混匀10 min,上酶标仪(上海Bio-Rad)于492 nm处检测各孔吸光度(A)值。
1.2.6TUNEL检测细胞凋亡 用PBS洗细胞3次×5 min。加入4%多聚甲醛溶液室温固定30 min,PBS洗3次×5 min。加入0.1% Triton X-100溶液室温破膜10 min,PBS洗3次×5 min。实验组每片以5 μL末端脱氧核苷酸转移酶(terminal deoxynucleotidyl transferase,TdT)及45 μL荧光素标记的dUTP液混匀。玻片干后,加50 μL TUNEL反应混合液于标本上,加盖玻片或封口膜在暗湿盒中37 ℃反应60 min。PBS洗3次×5 min。玻片干后加50 μL converter-POD于标本上,加盖玻片或封口膜在暗湿盒中37℃反应30 min。PBS洗3次×5min。在组织处加适量DAB底物,显微镜下控制显色。PBS终止显色。苏木素复染,中性树胶封片。观察,拍照。每张切片于200倍镜下随机选择4个视野,计算阳性细胞数为凋亡指数。
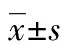
2 结 果
2.1各组Cyclin D1、Mdm2、Mdm4、P53、P21 mRNA的表达 与空白对照组和NC-siRNA组相比,Cyclin D1-siRNA组P53和P21 mRNA的表达上调(P<0.05),Cyclin D1、Mdm2和Mdm4 mRNA的表达下调(P<0.01);而空白对照组与NC-siRNA组之间相比,各基因表达差异无统计学意义(P>0.05),见图1。
2.2各组Cyclin D1、Mdm2、Mdm4、P53、P21蛋白的表达 与空白对照组和NC-siRNA组相比,Cyclin D1-siRNA组P53和P21蛋白的表达上调(P<0.01),Cyclin D1、Mdm2和Mdm4蛋白的表达下调(P<0.01);而空白对照组与NC-siRNA组之间相比,各蛋白表达差异无统计学意义(P>0.05),见图2。

表2 流式细胞仪检测细胞周期
*:P>0.05,与空白对照组和NC-siRNA组比较
2.3各组细胞周期 与空白对照组和NC-siRNA组相比,Cyclin D1-siRNA组细胞G1、S及G2期均无明显差异(P>0.05);空白对照组与NC-siRNA组之间比较,各期差异无统计学意义(P>0.05),见表2、图3。

A:空白对照组;B:NC-siRNA组;C:Cyclin D1-siRNA组;*:P<0.05,与空白对照组和NC-siRNA组比较
图1各组Cyclin D1、Mdm2、Mdm4、P53、P21 mRNA的表达
A:空白对照组;B:NC-siRNA组;C:Cyclin D1-siRNA组;*:P<0.01,与空白对照组和NC-siRNA组比较
图2各组Cyclin D1、Mdm2、Mdm4、P53、P21蛋白的表达

A:空白对照组;B:NC-siRNA组;C:Cyclin D1-siRNA组
图3各组细胞周期情况
2.4各组细胞增殖活力 与空白对照组和NC-siRNA组相比,Cyclin D1-siRNA组细胞增殖活力明显减弱(P<0.01);空白对照组与NC-siRNA组细胞增殖活力差异无统计学意义(P>0.05),见图4。

A:空白对照组;B: NC-siRNA组;C:Cyclin D1-siRNA组;*:P<0.01,与空白对照组和NC-siRNA组比较
图4各组细胞增殖活力
2.5各组细胞凋亡情况 与空白对照组和NC-siRNA组相比,Cyclin D1-siRNA组细胞凋亡明显增强(P<0.01);而空白对照组与NC-siRNA组的细胞凋亡差异无统计学意义(P>0.05),见图5。

A:空白对照组(×200);B:NC-siRNA组(×200);C:Cyclin D1-siRNA组(×200);*:P<0.01,与空白对照组和NC-siRNA组比较
图5各组细胞凋亡情况
3 讨 论
细胞周期是确保细胞进行生命活动的基本过程,其准确调控对于生命正常生存、繁殖、发育及遗传起到了关键性作用。细胞周期的关键点是G1期的启动,而Cyclin D1是调控细胞周期 G1期的关键性蛋白[5]。Cyclin D1在肿瘤细胞中表现为表达过度,造成了G1期的缩短,过度的细胞增殖[6]。Cyclin D1已经被证实了与多种肿瘤的发生、发展有关[7]。肝癌的发生也与G/S期检测点的缺陷相关[8]。Cyclin D1表达下调可导致肝癌细胞株Huh7细胞的凋亡,使其停滞在G1期[9]。
HCC是全世界最普遍的肿瘤之一,而我国由于乙型肝炎的高发使肝癌患者占全世界的大部分[10]。目前,针对HCC的治疗方法均不理想,疗效有限。而基因治疗因其可从根本上治愈疾病,故而会是治疗HCC的新选择及新趋势。
本研究结果显示,Cyclin D1基因表达下调能抑制Mdm2和Mdm4的表达,并能上调P53和P21的表达;Cyclin D1基因表达下调能减弱肝癌细胞的增殖,并能诱导其凋亡。Cyclin D1表达下调对肝癌的细胞周期没有影响。其可能的原因是,Cyclin D1表达下调只通过细胞凋亡途径起作用,而对细胞周期通路并不产生影响。
Mdm2和Mdm4参与了多条细胞调控通路,并影响了肿瘤发生与发展的过程[11]。目前已有的研究表明,很多肿瘤中均有Mdm2和Mdm4表达过度的现象。Mdm2和Mdm4在肿瘤细胞中的过表达,导致了野生型P53的抑癌活性受抑,诱导了肿瘤形成[12]。本研究组既往的研究亦表明[13],利用RNA干扰技术使得Mdm2表达沉默减弱了肝癌细胞增殖,并导致其凋亡;下调Mdm2的表达能上调抑癌基因P21的表达,而P21是P53途径最重要的下游基因之一。本研究发现,Cyclin D1基因表达下调能抑制Mdm2和Mdm4的表达,并能上调抑癌基因P53和P21的表达。这些均表明,Cyclin D1基因表达下调能抑制肝癌的发生和生长。沉默Cyclin D1基因的表达能造成肝癌细胞的活力下降,凋亡被诱导。这与预期实验结果一致,即Cyclin D1基因表达下调能抑制肝癌细胞的增殖并促进其凋亡。
综上所述,Cyclin D1基因表达下调能抑制Mdm2和Mdm4的表达,并能上调抑癌基因P53和P21的表达;Cyclin D1基因表达下调能抑制肝癌细胞的增殖并促进其凋亡。这为肝癌的基因治疗提供可能的分子作用靶点。
[1]LI C F,PENG W C,SONG X,et al.Anticancer effect of icaritin inhibits cell growth of colon cancer through reactive oxygen species,Bcl-2 and cyclin D1/E signaling[J].Oncol Lett,2016,12(5):3537-3542.
[2]WADE M,LI Y C,WAHL G M.MDM2,MDMX and p53 in oncogenesis and cancer therapy[J].Nat Rev Cancer,2013,13(2):83-96.
[3]NAKAJI S,HIRATA N.Evaluation of the viability of hepatocellular carcinoma in the caudate lobe using contrast-enhanced endoscopic ultrasonography after transarterial chemoembolization[J].Endoscopic Ultrasound,2016,5(6):390-392.
[4]冯潜,石世代,周勇,等.KLF4调控 MMP9对原发性肝癌的侵袭迁移能力的影响[J].重庆医学,2015,44(22):3025-3029.
[5]DEFORZH E,VARGAS T R,KROPP J,et al.IMP-3 protects the mRNAs of cyclins D1 and D3 from GW182/AGO2-dependent translational repression[J].Int J Oncol,2016,49(6):2578-2588.
[6]WANG N,WANG X B,TAN H Y,et al.Berberine suppresses cyclin D1 expression through proteasomal degradation in human hepatoma cells[J].Int J Mol Sci,2016,17(11):1899-1911.
[7]FUSTÉ N P,FERREZUELO F,GARE.Cyclin D1 promotes tumor cell invasion and metastasis by cytoplasmic mechanisms[J].Mol Cell Oncol,2016,3(5):e1203471.
[8]MOGHADDAM S J,HAGHIGHI E N,SAMIEE S,et al.Immunohistochemical analysis of p53,cyclinD1,RB1,c-fos and N-ras gene expression in hepatocellular carcinoma in Iran[J].World J Gastroenterol,2007,13(4):588-593.
[9]CHE Y F,YE F,XU R L,et al.Co-Expression of XIAP and cyclin D1 complex correlates with a poor prognosis in patients with hepatocellular carcinoma[J].Am J Pathol,2012,180(5):1798-1807.
[10]向尹,杨阳,周杰.HBV DNA载量与肝硬化和原发性肝癌的相关性探究[J].重庆医学,2016,45(23):3231-3232.
[11]KRIEGMAIR M C,BALK M,WIRTZ R,et al.Expression of the p53 inhibitors MDM2 and MDM4 as outcome predictor in muscle-invasive bladder cancer[J].Anticancer Res,2016,36(10):5205-5213.
[12]TEVERONI E,LUCA R,PELLEGRINO M,et al.Peptides and peptidomimetics in the p53/MDM2/MDM4 circuitry - a patent review[J].Expert Opin Ther Pat,2016,26(12):1417-1429.
[13]丁浩,张吉翔.人着色性干皮病基因D对HepG2细胞Mdm2和Mdm4表达的影响[J].中国病理生理杂志,2014,30(1):48-52.

