不同荒漠植物根际土壤微生物群落结构特征
李欣玫,左易灵,薛子可,张琳琳,赵丽莉,贺学礼
河北大学生命科学学院,保定 071002
安西极旱荒漠地区气候条件恶劣,植物种类组成和群落结构简单。膜果麻黄(Ephedraprzewalskii)、红砂(Reaumuriasongarica)、合头草(Sympegmaregelii)、珍珠猪毛菜(Salsolapasserina)、泡泡刺(Nitrariasphaerocarpa)作为安西极旱荒漠的代表性植被,分别隶属麻黄科、柽柳科、藜科和蒺藜科,其群落发育、分布及对土壤微环境的调控作用差异显著。此外,膜果麻黄等5种植物均具有根系发达、耐旱、抗风沙等特性,对极旱荒漠生态系统维持具有重要作用。
土壤微生物参与多种生化反应过程,是有机物的主要分解者,在陆地生态系统养分循环中扮演着重要角色,尤其对C、N循环过程具有重要意义[1- 2]。土壤微生物特性对土壤基质变化敏感,其群落结构组成和生物量等可以反映土壤肥力状况,是重要的生物学指标[3- 4]。研究表明,土壤微生物与地表植被类型关系密切。毕江涛等[5]认为在一定空间尺度具有相似环境的条件下,随着植物类型不同,土壤微生物活性和群落结构表现出一定的差异。Ushio等[6]研究认为,植物能够通过根系分泌物等途径向土壤输入不同质量的碳源,改变土壤环境,进而影响土壤微生物群落结构。目前,有关植被类型对土壤微生物群落结构影响的研究主要集中于湿地、森林、草地等生态系统[6- 8],对荒漠生境中不同植被下土壤微生物群落结构的研究甚少。
基于此,我们假设:极旱荒漠生境中,不同植被下土壤微生物群落结构有显著差异。因此,本试验采用磷脂脂肪酸(PLFA)法结合Sherlock微生物鉴定系统,研究膜果麻黄等5种极旱荒漠植物根际土壤微生物群落结构,深入探讨植物种类和土壤因子对微生物群落组成和生态分布的影响,以期为干旱风沙区荒漠植被恢复和生态环境保护提供依据。
1 材料和方法
1.1 样地概况
研究区位于甘肃安西极旱荒漠国家级自然保护区(94°45′—97°00′E,39°52′—41°53′N),地处甘肃省瓜州县境内。该地区属典型大陆性气候,年均气温7.8—10℃,年均降雨量<52.0mm,季节分配不均,夏季降雨量占全年降雨的70%左右,年蒸发量2754.9—3420mm。土壤类型多为灰棕漠土,植被覆盖度低,主要有红砂、合头草、珍珠猪毛菜、泡泡刺、膜果麻黄等(表1)。

表1 5种植物群落基本信息
1.2 样品采集
于2015年7月在保护区选取上述5种典型植物群落,分别在每个植物群落按五点采样法选取5株相隔200m左右、长势相近的植株,去除土壤表面枯枝落叶层,在距植株主干0—30cm土层范围内采集根样,自然抖落根样根际土壤,混合均匀后装入隔热性能良好的自封袋带回实验室。土样过2mm筛后,部分保存在-20℃冰箱用于土壤微生物PLFA测定,其余用于土壤理化性质测定。
1.3 土壤因子测定
土壤pH用精密酸度计PHS- 3C测定;土壤有效磷用碳酸氢钠浸提-钼锑抗比色法;全氮、氨氮、全磷用全自动化学分析仪Smartchem200测定;碱解氮用碱解扩散法;土壤有机碳用马弗炉烘干法;按Wright[9]和Janos[10]等方法测定总球囊霉素和易提取球囊霉素;用改进的Brimner和Tabatabai[11]方法测定土壤酸性磷酸酶和碱性磷酸酶,其活性以1g土样培养1h后酸性磷酸酶和碱性磷酸酶转化对硝基苯磷酸二钠(PNPP)的量表示。
1.4 土壤微生物磷脂脂肪酸测定
土壤微生物群落结构根据Bossio等[12]的方法进行测定:将土壤提取液(氯仿∶甲醇∶磷酸缓冲液=1∶2∶0.8,v/v/v)加入到冷冻干燥土壤中提取脂类,利用硅胶柱(SPE-Si,500mg/6mL)进行分离纯化,纯化后的脂肪酸用KOH-甲醇溶液甲酯化,再加入甲酯化C19:0作为内标,用美国Agilent 6890N型GC-MS分析仪结合Sherlock MIS4.5系统(Sherlock Microbial Identification System)完成检测分析。单个 PLFA 含量用nmol/g表示,特征磷脂脂肪酸分类见表2。

表2 特征磷脂脂肪酸(PLFA)分类
1.5 数据分析
所有数据取3个重复的平均值,用Excel 2010进行整理,利用SPSS 19.0生物统计软件,对土壤因子和土壤微生物群落进行单因素方差分析,对土壤微生物PLFA进行主成分分析;用Amos Graphics 22.0构建结构方程模型(SEM)确定土壤因子与土壤微生物群落的相关性,其拟合标准如下:2/df<2,P>0.05,RMSEA<0.05。
2 结果与分析
2.1 土壤理化性质
5种植物根际土壤pH均呈碱性;总球囊霉素在泡泡刺中显著高于膜果麻黄、合头草和珍珠猪毛菜;酸性磷酸酶在红砂中显著高于其他植物;碱性磷酸酶在红砂和泡泡刺中有最大值;土壤有机碳在合头草中最高,泡泡刺中最低,其他植物间无显著差异;氨氮在不同植物间差异显著;土壤有效磷、全磷、全氮、碱解氮、易提取球囊霉素在不同植物间均无显著差异(表3)。
2.2 土壤微生物磷脂脂肪酸分析
本试验选取大于0.01nmol/g的24种PLFA进行分析。主成分分析表明(图1),与土壤微生物PLFA相关的3个主成分因子累积贡献率达96.838%,分别可解释变量方差的77.140%、12.617%和7.081%。不同植物在PC1、PC2和PC3上分布较散,说明不同植物土壤微生物PLFA组成差异显著。由表4可知,膜果麻黄、红砂和珍珠猪毛菜在3个主成分上得分无显著差异,合头草、泡泡刺分别在PC3和PC2上的得分显著最高。

表3 不同植物根际土壤因子
不同字母表示不同植物群落间差异显著(P<0.05)

表4 不同植物在PC1、PC2和PC3上得分
不同字母表示同一植物群落在不同主成分上得分差异显著(P<0.05)
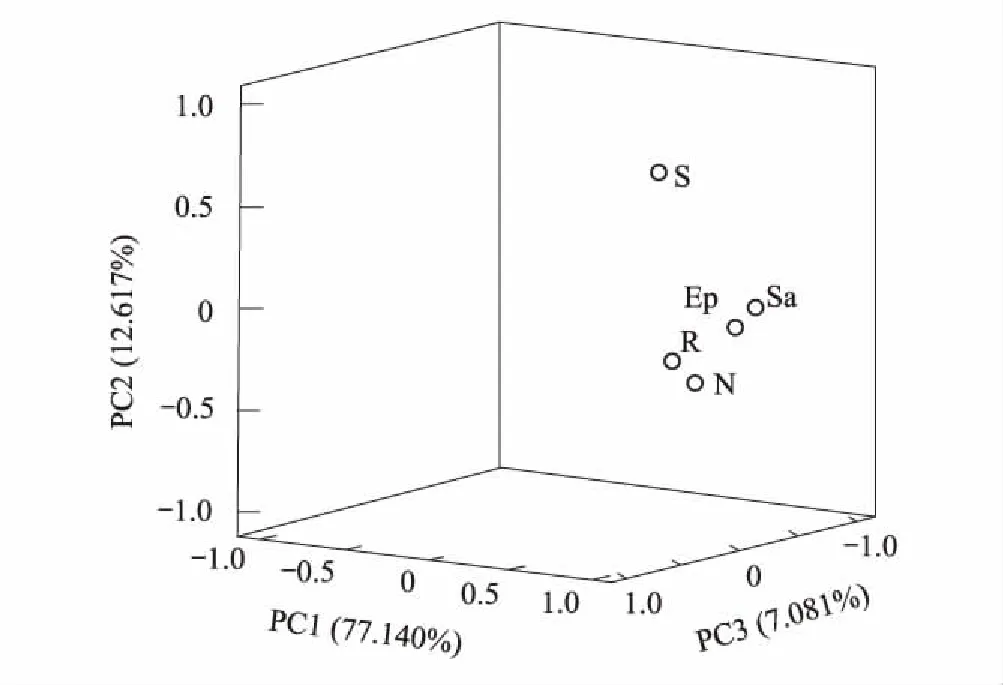
图1 土壤微生物PLFA主成分分析Fig.1 Principal component analysis of soil microbial PLFA E:膜果麻黄Ephedra przewalskii;R:红砂Reaumuria songarica;S:合头草Sympegma regelii;N:泡泡刺Nitraria sphaerocarpa;Sa:珍珠猪毛菜 Salsola passerina
将PLFA单体与PC1、PC2和PC3进行相关性分析可知(表5),15:0 iso、15:0 anteiso、17:0 anteiso(指示革兰氏阳性菌);16:1 ω7c、17:1 ω8c、18:1 ω7c(指示革兰氏阴性菌);16:0 10-methyl、18:0 10-methyl(指示放线菌)是膜果麻黄根际土壤主要PLFAs。18:0 iso(指示革兰氏阳性菌);23:1 ω4c、20:4 ω6c(指示真核生物);16:1 ω5c(指示AM真菌)是红砂主要PLFAs,其中18:0 iso、23:1 ω4c仅在红砂中存在。合头草根际土壤PLFAs以18:1 ω7c 、19:0 cyclo ω7c(指示革兰氏阴性菌);16:0 10-methyl(指示放线菌);16:3 ω6c、18:3 ω6c(指示真核生物)为主。18:2 ω6c(指示真菌)在泡泡刺中占主导地位。珍珠猪毛菜主要有15:0 iso、15:0 anteiso、17:0 iso、16:0 iso 、17:1 iso ω9c(指示革兰氏阳性菌);16:1 ω7c、17:1 ω8c、18:1 ω7c、19:0 cyclo ω7c(指示革兰氏阴性菌);16:0 10-methyl、18:0 10-methyl、18:1 ω7c 10-methyl(指示放线菌);20:4 ω6c(指示真核生物);16:1 ω5c(指示AM真菌);18:2 ω6c(指示真菌),其中16:0 iso、17:1 iso ω9c和18:1 ω7c 10-methyl为珍珠猪毛菜特有。可见,不同植物根际土壤微生物主要PLFA种类和组成差异显著,但以表征革兰氏阴性菌、革兰氏阳性菌和放线菌的特征脂肪酸为主。

表5 不同植物单种特征PLFA与PC1、PC2和PC3的相关性分析
*P<0.05,**P<0.01; “—”表示在该植物中未检出
2.3 土壤微生物群落结构分析
5种植物根际土壤微生物群落结构差异显著(表6),膜果麻黄、泡泡刺和珍珠猪毛菜中革兰氏阴性菌显著最高,革兰氏阳性菌、放线菌和真核生物次之,AM真菌最低;红砂中革兰氏阴性菌显著高于其他微生物;合头草中AM真菌最高,真菌最低。不同植物,总PLFA、放线菌和真菌表现为珍珠猪毛菜>膜果麻黄>泡泡刺>红砂>合头草,革兰氏阴性菌和革兰氏阳性菌大小顺序为膜果麻黄>珍珠猪毛菜>泡泡刺>红砂>合头草,AM真菌在合头草中显著最高。真菌/细菌在珍珠猪毛菜中显著高于其他植物,其他植物间无显著差异。

表6 不同植物土壤微生物PLFAs含量
不同大写字母表示同一植物各微生物类群间差异显著(P<0.05),不同小写字母表示同一微生物在不同植物群落间差异显著
2.4 土壤微生物群落与土壤因子相关性分析
相关性分析可知(表7),土壤pH与革兰氏阴性菌显著负相关;全氮与AM真菌显著正相关;氨氮与革兰氏阴性菌、革兰氏阳性菌、放线菌和真菌显著正相关;碱解氮与革兰氏阴性菌、革兰氏阳性菌和放线菌显著负相关;酸性磷酸酶与革兰氏阳性菌和放线菌显著负相关;易提取球囊霉素与革兰氏阴性菌、革兰氏阳性菌和放线菌显著正相关;总球囊霉素与真菌显著负相关。
*P<0.05,**P<0.01
2.5 植物种类和土壤因子对微生物群落的影响
根据相关系数构建结构方程模型(图2),对植物、易提取球囊霉素、土壤pH、碱解氮与革兰氏阳性菌、革兰氏阴性菌、放线菌和AM真菌的相关关系进行量化(2=8.018,df=16,P=0.948,RMSEA=0,GFI=0.883)。结果表明,植物通过土壤pH、碱解氮对革兰氏阴性菌、革兰氏阳性菌和AM真菌产生间接影响但不显著,易提取球囊霉素对放线菌有极显著直接影响,碱解氮是革兰氏阳性菌和革兰氏阴性菌的主要影响因子。

图2 土壤微生物群落与植物、土壤因子结构方程模型分析Fig.2 Structural equation model about soil microbial communities, plants and soil factors 箭头宽度表示影响程度,箭头附近的数字代表标准化路径系数(其中表示P<0.001,表示P<0.01,表示P<0.05)
3 讨论和结论
3.1 讨论
本试验中5种植物根际土壤以表征革兰氏阴性菌、革兰氏阳性菌和放线菌的特征磷脂脂肪酸为主,其中表征革兰氏阳性菌的18:0 iso、16:0iso和17:1 iso ω9c分别为红砂、珍珠猪毛菜特有表征放线菌的18:1 ω7c 10-methyl仅在珍珠猪毛菜中存在,说明不同植物土壤微生物主要PLFA种类和组成差异显著。Cao等[13]认为由于单种特征PLFA对土壤环境变化敏感,因此植物介导下土壤性质的改变对土壤微生物PLFA有显著影响。本试验中,红砂是典型泌盐植物,可通过盐分转移在一定程度上降低土壤盐分,而珍珠猪毛菜作为C4植物,其根系分泌物能够改变土壤有机质,从而影响单种特征PLFA的分布。

5种植物根际土壤微生物群落结构差异显著。有些研究认为,这可能与植物根系分泌物有关,植物不同,根系分泌物物理化学性状不同,从而对土壤微生物产生不同的刺激作用[5]。总PLFA、放线菌、真菌、革兰氏阴性菌和革兰氏阳性菌变化趋势基本一致,表现为珍珠猪毛菜>膜果麻黄>泡泡刺>红砂>合头草,说明珍珠猪毛菜根际土壤环境更有利于微生物生长。珍珠猪毛菜是C4植物,土壤有机质含量高于C3植物[2],加之真菌、革兰氏阳性菌对木质素等物质的分解[17],能进一步改善珍珠猪毛菜根际土壤环境,使其土壤微生物含量更高。Aguilera等[18]研究表明,随着土壤可利用性养分增加,土壤微生物丰度也随之提高。膜果麻黄为超旱生常绿灌木、植株较高且具有轴根型根系,而红砂、合头草属小灌木、植株矮小,因此向土壤输入的养分可能远低于膜果麻黄,导致其根际土壤微生物含量显著最低。AM真菌在合头草中最高,膜果麻黄中最低,可能与AM真菌生长特性有关。AM真菌作为植物共生真菌,其发生和分布往往依赖于植物根系[19]且对土壤盐碱度变化敏感[20]。合头草根系发达、侧根众多,能为AM真菌的侵染和共生提供支持;而膜果麻黄在水平方向上的聚盐性可能会抑制某些AM真菌生长,导致其根际土壤AM真菌含量显著降低。真菌/细菌作为表征土壤有机质的指标[21],在珍珠猪毛菜中显著高于其他植物,从侧面反映了珍珠猪毛菜根际土壤质量相对最高。
作为植物与土壤环境之间沟通的桥梁,土壤微生物群落结构必然受到植物和土壤因子的直接影响。本试验中,与植物相比,土壤因子对土壤微生物群落的影响更为显著,其中易提取球囊霉素和碱解氮是主要影响因子,这可能与样地生态环境有关。安西极旱荒漠干旱少雨且在7月份温度达全年最高值,土壤微生物活性明显降低,植物凋落物和根系分泌物分解受到抑制,加上降水量低、淋溶作用减弱,导致植物分解产生的营养物质对土壤微生物无显著影响[22]。球囊霉素是AM真菌分泌产生的一类具有一定黏附力的糖蛋白,随菌丝壁和孢子降解释放到土壤中,是土壤有机碳库的重要组成部分,且其黏附力有利于土壤团聚体形成,从而提高土壤通气性[23],为放线菌提供适宜的生长环境。碱解氮对革兰氏阴性菌和革兰氏阳性菌有显著负影响,可能与不同碳氮比对细菌的影响有关。氮素作为细菌细胞的重要成分,其含量越高,细菌自身合成作用越强,所需能量越多,但荒漠土壤有机碳含量较低,无法满足细菌物质合成对能量的需求。此外,氮素含量过高导致土壤积累大量铵盐,使得土壤pH升高,不利于有机物分解,从而抑制细菌生长。
3.2 结论
5种荒漠植物根际土壤微生物群落结构差异显著,并与植物群落和土壤因子密切相关,但土壤因子对土壤微生物影响更为显著,其中易提取球囊霉素和碱解氮是主要影响因子。这不仅有助于进一步揭示荒漠植物、土壤因子与土壤微生物群落的相互关系,同时对利用生物技术进行荒漠植被恢复具有重要意义。
致谢:河北大学生命科学院侯力峰、成斌、郭清华和孙茜同学帮助采集野外样品,甘肃安西极旱荒漠国家级自然保护区和甘肃民勤连古城国家级自然保护区为野外采样工作提供便利,特此致谢。
参考文献(References):
[1] 蒋婧, 宋明华. 植物与土壤微生物在调控生态系统养分循环中的作用. 植物生态学报, 2010, 34(8): 979- 988.
[2] Porazinska D L, Bardgett R D, Blaauw M B, Hunt H W, Parsons A N, Seastedt T R, Wall D H. Relationships at the aboveground-belowground interface: plants, soil biota, and soil processes. Ecological Monographs, 2003, 73(3): 377- 395.
[3] Pankhurst C E, Hawke B G, Mcdonald H J, Kirkby C A, Buckerfield J C, Michelsen P, O′Brien K A, Gupta V V S R, Doube B M. Evaluation of soil biological properties as potential bioindicators of soil health. Australian Journal of Experimental Agriculture, 1995, 35(7):1015- 1028.
[4] 李晨华, 李彦, 谢静霞, 唐立松. 荒漠-绿洲土壤微生物群落组成与其活性对比. 生态学报, 2007, 27(8):3391- 3399.
[5] 毕江涛, 贺达汉. 植物对土壤微生物多样性的影响研究进展. 中国农学通报, 2009, 25(9): 244- 250.
[6] Ushio M, Wagai R, Balser T C, Kitayama K. Variations in the soil microbial community composition of a tropical montane forest ecosystem: Does tree species matter? Soil Biology and Biochemistry, 2008, 40(10): 2699- 2702.
[7] Bossio D A, Fleck J A, Scow K M, Fujii R. Alteration of soil microbial communities and water quality in restored wetlands. Soil Biology and Biochemistry, 2006, 38(6): 1223- 1233.
[8] Breulmann M, Schulz E, Weißhuhn K, Buscot F. Impact of the plant community composition on labile soil organic carbon, soil microbial activity and community structure in semi-natural grassland ecosystems of different productivity. Plant and Soil, 2012, 352(1/2): 253- 265.
[9] Wright S F, Upadhyaya A. A survey of soils for aggregate stability and glomalin, a glycoprotein produced by hyphae of arbuscular mycorrhizal fungi. Plant and Soil, 1998, 198(1): 97- 107.
[10] Janos D P, Garamszegi S, Beltran B. Glomalin extraction and measurement. Soil Biology and Biochemistry, 2008, 40(3): 728- 739.
[11] 鲁如坤. 土壤农业化学分析方法. 北京: 中国农业科技出版社, 2000: 271- 272.
[12] Bossio D A, Scow K M. Impacts of carbon and flooding on soil microbial communities: phospholipid fatty acid profiles and substrate utilization patterns. Microbial Ecology, 1998, 35(3): 265- 278.
[13] Cao Y S, Fu S L, Zou X M, Cao H L, Shao Y H, Zhou L X. Soil microbial community composition under Eucalyptus plantations of different age in subtropical China. European Journal of Soil Biology, 2010, 46(2): 128- 135.
[15] 左易灵, 贺学礼, 王少杰, 赵丽莉. 磷脂脂肪酸(PLFA)法检测蒙古沙冬青根围土壤微生物群落结构. 环境科学, 2016, 37(7): 2705- 2713.
[16] Djukic I, Zehetner F, Watzinger A, Horacek M, Gerzabek M H.Insitucarbon turnover dynamics and the role of soil microorganisms therein: a climate warming study in an Alpine ecosystem. FEMS Microbiology Ecology, 2013, 83(1): 112- 124.
[17] Kelly J J, Favila E, Hundal L S, Marlin J C. Assessment of soil microbial communities in surface applied mixtures of Illinois River sediments and biosolids. Applied Soil Ecology, 2007, 36(2/3): 176- 183.
[18] Aguilera L E, Armas C, Cea A P, Gutiérrez J R, Meserve P L, Kelt D A. Rainfall, microhabitat, and small mammals influence the abundance and distribution of soil microorganisms in a Chilean semi-arid shrubland. Journal of Arid Environments, 2016, 126: 37- 46.
[19] Tawaraya K, Saito M, Morioka M, Wagatsuma T. Effect of phosphate application to arbuscular mycorrhizal onion on the development and succinate dehydrogenase activity of internal hyphae. Soil Science and Plant Nutrition, 1994, 40(4): 667- 673.
[20] Juniper S, Abbott L K. Soil salinity delays germination and limits growth of hyphae from propagules of arbuscular mycorrhizal fungi. Mycorrhiza, 2006, 16(5): 371- 379.
[21] Johnson C K, Vigil M F, Doxtader K G, Beard W E. Measuring bacterial and fungal substrate-induced respiration in dry soils. Soil Biology and Biochemistry, 1996, 28(4/5): 427- 432.
[22] 李强, 周道玮, 陈笑莹. 地上枯落物的累积、分解及其在陆地生态系统中的作用. 生态学报, 2014, 34(14): 3807- 3819.
[23] Rillig M C, Allen M F. What is the role of arbuscular mycorrhizal fungi in plant-to-ecosystem responses to Elevated atmospheric CO2? Mycorrhiza, 1999, 9(1): 1- 8.

