大肠杆菌通过甲羟戊酸途径合成紫苏醇
秦泽华,张汝兵,郁建平
1 贵州大学,贵州 贵阳 550000
2 中国科学院青岛生物能源与过程研究所 中国科学院生物基材料重点实验室,山东 青岛 266101
紫苏醇是一种性质稳定、不易挥发、耐热耐酸的单体香料,在工业生产、食品生产、农业生产中具备广泛的用途[1]。此外,紫苏醇在医疗中也有独到的治疗效果,可用于降低器官移植中的排斥反应,并在胰腺癌[2]、乳腺癌[3]和食道癌[4]等多种癌症治疗[5-6]中具有广谱、高效、低毒的抗癌作用,目前国外已进入了临床阶段。
在自然界中,紫苏醇是植物甲醛戊酸代谢途径中产生的单萜化合物,通常以游离或酯的形式存在于多种植物中[7]。理论上,紫苏醇可采用有机溶剂[8-9]或超临界 CO2萃取[10-11]等方法从天然植物精油中提取。但因植物精油中紫苏醇含量太低、不易分离,导致成本过高而不能大量生产。李谦和等[12]则采用以天然存在的单萜烯为起始原料,用化学合成的方法合成紫苏醇,但因反应温度高、氧化剂剧毒、产物复杂且产率低等原因,同样也不能在实际生产中应用[13]。现今,合成生物学和代谢工程技术的迅速发展,为改造目标分子的天然生产物种或设计异源合成途径提供了可能。同时生物转化反应具有操作简单、条件温和、无毒、环境友好等优势,且转化所得到的产物通常具有区域选择性和立体选择性,所以生物转化法用于合成紫苏醇具有较好的应用前景[14]。
1966年,科学家Dhavalikar等[15]首次报道了假单胞菌Pseudomonad转化柠檬烯的方法,发现该细菌可以将 D-柠檬烯作为唯一碳源和能源转化合成紫苏醇。通过产物结构鉴定,发现Pseudomonad转化反应是在柠檬烯的第7位碳原子上进行羟基化,从而得到紫苏醇。然而紫苏醇会被该菌进一步氧化成紫苏醛、紫苏酸,接着进行β-氧化,最终发生降解。此后诸多研究证实了Pseudomonas和芽孢杆菌Bacillus能够利用柠檬烯作为唯一碳源和能源转化得到紫苏醇。1998年,van der Werf等[16]报道了红平红球菌Rhodococcus erythropolisDCL14能以柠檬烯作为唯一的碳源和能源合成紫苏醇,但不同于Bacillus和Pseudomonad,该菌不会对紫苏醇发生进一步氧化反应[15]。此外采用生物转化的方法,也可将柠檬烯转化合成光学活性的紫苏醇,转化作用是通过分枝杆菌Mycobacteriumsp.的细胞色素P450烷烃羟化酶 (Cytochrome P450 alkane hydroxylase,P450) 在L-柠檬烯的7位羟化生成L-紫苏醇。
大肠杆菌作为典型的模式生物,其遗传背景清楚,是生物合成领域常用的宿主菌[17]。以大肠杆菌作为合成萜类物质的宿主菌也日益得到研究人员的重视[18]。刘敏[19]利用大肠杆菌成功地构建了MEP途径合成异戊二烯。Alonso-Gutierrez等[20]以大肠杆菌为表达宿主,利用来源于葡萄球菌Staphylococcus aur eus的外源甲羟戊酸 (MVA)途径,初步实现了大肠杆菌通过 MVA代谢途径合成紫苏醇的可行性,但产物浓度和产率还处于较低的水平。本研究选择来源于粪肠球菌的外源MVA代谢合成基因,因本实验室已验证了此途径可高效合成MVA,可为后续反应提供充足的前体物。该合成途径再结合来源于留兰香Mentha spicata的香叶基焦磷酸合成酶 (GPPS)、巨冷杉Abies grandis的柠檬烯合酶 (LS)及分支杆菌Mycobacteriumsp.的P450,成功构建了以葡萄糖为原料合成紫苏醇的工程大肠杆菌 (图1)。此外,为了提高紫苏醇的产量,本研究进一步优化了工程菌株发酵条件中的碳源、IPTG浓度、诱导OD值、VB2浓度、发酵起始pH值等参数。
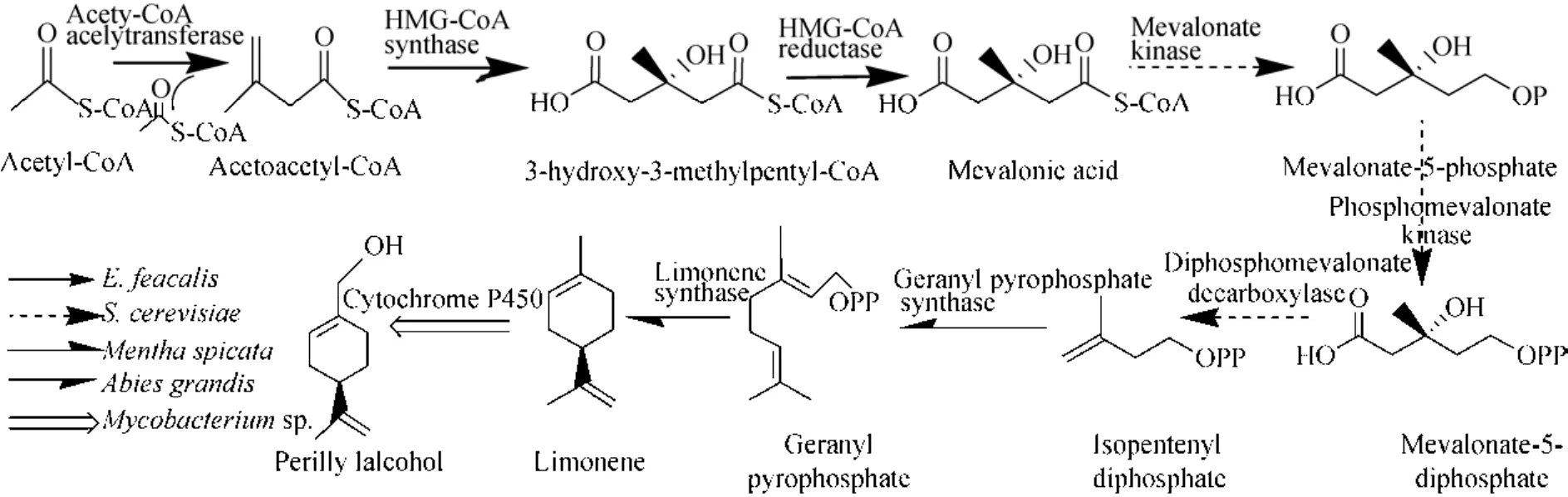
图1 紫苏醇MVA代谢途示意图Fig. 1 The mevalonate (MVA) pathway in Escherichia c oli for the production of perillyl alcohol. Acety-CoA acelytransferase (mvaE), HMG-CoA synthase (mvaS), HMG-CoA reductase (mvaE) form Enterococcus faeca lis;Mevalonate kinase (MK), phosphomevalonate kinase (PMK) and diphosphomevalonate decarboxylase (PMD) form Saccharomyces ce revisiae; Geranyl pyrophosphate synthase (GPPS) form Mentha sp icata; Limonene synthase (LS)form Abies grandis; Cytochrome P450 alkane hydroxylase (P450) form Mycobacterium sp..
1 材料与方法
1.1 实验材料
1.1.1 菌株与质粒
大肠杆菌Escherichia c oliDH5α和 BL21(DE3) 由本实验室保存。E. coliDH5α为基因克隆菌株,E. coliBL21 (DE3) 为发酵培养菌株。pCOLADuet-1购自Novagen公司,pTrcHis2B购自Invitrogen公司。pTrc-low、pACYCDuet-mvaE-mvaS为本实验已构建好质粒,其中 pTrc-low是以pTrcHis2B为载体,携带了来源于酿酒酵母Saccharomyces cer evisiae的 PMD、MK、PMK和IPI四种酶的基因[21];pACYCDuet-mvaE-mvaS是以pACYCDuet-1为载体,携带粪肠球菌Enterococcus faecalis的mvaS和mvaE两种酶的基因[21]。基因gpps、ls和p450经过大肠杆菌表达宿主序列优化后,由金唯智公司合成,并连接到载体pUC57上。
1.1.2 培养基
LB培养基:10.0 g/L蛋白胨、5.0 g/L酵母粉、10.0 g/L NaCl,pH 7.0,用于大肠杆菌的培养。紫苏醇的发酵培养基是在LB培养基的基础上添加终浓度为2 mmol/L的MgSO4。根据质粒抗性需要添加相应抗生素,培养基中抗生素终浓度为:Kan 50 μg/mL,Amp 100 μg/mL,抗生素购自北京索莱宝科技有限公司。
1.1.3 试剂及仪器
基因组DNA提取试剂盒、质粒提取试剂盒、凝胶纯化回收试剂盒和 DNA纯化试剂盒购自Omega公司;PrimeSTAR Max DNA Polymerase购自TaKaRa公司;限制性内切酶、T4 DNA连接酶购自Thermo scientific公司;DNA Marker等购自北京全式金生物技术有限公司;引物合成和基因测序是由青岛擎科生物技术公司负责完成。实验过程中使用的主要仪器包括:Bio-Rad PCR仪、Bio-Rad凝胶成像仪、Bio-Rad电泳仪、Varian GC450气相色谱、Varian Cary50分光光度计。
1.2 基因克隆和质粒构建
质粒 DNA提取、PCR扩增、限制性酶切、连接等均按说明书和常规方法进行。本研究质粒构建相关引物见表 1。培养携带 pUC57-p450和pUC57-ls的载体菌株,提取质粒。再分别以质粒pACYCDuet-mvaE-mvaS和pUC57-gpps为模板,采用PrimeSTAR Max DNA Polymerase扩增基因mvaE-mvaS、gpps。PCR产物经过电泳分析后,回收PCR目的片段,将回收产物和质粒进行双酶切,酶切产物用 DNA纯化试剂盒回收,再连接到经同样酶切并回收的质粒载体 pCOLADuet-1上,获得重组质粒。感受态细胞采用Competent Cell Preparation Kit试剂盒 (TaKaRa公司) 进行制备。
1.3 重组菌的发酵及发酵条件的优化
1.3.1 发酵条件的优化
诱导OD值对合成紫苏醇的影响:重组质粒pCOLA-gpps-mva-ls-p450和pTrc-low转化到E. coliBL21 (DE3) 中获得合成紫苏醇的重组大肠杆菌。挑取平板上的单菌落,接种于4 mL (加入适量的Amp和Kan) 的LB培养基中,37 ℃、200 r/min振荡培养8 h。将500 µL上述种子液接种于50 mL发酵培养基 (含 Amp 和 Kan) 中,37 ℃、200 r/min振荡培养。分别在菌液OD600达到0.3、0.6、0.8、1.0和1.5时,加入诱导剂IPTG诱导,30 ℃诱导培养。发酵36 h后,检测紫苏醇的含量。
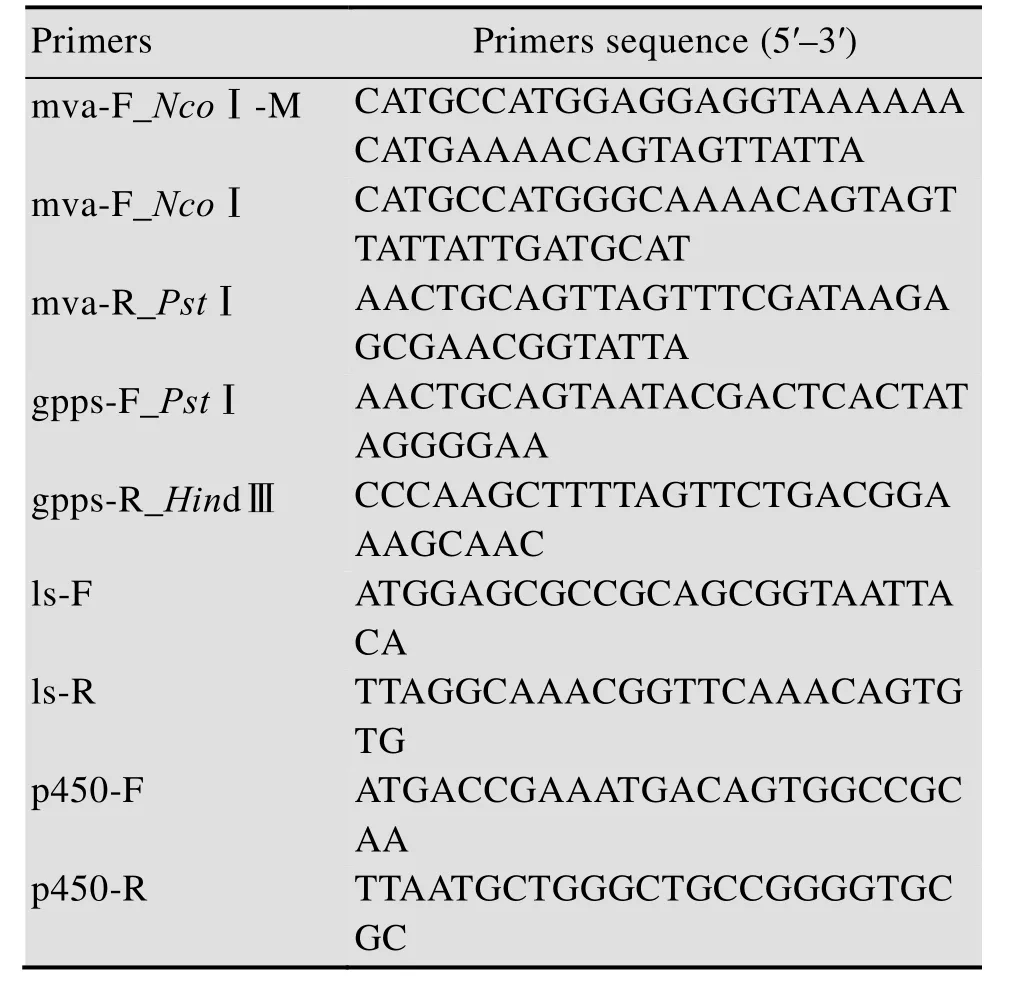
表1 本研究所用的引物Table 1 Primers used in this study
诱导剂 IPTG浓度对合成紫苏醇的影响:按上述发酵培养条件,当OD600为0.6–0.8时,加入诱导剂IPTG至终浓度分别为0.1、0.3、0.5、1.0、1.5 mmol/L。发酵36 h后,检测紫苏醇的含量。
碳源对合成紫苏醇的影响:按上述发酵培养条件,分别采用发酵培养基、发酵培养基加终浓度20 g/L葡萄糖、发酵培养基加终浓度20 g/L甘油作为紫苏醇的合成培养基,当OD600为0.6–0.8时,加入终浓度1.0 mmol/L的IPTG诱导剂。发酵36 h后,检测紫苏醇的含量。
pH对合成紫苏醇的影响:按上述发酵培养条件,采用发酵培养基加终浓度20 g/L的葡萄糖为紫苏醇发酵合成培养基。用HCl和氨水调节培养基中起始 pH,分别调节成 6.0、6.5、7.0、7.5、8.0,比较不同 pH下紫苏醇产量,在OD600为0.6–0.8时,加入终浓度1.0 mmol/L的IPTG诱导剂。发酵36 h后,检测紫苏醇的含量。
VB2对合成紫苏醇的影响:按上述发酵培养条件,采用起始pH为7.0的发酵合成培养基,分别加入终浓度为 0、10、30、50、100 µmol/L 的 VB2,在OD600为0.6–0.8时,加入终浓度1.0 mmol/L的IPTG诱导剂。发酵36 h后,检测紫苏醇的含量。
1.3.2 最优条件下紫苏醇的发酵培养
根据上述优化得到的发酵优化结果,进行紫苏醇的最终发酵。条件为:采用起始pH为7.0的发酵合成培养基,当OD600达到0.6–0.8,加入终浓度为30 µmol/L的VB2和1.0 mmol/L的IPTG,30 ℃诱导培养。在该条件下考察紫苏醇的合成过程,发酵过程中定期取样检测紫苏醇的合成。
1.4 紫苏醇的测定
紫苏醇采用气相色谱检测,方法如下:取3 mL的发酵液,加入等体积的乙酸乙酯,用涡旋振荡器充分混匀,然后3 000×g离心5 min,上层的乙酸乙酯转移到新的离心管中,加入Na2SO4将乙酸乙酯相中的水分充分抽离,3 000×g离心3 min。然后对上层的乙酸乙酯采用气相色谱分析检测。色谱条件:色谱柱为 DB-5 (30 m×0.320 mm×0.25 μm);检测器为氢火焰离子检测器;分析条件如下:柱温80 ℃保持2 min,然后以20 ℃/min从80 ℃升温到250 ℃,保持2 min,汽化温度250 ℃,检测器温度260 ℃。
2 结果与分析
2.1 紫苏醇合成质粒的构建
将基因gpps、mva、ls和p450克隆到表达载体pCOLADuet-1中,经测序确认后,获得重组表达质粒 pCOLA-gpps-mva-ls-p450。将重组质粒pCOLA-gpps-mva-ls-p450和pTrc-low共同转化到感受态细胞E. coliBL21 (DE3) 中,获得合成紫苏醇的工程大肠杆菌。
2.2 发酵条件优化分析
2.2.1 诱导OD值对紫苏醇合成的影响
诱导时机的选择对菌体外源蛋白的表达及产物合成影响极为显著,采用不同诱导时机考察对紫苏醇的合成影响结果如图 2所示。菌液OD600低于0.6时,菌体生长还处于初期,IPTG的诱导使菌体代谢负担加重,产物合成能力偏低。当OD600为0.8时加入IPTG诱导,紫苏醇含量达到最大值。随着OD600的增加,诱导时处于对数生长的后期,导致目的蛋白的合成量减少,从而影响产物生成。
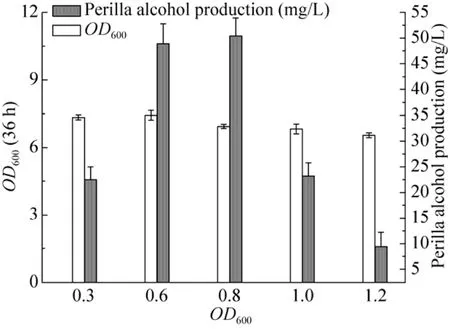
图2 不同诱导OD600值对紫苏醇合成的影响Fig. 2 Effect of different OD600 on perillyl alcohol production.
2.2.2 诱导剂IPTG浓度对菌体产紫苏醇的影响
IPTG浓度对菌体外源蛋白的表达及产物的合成影响极为显著,合适的 IPTG浓度可以诱导目的蛋白高效表达,采用不同浓度的 IPTG考察对紫苏醇的合成影响结果如图3所示。紫苏醇产量随着诱导剂浓度的升高而不断升高;诱导剂浓度为1.0 mmol/L时,紫苏醇浓度达到最大值;随着诱导剂浓度的再次增加,紫苏醇产量出现降低的趋势。经过初步分析得出,可能是由于高浓度的诱导剂会对细胞产生一定毒性,抑制菌体的生长,从而影响菌体代谢及产物表达水平。
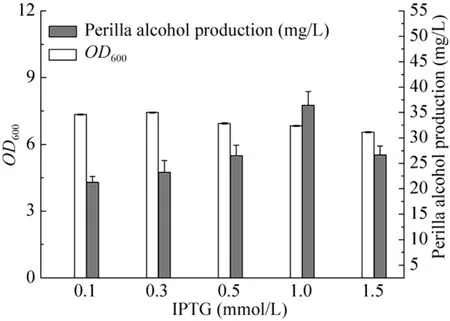
图3 IPTG浓度对工程菌合成紫苏醇的影响Fig. 3 Effect of IPTG concentration on perillyl alcohol production.
2.2.3 培养基对工程菌株产紫苏醇的影响
微生物对不同碳源的代谢能力不同,主要表现在代谢过程中所需的酶系活性及转运能力上的差异。因此,不同的碳源对菌体生长和产物的合成都有很大的影响,所以选择合适的碳源对微生物发酵合成目标代谢产物是十分重要的。本实验采用发酵培养基、发酵培养基+葡萄糖、发酵培养基+甘油为紫苏醇的合成培养基,考察培养基对紫苏醇合成的影响。结果可见,采用发酵培养基+葡萄糖时紫苏醇的合成效果最好,发酵培养基+甘油次之,不添加额外碳源的产量最低 (图4)。经过初步分析得出,在合成紫苏醇的发酵培养过程中,随着时间的延长,碳源逐渐消耗,导致重组大肠杆菌生长及代谢受到了一定的影响;而大肠杆菌在营养丰富的LB培养基条件下,甘油经甘油脱氢酶和二羟丙酮激酶催化生成磷酸二羟丙酮的速率过快,导致胞内积累的磷酸二羟丙酮进入丙酮酸代谢途径时生成可抑制大肠杆菌生长的乳醛,进而影响菌体代谢及产物合成;而分解葡萄糖的酶属于组成酶,此类酶的合成受遗传物质控制,可以有效地进入糖酵解途径生成乙酰辅酶A。
2.2.4 pH对工程菌株产紫苏醇的影响
pH是菌体生长和产物合成的重要参数,是影响发酵过程中酶的活性、糖的转化率、细胞渗透压的重要因素之一[22]。同时还影响发酵液中某些营养物和中间代谢产物的解离,从而影响重组大肠杆菌对营养物质的吸收和利用[23]。因此,发酵液中pH值过高或过低都会影响目的产物的生成。实验结果表明当pH范围在6.0–7.0时,紫苏醇产量随随着pH的升高而增加;pH值为7时,紫苏醇产量最高;pH范围在7.0–8.0时,紫苏醇产量下降(图5)。
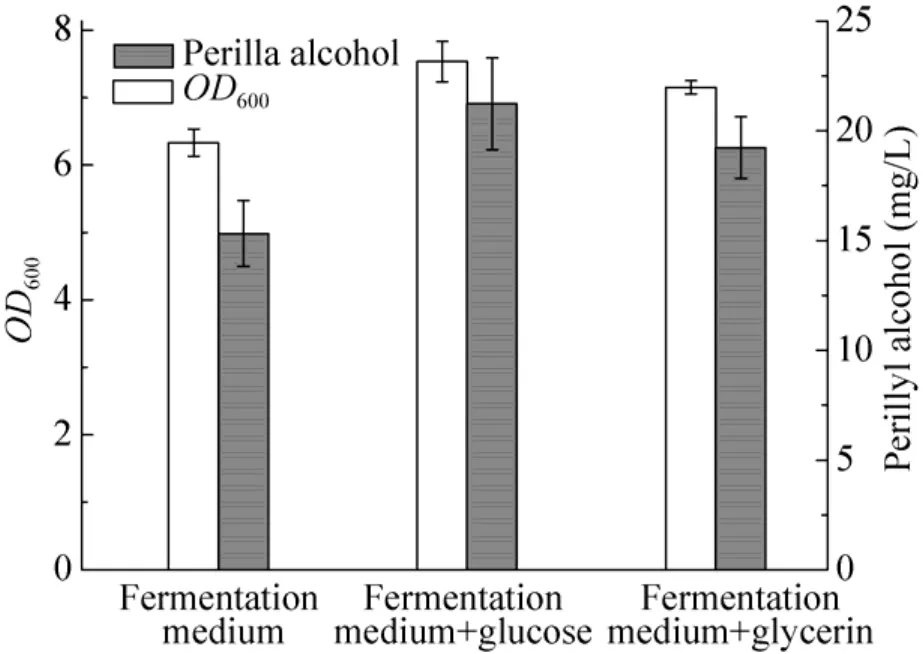
图4 培养基对工程菌合成紫苏醇的影响Fig. 4 Effect of carbon source concerntration on perillyl alcohol production.
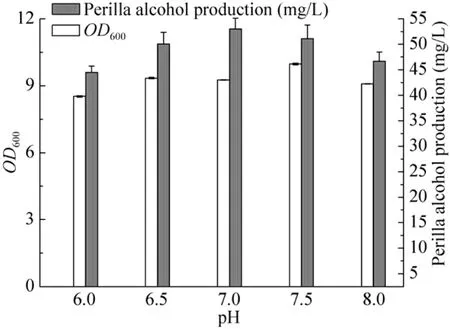
图5 pH对工程菌合成紫苏醇的影响Fig. 5 Effect of pH on perillyl alcohol production.
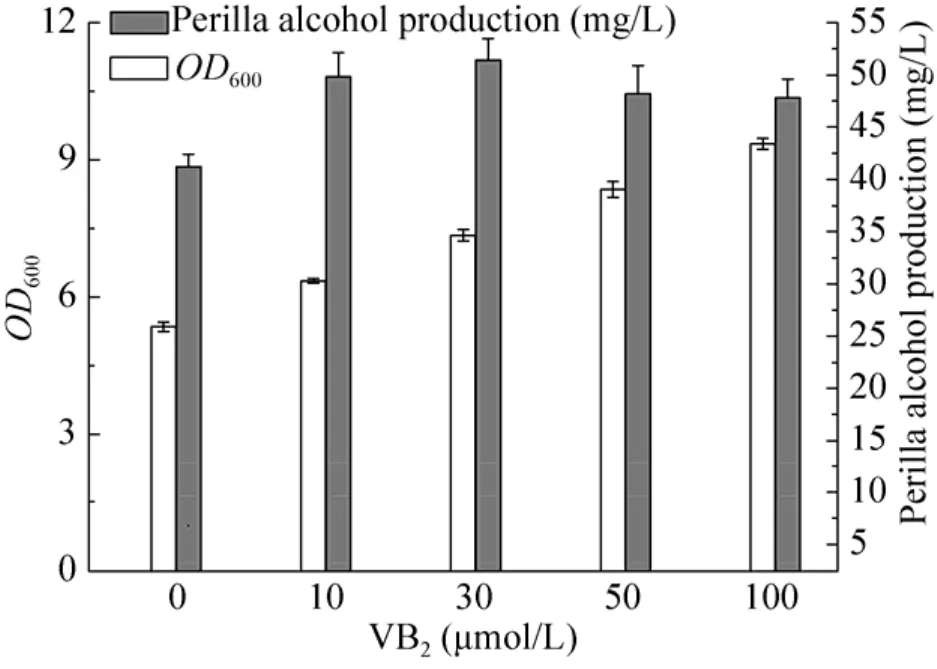
图6 VB2对合成紫苏醇的影响Fig. 6 Effect of VB2 concerntration on perillyl alcohol production.
2.2.5 VB2对工程菌株产紫苏醇的影响
核黄素 (VB2) 是蛋白质、糖、脂肪酸代谢和能量利用与组成所必需的物质[24]。在菌体生长发育过程中,VB2作为黄素蛋白的辅酶参与到机体组织代谢中,主要是在呼吸链中负责传递电子以及一些氧化还原反应,在呼吸和生物氧化中起着重要的作用。Alonso-Gutierrez等[20]报道了利用大肠杆菌生产紫苏醇的过程中,在培养液中添加一定量的VB2有利于柠檬烯转化为紫苏醇。本研究考察采用不同浓度的VB2对紫苏醇合成的影响,结果如图 6所示。研究表明当 VB2较低时,紫苏醇含量随着 VB2浓度的升高而不断升高;当浓度达到 30 µmol/L,紫苏醇浓度达到最高。但随着VB2浓度的继续增加,紫苏醇含量又逐渐下降(图 6)。
2.2.6 初步优化条件下的紫苏醇发酵
发酵培养基不仅是工程菌繁殖所需营养物质的基本条件,也是合成代谢产物的基础。它既要满足大肠杆菌快速生长繁殖至一定的菌体浓度,又要使菌体迅速合成代谢产物。因此,发酵培养液的组分和培养条件对菌株生长及产物合成是至关重要的[25]。以初步优化条件进行工程菌的发酵,每隔12 h定时取样,检测紫苏醇的产量,结果如图7所示。紫苏醇产量在诱导后的36 h前增加较快,在36 h左右时,紫苏醇的浓度达到最高值。随着时间的延长,紫苏醇的含量基本趋于稳定。
3 讨论
本研究通过在大肠杆菌体内引入基于 MVA代谢途径的外源基因,构建了合成紫苏醇的工程菌株,并在后期开展了菌株的发酵条件优化,提高了紫苏醇的发酵浓度至50.12 mg/L。
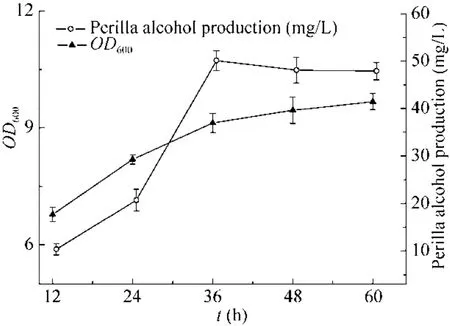
图7 紫苏醇的发酵过程Fig. 7 The fermentation process of perillyl alcohol.
紫苏醇生物合成的代谢途径和调控机制非常复杂,它需要将外源代谢途径中整个编码酶的基因导入到大肠杆菌中并实现异源表达[26]。由于所需的编码酶基因较多,只有一个载体的表达系统很难将整个代谢通路完全构建成功,需要使用多个重组质粒搭建一套完整的代谢途径,这其中就涉及到多个表达模块在细胞内的调控[26]。针对这个问题,本实验采用的工程菌株含有 pCOLA-gpps-mva-ls-p450和 pTrc-low两个质粒,其中本实验室已验证来源于粪肠球菌的外源 MVA代谢途径比来源于葡萄球菌[19]的外源 MVA代谢途径可更高效地合成MVA,可为后续反应提供充足的前体物。研究表明,本研究初步实现了大肠杆菌通过甲羟戊酸途径合成紫苏醇,并优化了工程菌株发酵条件中的培养基、IPTG浓度、诱导OD值、VB2浓度、发酵起始pH值等参数。研究发现工程菌在初始pH为7.0的发酵合成培养基中发酵培养,当菌液OD600达到0.6–0.8,加入终浓度为30 µmol/L的VB2和1.0 mmol/L的IPTG,在30 ℃诱导培养时紫苏醇含量最高,达到50.12 mg/L。
本研究通过采用高效表达的 T7启动子过量表达紫苏醇合成过程中的多种酶,实现了紫苏醇的生物合成,但由于每步酶的活性存在一定差异,必然会导致代谢过程中存在一定的不平衡,从而制约了紫苏醇的进一步合成。以往的研究也表明,从调节蛋白质表达水平的角度来提高产量并不是简单的“越多越好”,而是要平衡在多步代谢合成途径中的酶活性[27-28],因此后续研究还需对代谢通量进行分析,平衡代谢路径来进一步提高紫苏醇的合成能力。此外由于大多数单萜烯对细胞的毒性,使大肠杆菌生产单萜微生物的产量受到了一定的限制[29]。研究降低单萜烯对工程菌的毒性或提高菌株的耐受性有望进一步大幅度提高紫苏醇的发酵产量。同时进一步研究工程菌的代谢途径,并优化产品回收过程,将使微生物生产紫苏醇更加经济可行。
[1]Ma J. Recent advances on perillyl alcohol of a natural and active monoterpene. Guangzhou ChemInd, 2014,42(19): 16–18, 28 (in Chinese).马娟. 天然活性单萜-紫苏醇研究进展. 广州化工,2014, 42(19): 16–18, 28.
[2]Burke YD, Ayoubi AS, Werner SR, et al. Effects of the isoprenoids perillyl alcohol and farnesol on apoptos is biomarkers in pancreatic cancer chemoprevention. Anticancer Res, 2002, 22(6A):3127–3134.
[3]Bailey HH, Attia S, Love RR, et al. Phase Ⅱ trial of daily oral perillyl alcohol (NSC 641066) in treatment-refractory metastatic breast cancer. Cancer Chemother Pharmacol, 2008, 62(1): 149–157.
[4]Liston BW, Nines R, Carlton PS, et al. Perillyl alcohol as a chemopreventive agent inN-nitrosomethylbenzylamine-induced rat esophageal tumorigenesis. Cancer Res, 2003, 63(10): 2399–2403.
[5]Meadows SM, Mulkerin D, Berlin J, et al. Phase Ⅱtrial of perillyl alcohol in patients with metastatic colorectal cancer. Int J Gastrointest Cancer, 2002,32(2/3): 125–128.
[6]Wagner JE, Huff JL, Rust WL, et al. Perillyl alcohol inhibits breast cell migration without affecting cell adhesion. J Biomed Biotechnol, 2002, 2(3): 136–140.
[7]Tao LH, Pereira MA. Quantification of carvone,cineole, perilaldehyde, perillyl alcohol and sobrerol by isocratic high-performance liquid chromatography. J Chromatogr A, 1998, 793(1): 71–76.
[8]Jung YA, Row KH. Separation of perillyl alcohol from Korean orange peel by solvent extraction and chromatography. Korean J Chem Eng, 1998, 15(5):538–543.
[9]Jung YA, Row KH. Extraction and purification of perillyl alcohol from Korean orange peel by reversed-phase high-performance liquid chromatography. J Chromatogr A, 1998, 828(1/2):445–449.
[10]Deok KJ, Ho NG, Yong LY, et al. Method of extracting perillyl alcohol from orange peel using supercritical carbon dioxide: KR, 20000060614A.2000-10-16.
[11]Lee YW, Lee CH, Kim JD, et al. Extraction of perillyl alcohol in Korean orange peel by supercritical CO2. Sep Sci Technol, 2000, 35(7):1069–1076.
[12]Li QH, Zhan XX, Feng ZZ, et al. Progress in synthesis of perillyl alcohol. Chem Ind Forest Prod,2007, 27(1): 121–126 (in Chinese).李谦和, 詹小雄, 冯真真, 等. 紫苏醇的合成研究进展. 林产化学与工业, 2007, 27(1): 121–126.
[13]Li HJ, Lan WJ. Biotransformation of limonene by microorganisms. Prog Chem, 2011, 23(11):2318–2325 (in Chinese).李厚金, 蓝文健. 天然单萜柠檬烯的微生物转化.化学进展, 2011, 23(11): 2318–2325.
[14]Huang JQ, Zhu QJ, Mao LC, et al. Advances in perillyl alcohol. Guizhou Agric Sci, 2016, 44(9):109–113 (in Chinese).黄杰秋, 朱秋劲, 茅林春, 等. 紫苏醇的研究进展.贵州农业科学, 2016, 44(9): 109–113.
[15]Dhavalikar RS, Bhattacharyya PK. Microbiological transformations of terpenes. 8. Fermentation of limonene by a soil pseudomonad. Indian J Biochem,1966, 3(3): 144–157.
[16]van der Werf MJ, de Bont JAM. Screening for microorganisms converting limonene into carvone.Stud Org Chem,1998, 53: 231–234.
[17]Feng F. Construction and optimization of the mevalonate pathway inEscherichia colifor production of isoprene[D]. Nanchang: Nanchang University, 2015 (in Chinese).冯凡. 大肠杆菌中MVA途径的构建及其产异戊二烯的研究[D]. 南昌: 南昌大学, 2015.
[18]Sun T, Miao LT, Li QY, et al. Production of lycopene by metabolically-engineeredEscherichia coli.Biotechnol Lett, 2014, 36(7): 1515–1522.
[19]Liu M. Building of a methyl-erythritol-4-phosphate pathway inEscherichia c olifor production of isoprene[D]. Wuhan: Wuhan University of Science and Technology, 2013 (in Chinese).刘敏. 大肠杆菌 MEP途径的构建及其产异戊二烯的研究[D]. 武汉: 武汉科技大学, 2013.
[20]Alonso-Gutierrez J, Chan R, Batth TS, et al.Metabolic engineering ofEscherichia colifor limonene and perillyl alcohol production. Metab Eng,2013, 19: 33–41.
[21]Yang JM, Xian M, Su SZ, et al. Enhancing production of bio-isoprene using hybrid MVA pathway and isoprene synthase inE. coli. PLoS ONE,2012, 7(4): e33509.
[22]Cotter PD, Hill C. Surviving the acid test: responses of gram-positive bacteria to low pH. Microbiol Mol Biol Rev, 2003, 67(3): 429–453.
[23]Elmahdi I, Baganz F, Dixon K, et al. pH control in microwell fermentations ofS. erythraeaCA340:influence on biomass growth kinetics and erythromycin biosynthesis. Biochem Eng J, 2003,16(3): 299–310.
[24]Lou XP, Shen JZ, Cai YJ, et al. Effect of vitamins on production of L-tryptophan inEscherichia coli. JN8.J Food Sci Biotechnol, 2013, 32(9): 921–926 (in Chinese).娄秀平, 沈健增, 蔡宇杰, 等. 维生素对大肠杆菌Escherichia coli.JN8产L-色氨酸的影响. 食品与生物技术学报, 2013, 32(9): 921–926.
[25]Withers ST, Gottlieb SS, Lieu B, et al. Identification of isopentenol biosynthetic genes fromBacillus subtilisby a screening method based on isoprenoid precursor toxicity. Appl Environ Microbiol, 2007,73(19): 6277–6283.
[26]Feng F, Xu Y, Tao Y, et al. Improving isoprene production by engineered heterologous mevalonate pathway inEscherichia coli. Chin J Biotech, 2015,31(7): 1073–1081 (in Chinese).冯凡, 许杨, 陶勇, 等. 提高大肠杆菌通过MVA途径合成异戊二烯. 生物工程学报, 2015, 31(7):1073–1081.
[27]Liu CS, Ding YM, Zhang RB, et al. Functional balance between enzymes in malonyl-CoA pathway for 3-hydroxypropionate biosynthesis. Metab Eng,2016, 34: 104–111.
[28]Dueber JE, Wu GC, Malmirchegini GR, et al.Synthetic protein scaffolds provide modular control over metabolic flux. Nat Biotechnol, 2009, 27(8):753–759.
[29]Redding-Johanson AM, Batth TS, Chan R, et al.Targeted proteomics for metabolic pathway optimization: application to terpene production.Metab Eng, 2011, 13(2): 194–203.

