斜生栅藻对不同形态锑胁迫的响应及抗性研究
陈蔚洁,杨爱江,2,3*,胡 霞,2,李 聪,王 丽
(1 贵州大学 资源与环境工程学院,贵阳 550025;2 贵州大学 环境工程规划设计研究所,贵阳 550025;3 贵州大学 科技园发展有限公司,贵阳 550025)
锑(Sb)是一种非生命必需的元素[1],过去数十年被广泛应用于生产半导体、制造PET(聚对苯二甲酸乙二酯)的催化剂、刹车片、弹药、阻燃剂、医药等行业,有着巨大的市场需求[2]。而中国是世界上主要的产Sb国,约占世界Sb产量的87%[2]。Sb因为其致癌性等各种危害而被欧盟巴塞尔公约列入危险废物[3]。随着Sb在各行各业的大量使用以及Sb矿的大规模开采,大量Sb进入到大气、地表水、地下水和土壤中,严重威胁环境安全[4]。朱静等研究发现湖南锡矿山(世界锑都)矿区的溪流中锑浓度为37~241 μmol/L,远高于中国地表水标准中Sb的含量[5]。伴随环境生物学的发展,重金属形态对各类生物生理生态效应已成为生态毒理学的研究热点。自然环境中锑表现多种价态,但主要为三价化合物[Sb(Ⅲ)]和五价化合物[Sb(Ⅴ)]存在,Sb的毒性与其形态密切相关,与无机锑相比有机锑的毒性相对较弱,其Sb(Ⅲ)的毒性是Sb(Ⅴ)的10倍以上[1]。
藻类是水生生态系统的初级生产者,对水生生态系统的稳定有着重要的作用。因其对有毒物质较敏感、易获得、个体小、易繁殖等一系列的优点,常作为水体污染的测试材料[6]。有研究发现,藻类在重金属离子胁迫下会对其细胞的分裂、光合放氧和细胞膜透性等产生影响[7]。Maeda 等报道,藻类对高浓度Sb具有生物积累作用[8],普通小球藻(Chlorellavulgaris)积累的Sb浓度为12 mg·g-1,其生长状况在高浓度Sb胁迫下并没有受到明显影响,这可能是因为普通小球藻有其独特的解毒机制,即通过将吸收的Sb(Ⅲ)转化为毒性更低的Sb(Ⅴ),进而保护自身细胞安全[9]。光合作用是绿色植物最重要的生命活动[10],高浓度的重金属胁迫会对微藻的光合作用产生影响,造成藻类细胞结构的变化、叶绿体破坏、线粒体损伤,影响植物的光合作用,从而抑制藻细胞生长[11]。Sb对蓝藻(Synechocystissp.)的毒性效应主要体现在对光合系统的影响上,对光合放氧和光系统中电子传递和能量转移等过程产生抑制[12]。斜生栅藻(Scenedesmusobliquus)也因其易培养且对毒物反应敏感等特点常被选作水质评价的指示生物[13-14],本研究主要考察不同浓度Sb(Ⅲ)和Sb(Ⅴ)胁迫下斜生栅藻(自养条件)细胞生长、光合色素含量以及抗氧化酶系统活力等生理方面的变化情况,以便为重金属胁迫下微藻抗性机理提供理论基础。
1 材料和方法
1.1 试验材料
试验主要仪器包括智能人工气候箱(RXZ-500D型,上海圣科设备有限公司)、立式压力蒸汽灭菌锅(LDX-50FBS,上海申安医疗器械厂)、紫外可见光分光光度计(1800PC,上海美普达)、场发射扫描电镜(SIGMA500,德国卡尔蔡司公司)等。本试验中Sb(Ⅲ)和Sb(Ⅴ)分别选用酒石酸锑钾和焦锑酸钾,均为市售分析纯,分别用去离子水配制成终浓度为0、100、200、400、800 μmol/L的锑溶液母液待用;丙二醛(MDA)含量、总超氧化物歧化酶(SOD)活性和过氧化氢酶(CAT)活性测定试剂盒均为南京建成生物工程研究所产品。实验所用斜生栅藻来自中国科学院水生生物研究所淡水藻种库(FACHB-12),用BG-11培养基对栅藻扩大培养[16],选用对数生长期的藻细胞作为实验材料。
1.2 材料培养与处理
1.2.1藻种培养首先对栅藻进行扩大培养,再将对数期的藻接入到500 mL的无菌三角瓶中,并加入不同浓度的Sb(Ⅲ)、Sb(Ⅴ)溶液,使最终藻液体积为200 mL,后用无菌膜对三角瓶进行封口,放置于人工气候箱中。气候箱培养温度设置为(25±1)℃,光照强度为2 000 lx,静置培养。为防止栅藻附着在烧瓶的内壁,每6 h摇动1次。
1.2.2实验处理按照1.2.1所设定的培养条件培养斜生栅藻,Sb(Ⅲ)和Sb(Ⅴ) 各分别设置5个处理浓度水平,分别为0、100、200、400、800 μmol/L(预实验显示斜生栅藻对此浓度范围胁迫响应的差异较为明显),每个浓度水平设置3个平行重复。共计培养8 d,期间每天取样用于测定不同价态锑胁迫下斜生栅藻的生物量、叶绿素a含量的动态变化情况。同时,以BG-11培养基作为对照组(CK),以800 μmol/L Sb(Ⅲ)、Sb(Ⅴ)溶液胁迫处理作为实验组,共计培养8 d,每天取样用于分析丙二醛(MDA)含量及抗氧化酶活性变化情况。
1.3 测定指标及方法
1.3.1生物量藻细胞密度和665 nm处吸光度具有很好的线性关系。因此,每隔24 h取样1次,测定665 nm处光密度(OD665),其生长状况(生物量)以分光光度计测定的光密度值表示(OD665)[21]。
1.3.2叶绿素a含量取培养8 d后1 mL藻液6 000 r/min离心10 min,用95%乙醇重悬浮提取叶绿素,以95%的乙醇为参比,测定上清液在665 nm与649 nm处的吸光度值(A665和A649)。然后,根据以下公式计算叶绿素a含量:
叶绿素a含量(μg/mL)=13.7A665-5.76A649
1.3.3藻液丙二醛(MDA)和抗氧化酶活性取经过800 μmol/L Sb(Ⅲ)、Sb(Ⅴ)溶液胁迫处理8 d后的藻液10 mL,6 000 r/min离心10 min,去掉上层清液,剩余藻泥,在冰浴条件下研磨,用蛋白提取液并在冰浴中提取2 h,制备成酶提取液(50 mmol·L-1磷酸缓冲液)。分别用南京建成生物工程研究所开发的丙二醛(MDA)含量测定试剂盒,以及超氧化物歧化酶(SOD)、过氧化氢酶(CAT)活性测定试剂盒测定各相应成分的含量和活性。
1.3.4Sb胁迫后栅藻微观形貌变化情况取经过100、200、400、800 μmol/L Sb(Ⅲ)、Sb(Ⅴ)溶液胁迫处理8 d后的藻液,6 000 r/min离心10 min,去掉上层清液,剩余藻泥放置冰箱冷冻后,再经冷冻干燥机脱水24 h后,收集藻粉。在2.5%戊二醛中固定2 h,用新鲜配制的0.1 mol/L PBS缓冲液冲洗3次,最后用系列乙醇(脱水剂的乙醇浓度依次为 30%~50%~70%~80%~90%~100%)两次脱水,醋酸异戊酯置换后,CO2临界点干燥,取正常清洗干燥后的栅藻,用导电胶粘于样品台上,喷金,用场发射扫描电子显微镜进行表面观测。
1.4 数据分析
数据统计制图采用Origin7.5软件完成,对叶绿素a含量和抗氧化系统酶活性结果采用SPSS20.0统计软件进行方差分析和组间差异显著性检验。P<0.05为显著性差异,P<0.01为极显著差异。
斜生栅藻的生长抑制率(I)=(1-N/N0)×100;N0为对照组的吸光度,N为实验组的吸光度。
2 结果与分析
2.1 Sb(Ⅲ)和Sb(Ⅴ)胁迫对斜生栅藻生长的影响
Sb(Ⅲ)和Sb(Ⅴ)胁迫处理斜生栅藻生物量随着处理时间整体呈上升趋势(图1)。其中, 在低浓度(100 μmol/L)的Sb(Ⅲ)胁迫下,斜生栅藻生物量在胁迫初期(1~3 d)受到一定的刺激作用,与对照组均表现出逐渐增加的生长趋势,而在随后的胁迫时间内表现出明显抑制;栅藻的生长在200、400和800 μmol/L Sb(Ⅲ)胁迫处理初期就受到极显著抑制(P<0.01),且随着胁迫时间的增加抑制作用表现得更为明显,三者生物量在胁迫第8天时分别为对照组的64.58%、62.25%、57.0%(图1,A)。同时,在Sb(Ⅴ)胁迫处理中,100、200和400 μmol/L浓度处理在实验初期(1~3 d)对栅藻生长产生了一定促进作用,而在随后的胁迫时间内均表现出明显抑制作用;而800 μmol/L Sb(Ⅴ)浓度处理在实验期间(1~8 d) 对栅藻生长整体表现强烈抑制作用(P<0.01),其栅藻生物量在实验第8天时仅为对照组的51.34%(图1,B)。可见,斜生栅藻生长在低浓度Sb(Ⅲ)和中低浓度Sb(Ⅴ) 短期处理下得到促进,而在高浓度Sb(Ⅲ)和Sb(Ⅴ) 长时间胁迫下受到显著抑制,且Sb(Ⅲ)的抑制效应明显强于Sb(Ⅴ)。
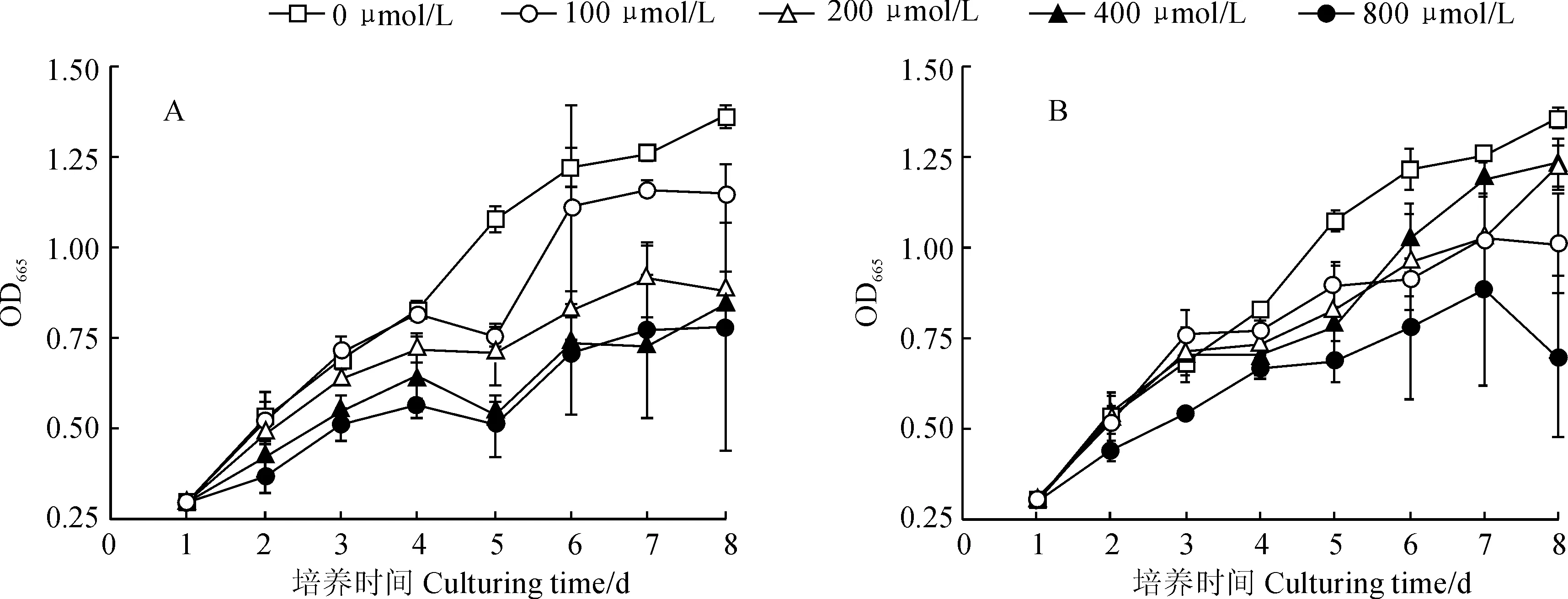
图1 不同浓度Sb(Ⅲ)(A)和Sb(Ⅴ)(B)处理下斜生栅藻生长情况Fig.1 The growth of Scenedesmus obliquus under different concentrations of Sb(Ⅲ) (A) and Sb(Ⅴ) (B)
2.2 Sb(Ⅲ)和Sb(Ⅴ)胁迫对斜生栅藻叶绿素a含量的影响
斜生栅藻叶绿素a含量在100、200、400和800 μmol/L的Sb(Ⅲ)、Sb(Ⅴ)胁迫8 d后变化情况如图2所示。其中,栅藻叶绿素a含量在低浓度时(100 μmol/L) Sb(Ⅲ)和Sb(Ⅴ)胁迫下比对照组(0 μmol/L)略有增加;但在 200、400和800 μmol/L浓度 Sb(Ⅲ)和Sb(Ⅴ)胁迫下,其叶绿素a含量均比对照组明显降低,且胁迫浓度越高降低幅度越大。尤其当Sb(Ⅲ)、Sb(Ⅴ)胁迫浓度为800 μmol/L时,栅藻细胞叶绿素a含量均显著低于对照组,分别为对照组的73.53%和91.37%(P<0.01)。以上结果说明中高浓度的Sb(Ⅲ)和Sb(Ⅴ)胁迫均明显降低了斜生栅藻叶绿素a含量,且浓度越高降幅越大,Sb(Ⅲ)降幅又大于Sb(Ⅴ)。
2.3 Sb(Ⅲ)和Sb(Ⅴ)胁迫对斜生栅藻丙二醛含量和抗氧化酶活性的影响
首先,斜生栅藻丙二醛(MDA)含量随着800 μmol/L Sb(Ⅲ)和Sb(Ⅴ)胁迫时间的延长而呈升高的趋势,并不同程度地高于同期对照组,且胁迫时间越长增幅越大 (图3,A)。其中,Sb(Ⅲ)胁迫处理栅藻MDA含量随胁迫时间增加而逐渐升高,从胁迫起始时的1.125 4 nmol·mg-1升高至第8天的(2.220 4±0.065) nmol·mg-1;与此同时,Sb(Ⅴ)胁迫处理组MDA含量随胁迫时间表现为先上升后下降的变化趋势,并在第6天时达到最大值 (1.987 4±0.021) nmol·mg-1,然后出现下降趋势,在第8天时MDA含量为(1.896 8±0.045)nmol·mg-1,但此时仍显著高于同期对照组(P<0.01)。Sb(Ⅲ)胁迫处理栅藻MDA含量除胁迫处理第3、4天外均不同程度高于Sb(Ⅴ)胁迫组,尤其是胁迫后期表现得更明显(P<0.01)。
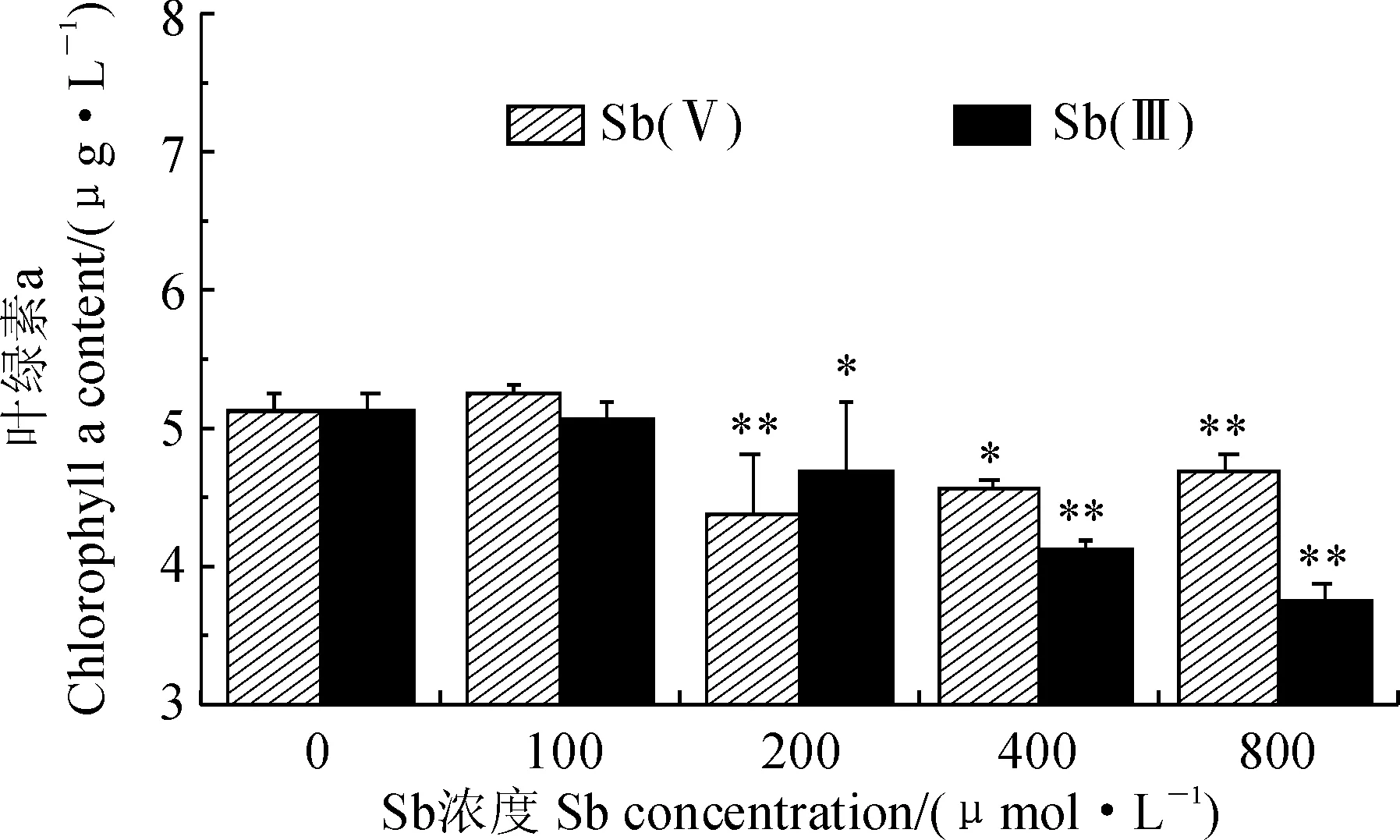
*和**分别表示处理与对照组间在0.05和0.01水平存在显著差异;下同图2 Sb(Ⅲ)和Sb(Ⅴ)胁迫下斜生栅藻叶绿素a含量的变化* and ** indicate significant difference between treatment and control at 0.05 and 0.01 level, respectively; The same as belowFig.2 The chlorophyll a content of S. obliquus under different concentrations of Sb (Ⅲ) and Sb(Ⅴ)
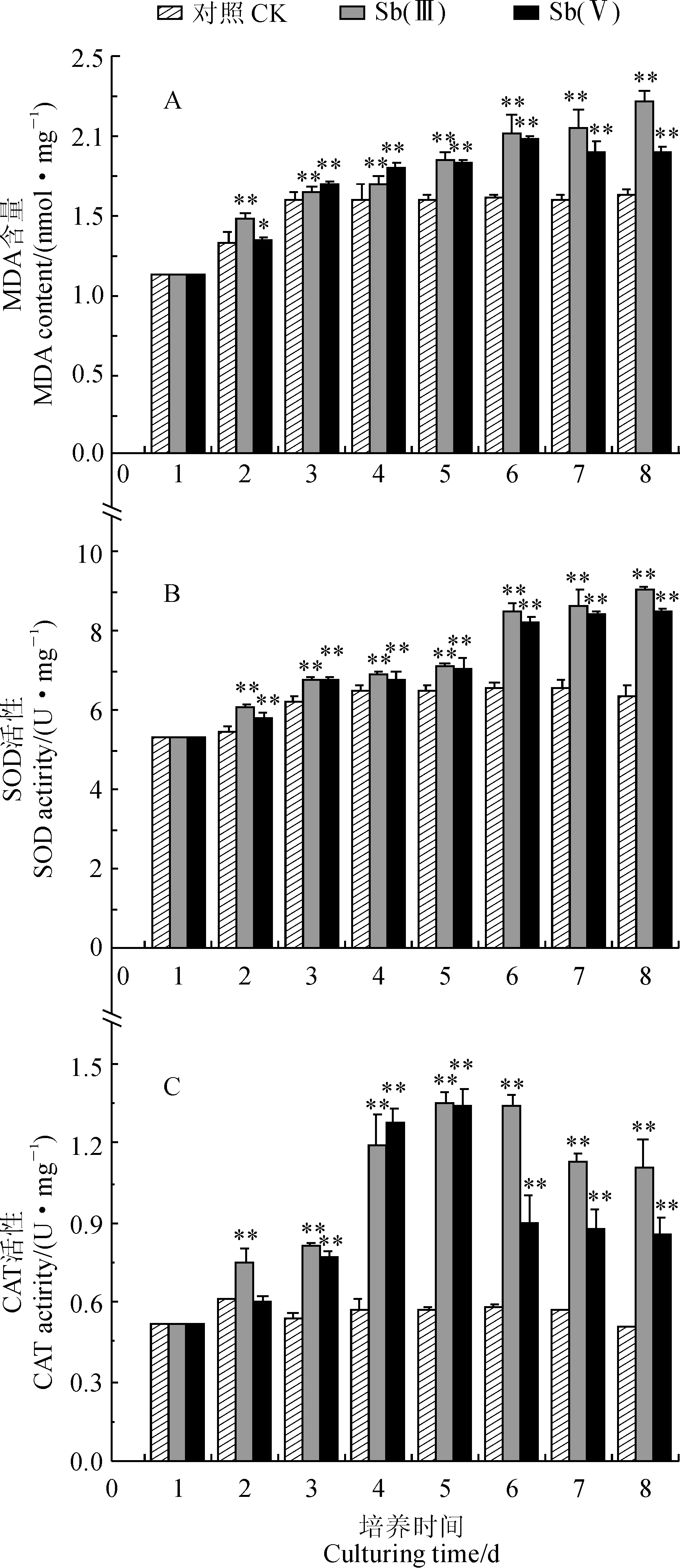
图3 Sb(Ⅲ)和Sb(Ⅴ)胁迫下斜生栅藻丙二醛含量及抗氧化酶活变化Fig.3 MDA content and antioxidant activities of S. obliquus under Sb(Ⅲ) and Sb(Ⅴ) stress
其次,Sb(Ⅲ)和Sb(Ⅴ)胁迫处理组斜生栅藻超氧化物歧化酶(SOD)活性随胁迫时间的增加均表现出逐渐上升趋势,并不同程度地高于同期对照,且处理时间越长差异越大(图3,B)。其中,对照组栅藻SOD活性先从培养初期的5.324 0 U·mg-1快速上升到第4天的(6.485 4±0.19) U·mg-1,随后呈现缓慢上升趋势并趋于平稳,第8天达到 (6.407 2±0.23) U·mg-1;Sb(Ⅲ)胁迫组SOD活性在第1~5天呈缓慢上升趋势,在第7、8天迅速升高,第8天达到最大值(9.033 3±0.086 U·mg-1); Sb(Ⅴ)胁迫组SOD活性也随胁迫时间增加而升高,并在第1~5天增加较缓慢,而在第6~8天增加迅速,第8天时达到最大值(8.507 8±0.093 U·mg-1)。

图4 Sb(Ⅲ)(左)和Sb(Ⅴ) (右)胁迫8 d后斜生栅藻结构变化Fig.4 The superficial structure of S. obliquus stressed with different concentrations of Sb(Ⅲ) (left)and Sb(Ⅴ) (right) after 8 days
再次,随着胁迫时间的延长,Sb(Ⅲ)和Sb(Ⅴ)胁迫处理栅藻CAT活性均呈现先升高后降低的变化趋势,并均在处理第5天达到最大值,而对照组基本在初始值附件上下波动,且处理组大多数时间显著高于同期对照(图3,C)。其中,Sb(Ⅲ)和Sb(Ⅴ)胁迫处理栅藻CAT活性在第5天时分别为(1.351 7±0.062)和 (1.339 8±0.062)U·mg-1,分别是同期对照组的2.34倍和2.33倍 (P<0.01),它们在第8天时分别是对照组的2.23倍和1.68倍(P<0.01)。
2.4 Sb(Ⅲ)和Sb(Ⅴ)胁迫对斜生栅藻表面结构的影响
栅藻表面结构在100、200、400和800 μmol/L的Sb(Ⅲ)、Sb(Ⅴ)胁迫下的表现如图4所示。在浓度为100 μmol/L的Sb(Ⅲ)胁迫下,能观察到少量完整的栅藻细胞个体,其他藻体细胞周边出现出大量的絮状物,且随着Sb(Ⅲ)浓度的增加栅藻细胞表面絮状物不断增多;在400 μmol/L Sb(Ⅲ)胁迫条件下,能清晰观观察到栅藻类细胞破损的情况;当Sb(Ⅲ)浓度为800 μmol/L时,栅藻细胞出现大面积破损,在其表面附着大量絮状物。同时,在100 μmol/L的Sb(Ⅴ)胁迫下,能清晰观察到栅藻个体细胞及周边的鞭毛,生长良好,与同浓度Sb(Ⅲ)胁迫处理的栅藻表面结构相比,栅藻细胞数量更多、结构更加完整;随着Sb(Ⅴ)浓度的增加,栅藻细胞出现溶解破裂的情况。可见,Sb(Ⅲ)和Sb(Ⅴ)不仅对栅藻细胞酶活性影响而且对其细胞结构产生严重的破坏。
3 讨 论
自然环境中锑表现多种价态,但主要为Sb(Ⅲ)、Sb(Ⅴ)存在[17],其价态与生物毒性关系密切[18]。本研究发现, Sb(Ⅲ)和Sb(Ⅴ)对斜生栅藻生长的影响表现在生物量、叶绿素a含量和表面结构多个方面。首先,斜生栅藻生物量在Sb(Ⅲ)、Sb(Ⅴ)胁迫下均表现出在低浓度促进、高浓度抑制的Hormesis效应[19]。相同浓度条件下,栅藻对Sb(Ⅲ)的胁迫响应更加敏感,且随着浓度的增加这一现象更加明显,生物量呈现明显下降趋势。产生这种现象的主要原因是由于Sb(Ⅲ) 毒性高于Sb(Ⅴ)[20]。李妍丽[21]、樊香绒等[22]对As(与Sb同一主族)毒性研究过程中也有相似的发现。其次,本研究中斜生栅藻叶绿素a含量在低浓度的Sb(Ⅲ)和Sb(Ⅴ)胁迫下比对照组略有增加,由于低浓度Sb促进栅藻细胞的生长,从而使得藻栅藻细胞生物量增加,叶绿素a含量随之升高[23]。由于高浓度的Sb(Ⅲ)、Sb(Ⅴ)破坏了藻类细胞的叶绿体[24],其次抑制栅藻生长,叶绿素a含量随之降低。同时还由于Sb(Ⅲ)毒性更强,从而表现出Sb(Ⅲ)对叶绿素a的影响大于Sb(Ⅴ)。另外,本研究还发现高浓度Sb(Ⅲ)、Sb(Ⅴ)胁迫不仅会对栅藻膜的通透性产生严重的损害,还造成细胞内大量的无机盐和有机物外渗,表现为细胞表面有大量絮状物产生,一些细胞出现粘连现象。这主要是由于在Sb(Ⅲ)、Sb(Ⅴ)胁迫下栅藻细胞破裂后产生的碎片等与细胞粘结在一起所致[30]。但在相同的浓度下,Sb(Ⅲ)对栅藻细胞的破坏明显大于Sb(Ⅴ),从微观层面佐证了Karadjova的结论[1]。
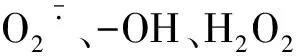
MDA为膜脂质过氧化的产物,可以作为重金属胁迫下藻类氧化压力指标[27]。本研究发现,对照组藻类细胞由于生长环境改变,MDA含量略有增加,但随时间增加栅藻逐渐适应外部环境而MDA含量趋于平稳。实验组中Sb(Ⅲ)和Sb(Ⅴ)胁迫斜生栅藻MDA含量随着胁迫时间增加而上升,表明藻细胞随着Sb(Ⅲ)、Sb(Ⅴ)胁迫时间的增加细胞中活性氧化自由基逐渐升高,栅藻细胞受到不同程度的损伤。在Sb(Ⅲ)胁迫第8 d和Sb(Ⅴ)胁迫第6 d,斜生栅藻MDA含量均极显著高于对照组。由于Sb(Ⅲ)比Sb(Ⅴ)有更强的毒性[1],栅藻对Sb(Ⅲ)胁迫响应更加明显,而这种不利影响随胁迫时间的增加而加强,并在第8天表现得尤为明显。同时,栅藻在Sb(Ⅲ)、Sb(Ⅴ)胁迫下会启动自身的清除活性氧的抗氧化防御系统[28],产生抗氧化酶(SOD、CAT),以维持栅藻细胞体内活性氧代谢的相对稳定。SOD对抵抗重金属胁迫下栅藻产生的氧化自由基和维持栅藻体内的氧化与抗氧化平衡起着至关重要的作用[29]。在Sb(Ⅲ)和Sb(Ⅴ)实验组中,栅藻体内SOD活性在胁迫处理第5~6天迅速增强,表示氧化自由基不断增加[28],在实验后期(第7~8天),由于抗氧化体系抗氧化酶不能及时清除过量的氧自由基,SOD活性出现下降的趋势。CAT是生物体防护机制的中心酶,所有的胁迫都会诱导CAT活性增加。在本研究中Sb(Ⅲ)和Sb(Ⅴ)胁迫处理栅藻CAT活性分别在第4、5 d显著提高,明显高于对照组,表明栅藻为应对氧化压力快速作出抗性反应。但在高浓度和长时间的重金属胁迫下藻类细胞的抗性逐渐减弱直到栅藻细胞死亡,这与刘璐、郐安琪等研究铜绿微囊藻对镉胁迫响应的结果相一致[30-31]。
综上所述,本实验中,低浓度、短时间Sb(Ⅲ)和Sb(Ⅴ)处理对斜生栅藻的生物量、叶绿素a含量有促进作用;但随着胁迫的浓度和时间不断的增加, Sb(Ⅲ)和Sb(Ⅴ)对栅藻的生物量和叶绿素a含量产生抑制作用,且其细胞结构破损也随着浓度的不断增加而更加严重;斜生栅藻在不利的生长环境中,其自身会启动清除活性氧的抗氧化防御系统,诱导增强自身抗氧化酶(SOD、CAT)活性,以维持栅藻细胞体内活性氧代谢的相对稳定。但是,由于斜生栅藻对Sb(Ⅲ) 和 Sb(Ⅴ)胁迫下的抗性过程十分复杂,所以今后将在植物分子蛋白和遗传基因等方面探讨其抗性机理,为深入研究重金属胁迫下微藻的抗性机理奠定基础。
参考文献:
[1] KARADJOVA I B, SLAVEYKOVA V I, TSALEV D L. The biouptake and toxicity of arsenic species on the green microalgaChlorellasalinain seawater[J].AquatToxicol, 2008,87(4): 264-271.
[2] FILELLA M, BELZILE N, CHEN Y,etal. Antimony in the environment: a review focused on natural waters. Ⅱ. Relevant solution chemistry[J].EarthSci.Rev., 2002, 59: 265-285.
[3] MCCALLUM R I. Occupational exposure to antimony compounds[J].JournalofEnvironmentalMonitoring, 2005,7(12): 1 245-1 250.
[4] 吴丰昌, 郑 建, 潘响亮, 等. 锑的环境生物地球化学循环与效应研究展望[J]. 地球科学进展, 2008,23(4): 350-356.
WU F C, ZHENG J, PAN X L,etal. Prospect on biogeochemical cycle and environmental effect of antimony[J].AdvancesinEarthScience, 2008,(4): 350-356.
[5] 朱 静, 吴丰昌, 邓秋静, 等. 湖南锡矿山周边水体的环境特征[J]. 环境科学学报, 2009,29(3): 655-661.
ZHU J, WU F C, DENG Q J,etal. Environmental characteristics of water near the Xikuangshan antimony mine[J].ActaScientiaeCircumstantiae,2009,29: 655-661.
[6] 沈洛夫, 姜建国, 赖凤英. 卤代物对盐藻的毒性试验及比较[J]. 四川环境, 2003,22(2): 17-18.
SHEN L F, JIANG J G, LAI F Y. Test of toxicity of halids toDunaliellasalina[J].SichuanEnvironment, 2003,22(2): 17-18.
[7] OMAR H H. Adsorption of zinc ions byScenedesmusobliquusandScenedesmusquadricaudaand its effect on growth and metabolism[J].InternationalBiodeterioration&Biodegradation, 2002,50(2): 95-100.
[8] MAEDA S, OHKI A. Bioaccumulation and biotransformation of arsenic, antimony, and bismuth compounds by freshwater algae[M]// WANG Y S, TAM N F Y. Wastewater Treatment with Algae. Springer-Verlag and Landes Bioscience, 1998: 73-92.
[9] MAEDA S, FUKUYAMA H, YOKOYAMA E,etal. Bioaccumulation of antimony byChlorellavulgarisand the association mode of antimony in the cell[J].ApplOrganometallicchen, 1997, 11: 393-396.
[10] 欧阳峥嵘, 温小斌, 耿亚红, 等. 光照强度、温度、pH、盐度对小球藻(Chlorella)光合作用的影响[J]. 武汉植物学研究, 2010,28(1): 49-55.
OUYANG Z R, WEN X B, GENG Y H,etal. The effects of light intensities, temperatures, pH and salinities on photosynthesis ofChlorella[J].PlantScienceJournal,2010,28(1): 49-55.
[11] 龚丽丽, 郭晶晶, 许晓明. Cr6+胁迫对莱茵衣藻光合作用的影响[J]. 西北植物学报, 2010,30(6): 1 166-1 172.
GONG L L, GUO J J, XU X M. Photosynthesis ofChlamydomonasreinhardtiiunder Cr6+stress[J].ActaBotanicaBoreali-OccidentaliaSinica,2010,30(6): 1 166-1 172.
[12] ZHANG D, PAN X, MU G,etal. Toxic effects of antimony on photosystem II ofSynechocystissp. as probedbyinvivochlorophyll fluorescence[J].JournalofAppliedPhycology, 2010,22(4): 479-488.
[13] 胡芹芹, 熊 丽, 田裴秀子, 等. 邻苯二甲酸二丁酯(DBP)对斜生栅藻的致毒效应研究[J]. 生态毒理学报, 2008,3(1): 87-92.
HU Q Q, XIONG L, TIAN F X Z,etal. Toxic effects of dibutyl phthalate(DBP) onScenedesmusobliquus[J].AsianJournalofEcotoxicology,2008,3(1): 87-92.
[14] 黄国兰, 戴树桂, 孙红文, 等. 有机污染物对藻类毒性的测定[J]. 环境化学, 1994, (3): 259-262.
HUANG G L, DAI S G, SUN H W,etal. Determination of the toxicity of organic pollutants to algae[J].EnvironmentalChemistry,1994,(3): 259-262.
[15] 吕 芳, 丁 刚, 王翔宇, 等. 鼠尾藻(Sargassumthunbergii)对邻苯二甲酸二甲酯(DMP)胁迫的响应[J]. 海洋与湖沼, 2017,48(2): 336-342.
LÜ F, DIND G, WANG X Y,etal. Response ofSargassumthunbergllto the stress of dimethyl phthalate[J].OceanologiaEtLimnologiaSinica,2017,48(2): 336-342.
[16] 张 丹, 朱晓艳, 温小斌, 等. 微藻培养基平衡pH的研究[J]. 水生生物学报, 2014,38(3): 401-406.
ZHANG D, ZHU X Y, WEN X B,etal. Studies on equilibrim pH values of micro algal medium[J].ActaHydrobiologicaSinica,2014,38(3):401-406.
[17] AMARASIRIWARDENA D, WU F C. Antimony: Emerging toxic contaminant in the enviroent[J].MicrochemicalJournal, 2001,97(1): 1-3.
[18] SMICHOWSKI P. Antimony in the environment as a global pollutant: a review on analytical methodologies for its determination in atmospheric aerosols[J].Talanta, 2008,75(1): 2-14.
[19] CAKMAK I, HORST W J. Effect of aluminium on lipid peroxidation, superoxide dismutase, catalase, and peroxidase activities in root tips of soybean (Glycinemax).[J].PhysiologiaPlantarum, 2006,83(3): 463-468.
[20] 陈秋平, 胥思勤, 安艳玲, 等. 锑矿区土壤As、Sb和Bi的污染与植物累积特征[J]. 贵州农业科学, 2014,42(9): 236-240.
CHEN Q P, XUE S Q, AN Y L,etal. Soil As, Sb and Bi pollution and plant accumulation characteristics in Antimony Mine Area[J].GuizhouAgriculturalSciences,2014,42(9): 236-240.
[21] 樊香绒, 尹黎燕, 李 伟, 等. 不同价态砷对斜生栅藻生长及叶绿素荧光的影响[J]. 水生态学杂志, 2013,34(5): 60-64.
FAN X R, YI L Y, LI W,etal. Effect of arsenic species on the growth and chlorophyll fluorescence characteristics ofScenedesmusobliquus[J].JournalofHydroecology,2013,34(5): 60-64.
[22] 李妍丽, 柯 林. As(Ⅲ)和As(Ⅴ)对小球藻(Chlorellasp.)的生长影响研究[J]. 环境科学与技术, 2012,35(12): 61-64, 70.
LI Y L, KE L. Toxicity of arsenic species on growth of green microalgaeChlorellasp.[J].EnvironmentalScience&Technology,2012,35(12): 61-64, 70.
[23] 李建宏, 浩云涛, 翁永萍. Cd2+胁迫条件下椭圆小球藻的生理应答[J]. 水生生物学报, 2004,28(6): 659-663.
LI J H, HAO Y T, WEN Y P. Physical responses to Cd2+stress inChlorellaellipsoidea[J].ActaHydrobiologicaSinica,2004,28(6): 659-663.
[24] 马广岳, 施国新, 徐勤松, 等. Cr6+、Cr3+胁迫对黑藻生理生化影响的比较研究[J]. 广西植物, 2004,24(2): 161-165.
MA G Y, SI G X, XU Q S,etal. Comparative studies of toxic effect of Cr6+, Cr3+stress on the physiological and biochemical characteristics ofHydrillaverticillata[J].Guihaia,2004,24(2):161-165.
[25] DISCHIA M, COSTANTINI C, PROTA G,etal. Lipofuscin-like pigments by autoxidation of polyunsaturated fatty acids in the presence of amine neurotransmitters: the role of malondialdehyde[J].BiochimicaetBiophysicaActa, 1996,1290(3): 319-326.
[26] 刘卫华, 梁涌涛, 罗贵民, 等. 超氧化物歧化酶与过氧化氢酶的缀合物的制备与性质研究[J]. 化学通报, 1994, 12:36-39.
LIU W H, LIANG Y T, LUO G M,etal. Preparation and characterization of conjugates of superoxide dismutase and catalase[J].Chemistry,1994,12: 36-39.
[27] CAKMAK I, HORST W J. Effect of aluminium on lipid peroxidation, superoxide dismutase, catalase, and peroxidase activities in root tips of soybean (Glycinemax)[J].PhysiologiaPlantarum, 1991,83(3): 463-468.
[28] 于 娟, 唐学玺, 张培玉, 等. CO2加富对两种海洋微绿藻的生长、光合作用和抗氧化酶活性的影响[J].生态学报, 2005,25(2): 197-202.
YU J, TANG X X, ZHANG P Y,etal. Effects of CO2enrichment on growth, photosynthesis and activities of antioxidant enzymes of two marine micro-green-algae[J].ActaEcologicaSinica,2005,25(2): 197-202.
[29] 杨 洪, 黄志勇. 锌胁迫对小球藻抗氧化酶和类金属硫蛋白的影响[J]. 生态学报, 2012,32(22): 7 117-7 123.
YANG H, HUANG Z Y. Activities of antioxidant enzymes and Zn-MT-like proteins induced inChlorellavulgarisexposed to Zn2+[J].ActaEcologicaSinica,2012,32(22): 7 117-7 123.
[30] 刘 璐, 闫 浩, 夏文彤, 等. 镉对铜绿微囊藻和斜生栅藻的毒性效应[J]. 中国环境科学, 2014,34(2): 478-484.
LIU L, YAN H, XIA W T,etal. Toxic effect of cadmium onMicrocysisaeruginosaandScenedesmusobliquus[J].ChinaEnvironmentalScience,2014,34(2): 478-484.
[31] 郐安琪, 赵伟华, 李青云, 龙萌. 铜绿微囊藻对Cd2+胁迫的生理生化响应[J]. 人民长江, 2016,47(16): 20-25.
[32] MICHALAK I, CHOJNACKA K, MARYCZ K. Using ICP-OES and SEM-EDX in biosorption studies[J].MicrochimicaActa, 2011,172(1/2): 65-74.

