5-氨基乙酰丙酸对不同温度下斜生栅藻叶绿素荧光诱导动力学的影响
杨宋琪,韩梓霞,赖金霞,杨生辉,罗光宏
(河西学院,甘肃省微藻工程技术研究中心,甘肃省河西走廊特色资源利用重点实验室,甘肃张掖 734000)
5-氨基乙酰丙酸(ALA)是卟啉、叶绿素及VB12等四吡咯生物合成的中间代谢产物[1],具有多种生物活性[2]。20世纪末,Hotta等[3]发现外源ALA可以提高绿萝(Epipremnumaureum)试管苗叶片光合速率,此后,有学者发现ALA在草莓、西瓜、白菜、萝卜和烟草等高等植物上依然具有光合促进效应[4-6]。尤其在植物处于低温、弱光、高盐度等胁迫条件下,ALA对植物光合作用促进效应更为显著[6-7]。汪良驹等[8]对萝卜叶片研究表明,ALA处理有利于能量进入PSⅡ反应中心,促进光化学效率提高;张春平等也发现,外源ALA能够提高盐胁迫下黄莲叶片的电子传递效率,增大苹果叶片在弱光胁迫下的光合效率,有效缓解逆境的对植物伤害[9-10]。截止目前,添加ALA提高植物抗逆性、增强光合能力的研究多集中在农作物领域,但针对藻类的研究并不多见。然而,在规模化养殖过程中,藻类的生长及光合作用同样受到低温、弱光、盐渍等因子的制约,进而导致养殖期限缩短、藻生物量积累效率低下等。因此,尝试使用外源光合促进剂来提高藻类的光合效率十分必要。近年来,利用叶绿素荧光诱导动力学技术检测藻类光合系统对外界逆境环境因子的响应已有一些研究[11],但针对ALA对藻类抵御胁迫环境的研究尚鲜见报道。因此,笔者首次利用叶绿素荧光技术来探究低温条件下光合促进剂ALA对斜生栅藻荧光特性的影响,进一步了解ALA在藻类耐低温方面的作用机制。
1 材料和方法
1.1 实验材料
斜生栅藻(Scenedesmusobliquus)FACHB-416由中国科学院水生生物研究所藻种库提供。5-氨基乙酰丙酸盐酸盐(aladdin)为白色粉末,纯度99%,由上海晶纯生化科技股份有限公司生产。
1.2 实验处理及藻种培养
实验处理温度共设5、15和25 ℃3个梯度,ALA处理共设置空白对照组(CK)、一次性添加ALA组(ALA)和每3 d添加1次ALA组(C-ALA)3组处理,每次添加剂量均为5 mg/L,共组成9(3×3)个处理组合。将扩大培养至对数期的斜生栅藻分别接种至以上备好的150 mL含ALA新鲜的BG-11培养基中,每个处理3个平行重复,分别置于5、15和25 ℃条件下培养,光照50 μmol·m-2·s-1,光暗比12 h∶12 h,培养期间每天摇动藻液3~4次,共计培养12 d。
1.3 指标的测定与方法
1.3.1斜生栅藻生长曲线及比生长速率每24 h分别取3 mL藻液于紫外-可见分光光度计(Harch-6000)上测定藻液在680 nm处的吸光度(OD680),并记录藻的生长状况。
比生长速率(μ)计算公式为:
μmax=μmax(μ1,μ2,μ3, ...μn)
式中,μ表示斜生栅藻在某一时间段内的比生长速率,μmax表示最大比生长速率,x2表示t2时间的藻类现存量,x1表示t1时间的藻类现存量。
1.3.2叶绿素荧光动力学曲线(OJIP)及JIP-test参数取对数期藻液2.3 mL暗适应20 min后,采用植物效率分析仪(英国汉莎科技有限公司)测定OJIP曲线及荧光参数,测定光强为3 000 μmol·m-2·s-1,最大激发波长650 nm,记录10 μs到2 s叶绿素荧光的变化过程,从而准确记录OJIP等相[10]。参照孙永平等文献[12],设Fo为照光50 μs时荧光(O相)、Fk为300 μs时荧光(K相)、Fj为2 ms时荧光(J相)、Fi为30 ms时的荧光(I相)、Fm为最大荧光(P相)。用Fo-k、Fk-j、Fj-i和Fi-p分别表示放氧复合体(OEC)活性状态、QA被还原能力、QB(含快还原PQ库)被还原能力和慢还原PQ库被还原的能力;其中,Fo-k=(Fk-Fo)/Fo,Fk-j=(Fj-Fk)/Fo,Fj-i=(Fi-Fj)/Fo,Fi-p=(Fm-Fi)/Fo。
同时,根据Strasser等[13]建立的高度简化的能量流动理论模型,分析斜生栅藻PSⅡ单位反应中心能量流动比活性能参数,包括单位反应中心吸收的光能(ABS/RC)、t=0时单位反应中心耗散掉的能量(DI0/RC)、t=0时单位反应中心捕获的用于还原QA的能量(TR0/RC)和t=0时单位反应中心捕获的用于电子传递的能量(ET0/RC)。
1.4 数据处理
实验数据用SPSS 13.0进行单因素方差分析(One Way ANOVA),并用LSD法进行多重比较,使用Origin 9.0软件作图。
2 结果分析
2.1 不同温度下添加ALA对斜生栅藻的生长及比增长速率的影响
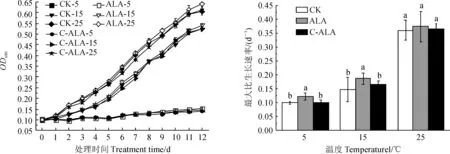
斜生栅藻在3个温度条件下的生长和最大比生长速率结果(图1)显示,当温度为15 ℃和25 ℃时,随着处理时间的增加,斜生栅藻的生物量显著增加(P<0.05);但在5 ℃条件下,斜生栅藻的生长极为缓慢,生物量增幅很小,与接种时差异不显著(P>0.05);处理期间,15 ℃和25 ℃低温处理生物量始终明显大于同期5 ℃低温处理。待培养至稳定期时(培养的第11~12天),一次性添加ALA处理组的斜生栅藻生物量在3个温度条件下均相对较高,但与相同低温下的CK及C-ALA组相比均差异不显著(P>0.05)。
同时,在5 ℃和15 ℃低温处理下,斜生栅藻最大比生长速率(μmax)均表现为ALA组>C-ALA组>CK组;此时,ALA组μmax分别为(0.09±0.00)和(0.12±0.01) d-1,均显著高于相应CK和C-ALA组(P<0.05),分别达到各自CK组的122.7%和126.8%。当温度为25 ℃时,斜生栅藻μmax在添加ALA后虽有一定程度的增长,但与对照相比均差异不显著(P>0.05)。可见,添加ALA不同程度促进了斜生栅藻生长,并以一次性添加ALA效果更好,且在低温5和15 ℃条件下表现得更突出。
2.2 ALA对不同温度条件下斜生栅藻叶绿素荧光诱导动力学曲线的影响
由图2可知,在3个温度环境中,斜生栅藻相对可变荧光在CK组、ALA组和C-ALA组之间差异不显著;但相比于25 ℃和15 ℃处理,斜生栅藻生长在5 ℃条件下受到严重的低温胁迫,其OJIP曲线中出现K相。同时,用Fo-k、Fk-j、Fj-i、Fi-p分别表示氧气释放复合体(OEC)活性状态、QA被还原能力、QB(含快还原PQ库)被还原能力和慢还原PQ库被还原的能力。结果(图3)发现,在5 ℃环境中,ALA组斜生栅藻Fo-k、Fk-j、Fj-i均显著高于CK和C-ALA组(P<0.05);而在15 ℃和25 ℃环境中, ALA组和C-ALA组斜生栅藻Fo-k、Fk-j、Fj-i均与CK组相近,即ALA的添加与否对斜生栅藻这几个荧光参数的影响不大。
CK.对照,不添加ALA;ALA.一次性添加5 mg/L ALA;C-ALA.每隔3 d添加1次5 mg/L ALA;5、15和25分别表示5、15和25 ℃温度处理;相同温度下不同小写字母表示处理间在0.05水平存在显著性差异;下同CK. Control, without ALA ;ALA. One-time spike with 5 mg/L ALA;C-ALA. Every-three-day spike with 5 mg/L ALA; 5, 15 and 25 represent 5, 15 and 25 ℃ treatments, respectively. The different normal letters within the same temperature indicate significant difference at 0.05 level; The same as below
2.3 ALA处理对不同温度下斜生栅藻Fv/Fm和PIABS的影响
图4显示,在15 ℃和25 ℃温度环境下,斜生栅藻PSⅡ最大光化学效率(Fv/Fm)值均在0.70~0.75之间,且ALA、C-ALA和CK组之间差异均不显著(P>0.05);当温度为5 ℃时,斜生栅藻Fv/Fm值下降至0.4以下,且各组均显著低于相应的15和25 ℃处理组(P<0.05)。值得引起注意的是,在5 ℃低温条件下,各添加ALA处理均使得斜生栅藻Fv/Fm值不同程度提高,且一次性添加处理还达到显著水平。说明环境温度越低,添加ALA对促进斜生栅藻抵抗低温效果越显著。
同时,PIABS表示以吸收光能为基础的性能指数,反映PSⅡ整体的功能。图4还显示,随着环境温度降低,斜生栅藻PIABS在CK、ALA和C-ALA组均表现出逐渐显著降低的趋势(P<0.05);与25 ℃处理相比,CK、ALA和C-ALA组斜生栅藻PIABS在5 ℃低温处理中分别下降98.9%、98.4%和98.5%,它们在15 ℃处理中下降幅度较小,下降幅度分别为28.5%、26.1%和28.1%。在同一温度处理下,斜生栅藻PIABS均表现为ALA组>C-ALA组>CK组。其中,在温度为5 ℃环境下,ALA和C-ALA组斜生栅藻PIABS均比CK组获得了显著提升(P<0.05);在15 ℃环境中,仅ALA组PIABS相比于CK组显著增加(P<0.05),而C-ALA组中PIABS虽有所增加但并未达到显著水平;在25 ℃条件下,斜生栅藻PIABS在3个处理之间均差异不显著(P>0.05)。以上结果说明添加ALA对斜生栅藻PSⅡ光合效率的促进效果在温度较低时更加明显。
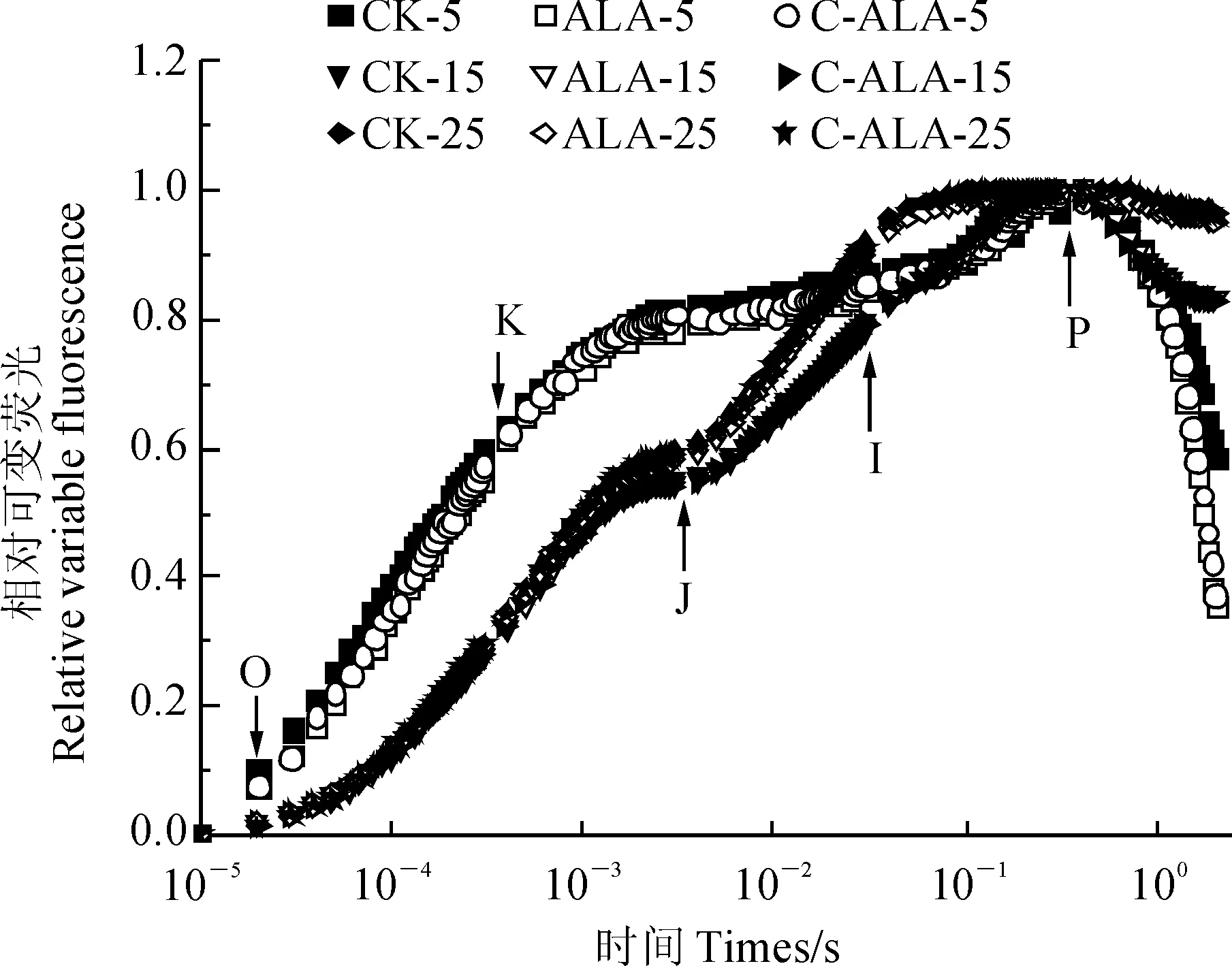
图2 添加ALA后不同温度下斜生栅藻OJIP曲线的变化Fig.2 Changes in the OJIP curves of S. obliquus treated with ALA at different temperature conditions
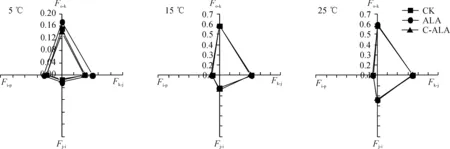
图3 添加ALA后斜生栅藻荧光参数Fo-k、Fk-J、Fj-i、Fi-p的变化Fig.3 Changes in the chlorophyll fluorescence parameters Fo-k, Fk-j, Fj-i, Fi-p of S. obliquus treated with ALA at different temperature conditions

图4 ALA对不同温度下斜生栅藻Fv/Fm和PI ABS的影响Fig.4 Effect of ALA treatment on Fv/Fm and PIABS of S. obliquus under different temperature conditions
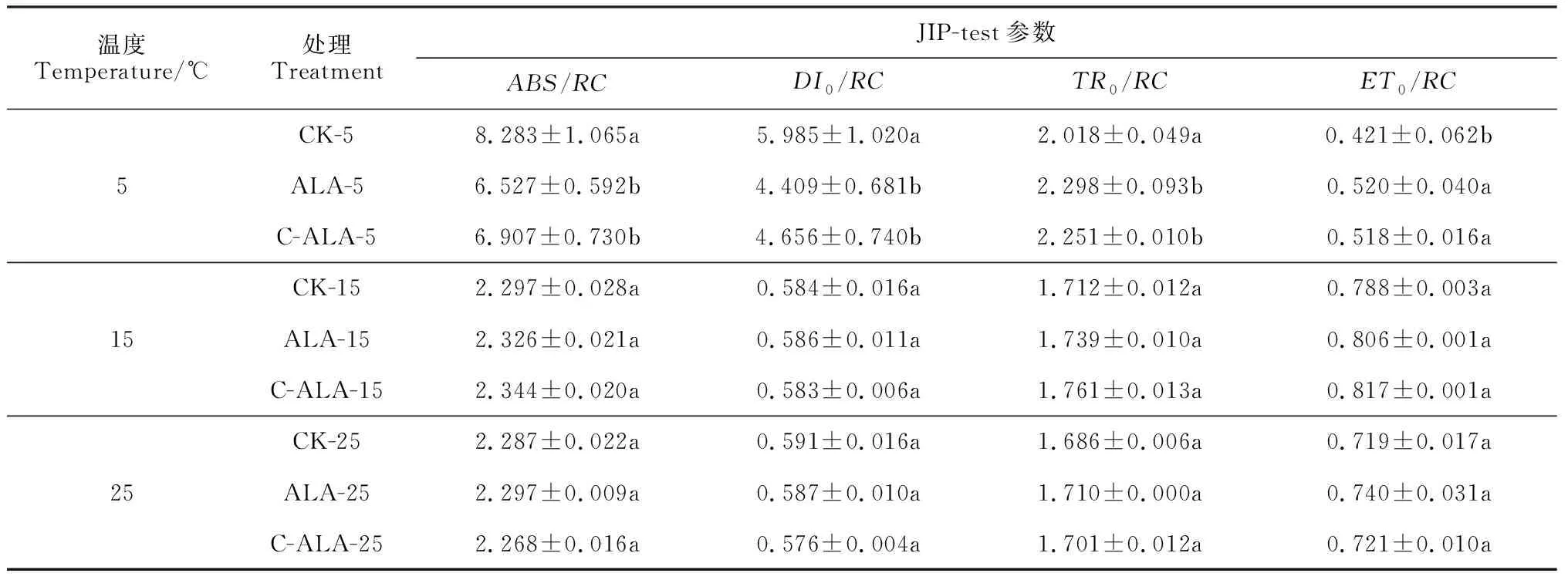
表1 添加ALA后3个温度条件下斜生栅藻JIP-test参数的变化Table 1 Changes in the JIP-test parameters of of S. obliquus treated with ALA at different temperature conditions
2.4 ALA处理对不同温度下斜生栅藻JIP-test参数的影响
在不同温度处理条件下,添加ALA后斜生栅藻单位反应中心吸收的光能(ABS/RC)、单位反应中心捕获的激发能用于还原QA的能量(TR0/RC)、单位反应中心捕获的光能用于电子传递的能量(ET0/RC)和单位反应活性中心耗散掉的能量(DI0/RC)的变化情况如表1所示。在15 ℃和25 ℃条件下,两种ALA添加方式处理的斜生栅藻ABS/RC、TR0/RC、ET0/RC和DI0/RC与对照组相比均没呈现出显著差异(P>0.05);然而,当温度为5 ℃时,添加ALA处理的斜生栅藻ABS/RC和DI0/RC均显著低于对照组(P<0.05),而它们的ET0/RC和TR0/RC相比于对照组反而显著增加(P<0.05),但各参数在两添加处理间无显著差异。以上结果说明在15和25 ℃时,斜生栅藻PSⅡ反应中心及电子供体侧和受体侧的生理状态没有因ALA的添加与否而呈现出显著差异;但在5 ℃低温时,斜生栅藻活性反应中心负担加重,耗能效率提高,最终导致光合能力的降低。
3 讨 论
施用ALA使得农作物耐弱光、低温和盐渍的能力获得显著提升,农作物产量得到相应提高[6, 9-10]。然而,关于ALA对藻类抗逆性机制的研究极为少见。Carothers研究发现,添加ALA能够增强钝顶螺旋藻(Spirulinaplatensis)光系统Ⅰ与光系统Ⅱ的活性,进而促进藻的生长[14];李亚界研究发现,在25 ℃环境培养时,一定浓度范围的ALA可明显促进小球藻的生长,使得其生物量显著提高[15]。然而本研究却发现,在25 ℃环境条件下,ALA组和C-ALA组虽然使得斜生栅藻生物量和μmax略高于CK组,但差异不显著(P>0.05);但当温度为15 ℃和5 ℃时,ALA添加使得斜生栅藻μmax获得了显著提升(P<0.05),分别达到各自对照组的122.7%和126.8%,暗示ALA能够在一定程度上促进斜生栅藻的生长,且在低温下促进作用更加显著。
叶绿素荧光诱导动力学可以快速、简便、无损伤地检测植物在逆境条件下光能的吸收、传递、能量耗散及光化学反应等光合性能情况[16]。因此,该技术被形象地称为植物光合作用研究的探针[17]。Strivastava研究表明,PSⅡ供体侧受伤害时,水裂解系统及放氧复合体(OEC)受损,从而导致OJIP曲线K相(约300 ms处特征位点)出现,此时OJIP曲线则变为OKJIP曲线[18]。本研究中斜生栅藻OJIP曲线测定结果显示,5 ℃低温使得斜生栅藻光系统遭受严重胁迫,OJIP曲线的K相出现,即低温使得斜生栅藻OEC受损。同时,从Fo-k、Fk-j、Fj-i、Fi-p4个参数的计算结果来看,ALA组Fo-k、Fk--j、Fj-i、Fi-p仅在5 ℃时显著高于CK组,又说明ALA处理使得斜生栅藻QA、QB被还原的能力以及PQ库被慢还原的能力获得显著提升[12]。
PSⅡ最大光化学效率(Fv/Fm)指所有PSⅡ反应中心处于开放状态时的量子产量,能反映PSⅡ的功能,该指标在一般情况下较为稳定,但当处于胁迫环境时会显著降低[19]。PIABS反映PSⅡ整体的功能,只要PSⅡ部分受到伤害,PIABS就能够反映出来,在植物处于逆境中时,PIABS的反应比Fv/Fm更为敏感,因而常用PIABS来快速筛选抗逆品种[20]。本研究发现,与25 ℃处理相比,斜生栅藻Fv/Fm和PIABS这两个指标在5 ℃的低温条件下均急剧下降,而在15 ℃环境中斜生栅藻Fv/Fm值与25 ℃相近,但此时其PIABS值下降更为明显。这一方面可以说明低温胁迫会使得斜生栅藻光系统Ⅱ受限,另一方面说明PIABS比Fv/Fm能够更加灵敏的检测出斜生栅藻受低温胁迫的程度。在同一温度条件下,添加ALA对15 ℃和25 ℃条件下斜生栅藻的Fv/Fm和PIABS影响不大,却使5 ℃环境下斜生栅藻Fv/Fm和PIABS均获得了大幅提升。说明在一定温度范围内,环境温度越低,ALA对斜生栅藻PSⅡ保护作用越显著,该结果与康琅等研究结果一致[21]。
藻类PSⅡ反应中心及电子供体侧和受体侧的生理状态能够通过JIP-test进行定量分析[20, 22]。本研究JIP-test结果显示,环境温度为15 ℃和25 ℃时,添加ALA对斜生栅藻JIP-test参数均没有显著影响;而在环境温度为5 ℃时,ALA的添加使得斜生栅藻ABS/RC和DI0/RC显著降低,ET0/RC和TR0/RC显著增加。可见,低温时ALA处理使得斜生栅藻单位反应中心吸收的光能降低,热耗散也减少,更多的能量通过电子传递链传递并参与光化学反应,这一结论与孙永平等研究结果是一致的[12],进一步说明了ALA在低温下对斜生栅藻光系统的保护作用更为明显。
另外,ALA在一定程度上可以促进斜生栅藻的生长,可能因为斜生栅藻生长与ALA浓度存在一定的剂量关系,使得连续添加组ALA对斜生栅藻生长的促进作用不够明显。截止目前,有学者研究发现ALA浓度对植物生长呈现先升后降的“N”形或“M”型曲线[15, 23],其可能原因是ALA在低浓度时作为叶绿素合成前体物质而促进光合作用,而在较高浓度时促进植物细胞呼吸作用降低细胞增长速率[3]。本研究发现类似结果,即连续添加ALA后斜生栅藻生物量与一次添加没有显著差异,且光合效率有所降低,生长效果相对较差。但即便如此,在较低温度条件下,一次添加ALA处理斜生栅藻最大比生长速率依然获得显著提升,说明该物质对斜生栅藻的促进作用具有一定潜力;叶绿素荧光诱导动力学分析结果表明,在3个温度环境中,温度越低,ALA对斜生栅藻光合系统的保护作用越明显。
参考文献:
[1] 王俊卿, 张肇铭. 5-氨基乙酰丙酸的光动力应用研究进展[J]. 微生物学通报, 2004,31(3): 136-140.
WANG J Q, ZHANG Z M. Biotechnological production and applications of 5-aminolevulinic acid [J].MicrobiologyChina, 2004,31(3): 136-140.
[2] AKRAM N A, ASHRAF M. Regulation in plant stress tolerance by a potential plant growth regulator, 5-aminolevulinic acid [J].JournalofPlantGrowthRegulation, 2013,32(3): 663-679.
[3] HOTTA Y, TANAKA T, TAKAOKA H,etal. New physiological effects of 5-aminolevulinic acid in plants: the increase of photosynthesis, chlorophyll content, and plant growth [J].JournaloftheAgriculturalChemicalSocietyofJapan, 1997,61(12): 2 025-2 028.
[4] 程菊娥, 肖启明, 成飞雪, 等. 5-氨基乙酰丙酸对温室烟草的光合作用及抗逆性的促进效应[J]. 湖南农业科学, 2007,(4): 58-60.
CHENG J E, XIAO Q M, CHENG F X,etal. Promote effect of 5-aminolevulinic acid on photosynthesis and cold resistance of tobacco in indoor temperature [J].HunanAgriculturalSciences, 2007,(4): 58-60.
[5] 刘卫琴. 5-氨基乙酰丙酸对草莓和萝卜叶片光合作用及叶绿素荧光特性的影响[D]. 南京:南京农业大学, 2005.
[6] 汪良驹, 姜卫兵, 黄保健. 5-氨基乙酰丙酸对弱光下甜瓜幼苗光合作用和抗冷性的促进效应[J]. 园艺学报, 2004,31(3): 321-326.
WANG L J, JIANG W B, HUANG B J. Promotion of photosynthesis by 5-aminolevulinic acid (ALA) during and after chilling stress in melon seedlings grown under low light condition[J].ActaHorticulturaeSinica, 2004,31(3): 321-326.
[7] 康 琅, 程 云, 汪良驹. 5-氨基乙酰丙酸对秋冬季大棚西瓜叶片光合作用及抗氧化酶活性的影响[J]. 西北植物学报, 2006,26(11): 2 297-2 301.
KANG L, CHENG Y, WANG L J. Effects of 5-aminolevulinic acid (ALA) on the photosynthesis and anti-oxidative enzymes activities of the leaves of greenhouse watermelon in summer and winter[J].ActaBotanticBoreal-OccidentSinica, 2006,26(11): 2 297-2 301.
[8] 汪良驹, 刘卫琴, 孙国荣, 等. ALA对萝卜不同叶位叶片光合作用与叶绿素荧光特性的影响[J]. 西北植物学报, 2005,25(3): 488-496.
WANG L J, LIU W Q, SUN G R,etal. Effects of 5-aminolevulinic acid on photosynthesis and chlorophyll fluorescence of radish seedlings [J].ActaBotanticBoreal-OccidentSinica, 2005,25(3): 488-496.
[9] 张春平, 周 慧, 何 平,等. 外源5-氨基乙酰丙酸对盐胁迫下黄连幼苗光合参数及其叶绿素荧光特性的影响[J]. 西北植物学报, 2014,34(12): 2 515-2 524.
ZHANG C P, ZHOU H, HE P,etal. Effect of exogenous 5-aminolevulinic acid on photosynthesis and chlorophyll fluorescence characteristics ofCoptischinensisFranch. seedlings under NaCl stress [J].ActaBotanticBoreal-OccidentSinica, 2014,34(12): 2 515-2 524.
[10] 安玉艳, 张丽颖, 冯新新,等. 5-氨基乙酰丙酸对苹果叶片耐弱光能力的影响[J]. 西北植物学报, 2016,36(5): 987-995.
AN Y Y, ZHANG L Y, FENG X X,etal. Effect of 5-aminolevulinic acid on low light tolerance of apple leaves [J].ActaBotanticBoreal-OccidentSinica, 2016,36(5): 987-995.
[11] KRAUSE G H, WEIS E. Chlorophyll fluorescence and photosynthesis: the basics [J].AnnualReviewofPlantPhysiology, 1991,42(42): 313-349.
[12] 孙永平, 张治平, 徐呈祥,等. 5-氨基乙酰丙酸处理对低温下西瓜叶片快速叶绿素荧光诱导曲线的影响[J]. 园艺学报, 2009,36(5): 671-678.
SUN Y P, ZHANG Z P, XU C X,etal. Effect of ALA on fast chlorophyll fluorescence induction dynamics of watermelon leaves under chilling stress[J].ActaHorticulturaeSinica, 2009,36(5): 671-678.
[13] STRASSER B J, STRASSER R J. Measuring fast fluorescence transients to address environmental questions: The JIP test[M]//In: Mathis P. editor.Photosynthesis:fromlighttobiosphere. Dordrecht: Kluwer Academic Publishers, 1995: 977-980.
[15] 李亚界, 吴绵斌, 林建平,等. 5-氨基乙酰丙酸对小球藻生长及油脂积累的影响[J]. 浙江大学学报(工学版), 2014,3(48): 535-540.
LI Y J, WU M B, LIN J B,etal. Effect of 5-aminolevulinic acid onChlorellagrowth and lipid accumulation[J].JournalofZhejiangUniversity(Engineering Science), 2014,3(48): 535-540.
[16] 李 晓, 冯 伟, 曾晓春. 叶绿素荧光分析技术及应用进展[J]. 西北植物学报, 2006,26(10): 2 186-2 196.
LI X, FENG W, ZENG X C. Advances in chlorophyll fluorescence analysis and its uses[J].ActaBotanticBoreal-OccidentSinica, 2006,26(10): 2 186-2 196.
[17] GENTY B, BRIANTAIN J M, BAKER N R. The relationship between the quantum yield of photosynthetic electron transport and quenching of chlorophyll fluorescence [J].BiochimicaetBiophysicaActa(BBA) -GeneralSubjects, 1989,990(1): 87-92.
[18] STRIVASTAVA A, STRASSER R J. Stress and stress management of land plants during a regular day [J].JournalofPlantPhysiology, 1996,148(3-4): 445-455.
[19] PARKHILL J, MAILLET G, CULLEN J J. Fluorescence-based maximal quantum yield for PSII as a diagnostic of nutrient stress[J].JournalofPhycology, 2001,37(4): 517-529.
[20] APPENROTH K J, STCKEL J, SRICASTACA A,etal. Multiple effects of chromate on the photosynthetic apparatus ofSpirodelapolyrhizaas probed by OJIP chlorophyll a fluorescence [J].EnvironmentalPollution, 2001, 115: 49-64.
[21] 康 琅, 汪良驹. ALA对西瓜叶片叶绿素荧光光响应曲线的影响[J]. 南京农业大学学报, 2008,31(1): 31-36.
KANG L, WANG L J. Effect of ALA treatments on light response curves of chlorophyll fluorescence of Watermelon leaves [J].JournalofNanjingAgriculturalUniversity, 2008,31(1): 31-36.
[22] STRASSER R J, SRICASTAVA A, GOVINDJEE. Polyphasic chlorophyll alpha fluorescence transient in plants and cyanobacteria [J].PhotochemistryandPhotobiology, 1995, 61: 32-42.
[23] 汪良驹, 石 伟, 刘 晖,等. 外源5-氨基乙酰丙酸处理对小白菜叶片的光合作用效应[J]. 南京农业大学学报, 2004,27(2): 34-38.
WANG L J, SHI W, LIU H,etal. Effect of exogenous 5-aminolevulinic acid treatment on leaf photosynthesis ofpak-choi[J].JournalofNanjingAgriculturalUniversity, 2004,27(2): 34-38.

