乙醇引起大鼠低温反应与支配棕色脂肪组织交感神经放电变化的关系*
刘 欣,卜 舒, 胥建辉, 杨永录△
1.成都医学院 体温与炎症四川省高校重点实验室(成都610500); 2.兰州大学第一医院 重症医学科(兰州730000)
酒及酒精性饮料是全球消费最广泛的饮品之一。但众所周知,适量饮酒能促进血液循环,具有养生保健的作用[1];而过量或长期饮酒不仅可严重影响身体健康,且能引起痴呆、肝硬化、乳腺癌和消化道癌等许多疾病[1-2]。另外,给人和动物应用乙醇也能明显降低正常体温,其机制可能与乙醇能抑制体内棕色脂肪组织(brown adipose tissue, BAT)生热作用有关[3-8]。BAT是婴幼儿、成人以及啮齿类动物在冷环境中机体产热的主要来源,并参与维持能量代谢平衡和体温恒定[9-10]。支配BAT交感神经末梢释放的去甲肾上腺素通过激活BAT细胞内的肾上腺素能受体使其产热增加[9-10]。但目前关于乙醇对皮肤散热作用的报道结果并不一致[5-6,8]。因此,本实验用无线遥控测温技术观察乙醇对正常大鼠体核温度(core temperature, Tc)、BAT温度(BAT temperature, TBAT)和尾部皮肤温度(tail skin temperature, Tsk)的影响,并应用电生理技术观察乙醇引起大鼠支配BAT交感神经放电活动的变化,旨在证明乙醇引起大鼠低温是否与其能抑制BAT交感神经活动和提高尾部皮肤散热有关。
1 材料与方法
1.1 动物与试剂
实验动物为成都达硕生物医学科技有限公司提供的SPF级SD雄性大鼠(3~4月龄)65只,体质量220~300 g。实验用无水乙醇购自于美国Sigma公司,腹腔注射前30 min用0.9%的生理盐水将其稀释成20%的溶液,置于35 ℃的恒温水浴加热器中备用。
1.2 实验方法
1.2.1 腹腔和肩胛间区植入无线遥测温度传感器 术前用1%聚维酮碘溶液浸泡手术器械和无线遥测传感器60 min,用 4%戊巴比妥钠溶液(40 mg/kg)腹腔注射麻醉动物,剃去大鼠腹部与肩胛间区皮肤手术部位的鼠毛,然后用1%聚维酮碘溶液消毒手术部位的皮肤,手术方法同以往的实验[7]:首先将DSI公司生产的双探头遥测传感器(model TA10TA-F40-TT)植入大鼠腹腔,然后往肩胛间区BAT下埋置遥测温度探头,并用缝合线固定温度探头以防移位。为预防手术后感染,肌肉注射青霉素2×104U,让动物恢复7~9 d以上进行实验。
1.2.2 大鼠尾部皮温的测量 实验前一天下午将遥控测温传感器(model TA10TA-F20) 固定于大鼠尾部背侧距离根部1.5 cm处,让动物进行适应性过夜,第二天上午7∶00 开始连续测量尾部的皮温[11]。
1.2.3 实验分组与观察 实验分为对照组(生理盐水)和乙醇组,每组的例数见图1~3。用DSI遥测系统测量大鼠Tc、TBAT和Tsk。为了让动物适应实验环境,实验前一天下午将动物称体质量后,移入实验所需要的22 ℃或10 ℃人工实验环境气候箱中进行适应过夜,并让动物处于自由活动、进食和进水状态。人工气候箱内开灯和关灯的时间设置为12∶12 h,分别于上午6∶00 开灯与下午6∶00 关灯。实验当天上午7∶00开始记录大鼠Tc、TBAT和Tsk,10∶00往大鼠腹腔注射20%乙醇溶液(3 g/kg)或等容量生理盐水[7],连续观察大鼠Tc、TBAT和Tsk8 h。
1.2.4 记录BAT交感神经放电活动的方法 用17%氨基甲酸乙酯和1%氯醛糖混合液(5 mL/kg)腹腔麻醉大鼠,在肩胛区正中线切开约2 cm的纵向切口,用玻璃分针分离肩胛区下BAT的交感神经,并防止牵拉损伤神经。神经分离后,用细线结扎外周端,在靠近结扎处的外周端将其剪断。具体手术方法见笔者以前的实验[12]。用成都泰盟科技有限公司生产的BL-420S生物机能实验系统记录神经放电,观察腹腔注射生理盐水或乙醇溶液(3 g/kg)对支配BAT交感神经放电活动的影响。
1.3 统计学方法

2 结果
2.1 乙醇对热中性环境中大鼠Tc、TBAT和Tsk变化的影响
腹腔注射乙醇前,大鼠的平均Tc和TBAT分别为(36.54±0.17)℃和(35.63±0.15)℃, TBAT比Tc平均低0.91 ℃。上午10∶00腹腔注射乙醇后能快速引起Tc和TBAT降温反应。注射1.5 h后 Tc和TBAT分别平均降低到(35.16±0.35)℃(△T为-1.38 ℃;n=7,t=4.851,P<0.001)和(34.57±0.24)℃(△T为-1.06 ℃;n=7,t=3.808,P=0.005;图1A)。注射乙醇6 h后,Tc和TBAT逐渐恢复到给药前的基线水平(图1A)。对照组注射生理盐水前Tc和TBAT与乙醇组给药前相似,注射生理盐水后Tc和TBAT只出现轻度的应激性升高,大约50 min后恢复到基线水平(图1B)。
注射乙醇前大鼠Tsk变化范围为(29.72 ± 0.54)℃~(30.33 ± 0.70)℃,与对照组比较差异无统计学意义 (P>0.05,图1C)。有趣的是乙醇也能快速引起大鼠Tsk降低,注射乙醇1 h后Tsk降低到(24.95±0.83)℃(△T 为-4.55℃;n=6,t=5.308,P<0.001),这种低温反应约持续3 h (图1C);然后逐渐恢复,注射乙醇后6.5 h后恢复到基线水平(图1C)。对照组给生理盐水后,只能轻微引起短暂的Tsk降低反应 (图1C)。

图1 22 ℃环境中乙醇对大鼠体核温度(Tc)和BAT温度(TBAT)及尾部皮肤温度的影响
2.2 乙醇对较低环境中大鼠Tc、TBAT和Tsk变化的影响
将大鼠置于10 ℃环境温度中,腹腔注射乙醇前,Tc和TBAT与22 ℃热中性环境中的动物比较差异无统计学意义(P>0.05,图2A~2B)。上午10∶00腹腔注射乙醇后,Tc和TBAT分别出现快速降温反应(△T分别为-2.41 ℃和-1.58 ℃),其降温反应均明显大于22 ℃环境中Tc和TBAT的降温效应,Tc和TBAT分别较22 ℃环境中的低0.99 ℃和0.5 ℃(图2A~2B)。
在10 ℃环境中,注射乙醇前大鼠的Tsk变化范围为(22.65 ± 1.60)℃~(23.75 ± 0.72)℃,平均较22 ℃环境中的Tsk低6.9 ℃(图2C)。注射乙醇1.5 h后大鼠Tsk快速降到(16.31±0.89)℃[△T 为(-8.2 ± 0.83)℃(图2C)];其降温作用明显大于22 ℃环境温度中的动物(n=6,t=5.408,P<0.001);低温反应约持续4 h (图2C);然后逐渐恢复,注射乙醇7 h后恢复到基线水平(图2C)。

图2 不同环境温度(Ta)对乙醇引起大鼠Tc和TBAT及Tsk变化的影响
2.3 乙醇对支配BAT交感神经放电活动的影响
对照组和乙醇组动物在注射生理盐水和乙醇前,支配BAT交感神经自发放电频率差异无统计学意义(P>0.05);腹腔注射20%乙醇后,支配BAT交感神经的放电频率出现快速降低反应,给药60 min后放电频率平均降低达63%(n=7,t=3.885,P=0.005),然后逐渐出现恢复,到给乙醇后150 min放电恢复给药前80%(图3A~3B)。对照组动物注射生理盐水后,其放电频率无明显变化,与给药前相比差异无统计学意义(P>0.05,图3C)。
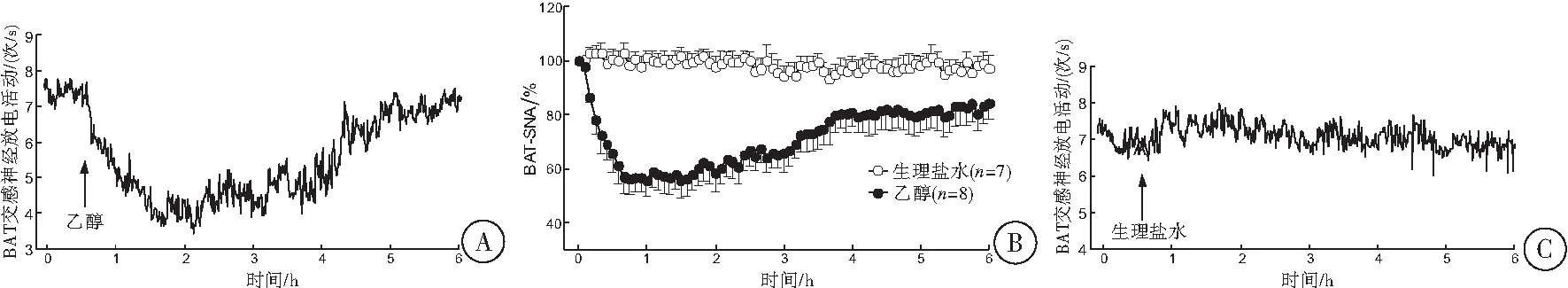
图3 腹腔注射乙醇对支配大鼠BAT交感神经放电活动(BAT-SNA)的影响
3 讨论
乙醇可引起啮齿类动物出现明显的调节性低温反应[3,13]。实验证明,给人服用乙醇后也能引起调节性低温反应[3,13]。本研究用无线遥控测温技术同步观察乙醇对大鼠Tc和TBAT的影响,腹腔注射乙醇能引起中性环境温度(22 ℃)和较低环境温度(10 ℃)中大鼠Tc明显降低,并伴有TBAT明显降低反应(图1~2),表明乙醇引起的低温反应与其抑制BAT产热有关,因为BAT温度的变化是反映BAT产热的一个重要指标[14]。需要指出是,在10 ℃环境中,乙醇对Tc和TBAT降温效应更明显,可能与其进一步抑制BAT的产热有关。实验也证明,环境温度降低能促进乙醇的降温作用,提示当乙醇中毒患者来自较低的环境温度时,要注意是否伴有低温现象。在10 ℃环境中,注射乙醇前大鼠的Tc和TBAT分别与22 ℃环境中同时间动物的Tc和TBAT比较差异无统计学意义(P>0.05)(图2A~2B),这是当环境温度发生变化时,机体具有维持体温恒定的调节机制[15]。
BAT产热作用可维持体温恒定和能量代谢平衡[10]。本实验显示,正常大鼠TBAT较Tc低0.91 ℃,这一结果与笔者以往的研究结果一致[14]。这是由于肩胛间区的BAT位于机体较表浅的皮下,有利于热量散失,使其温度较体核温度低[14]。机体处于低温状态下,能使交感神经兴奋引起去甲肾上腺素释放增加,通过线粒体内膜的分子标志蛋白解偶联蛋白1(UCP1)将脂肪酸氧化与ATP的产生解偶联,导致能量直接以热能形式散失而不生成ATP,使BAT以产热的形式释放能量[6,17]。为进一步研究乙醇的降温机制,本实验用电生理实验技术观察了乙醇对支配BAT交感神经放电活动的影响。给大鼠腹腔注射乙醇能引起BAT交感神经放电频率明显降低,其持续时间达150 min(图3B~3C)。实验表明,乙醇引起正常体温降低反应与其能抑制支配BAT的交感神经活动而导致BAT产热减少有关,因为BAT产热作用受交感神经活动的控制[16-17]。
机体散热主要通过皮肤血流量变化进行调控。大鼠的尾部是主要的散热器官,虽然大鼠尾部的皮肤面积只占全身总体表面积的7%,但在中性环境温度中,大鼠体内的热量大约25%经尾部皮肤血管扩张散失[3,11]。关于乙醇引起低温与皮肤散热的关系,由于以往实验方法和条件不同,有关研究结果也不同[8]。所以,本研究用无线遥控技术研究了乙醇引起大鼠Tc降低与大鼠尾部皮温变化的关系。有趣的是在热中性环境中(22 ℃),乙醇能引起大鼠尾部皮温显著降低反应。为进一步确定乙醇对Tsk的影响,笔者又观察了乙醇对10 ℃环境温度中大鼠尾部Tsk的影响。实验结果表明,乙醇不仅能明显促进10 ℃环境温度中大鼠尾部Tsk的降低反应,且Tsk降低反应明显大于22℃环境中反应(图2C)。这里需要指出的是,本研究使用无线遥控测温技术,让动物处于无任何干扰的生理条件下,获得的实验结果证明,乙醇不能提高大鼠尾部皮肤散热反应。乙醇引起Tsk降低可能与大鼠尾部血管收缩使血液运输到皮肤的热量减少有关。以往的报道,乙醇引起低温伴有Tsk升高使散热增加的现象,可能与人工测量尾部温度导致动物应激反应而影响了实验结果的准确性有关。本实验也显示,在10 ℃环境温度中,正常大鼠尾部Tsk较22 ℃环境温度中的Tsk降低约8 ℃,这种现象与环境温度降低引起皮肤血管收缩,皮肤血流量减少有关[3]。
本实验用无线遥控测温技术研究的结果证明,乙醇不仅能引起正常体温降低,且环境温度低于热中性温度区时能促进乙醇引起的低温反应,为临床乙醇中毒患者在低温环境中出现低体温现象提供了有趣的实验依据。乙醇引起大鼠低温效应的机制,除与乙醇能启动行为性体温调节活动和引起体内5-羟色胺增多有关外[18],还与其降低BAT交感神经活动而导致BAT产热减少有关。实验结果不支持乙醇引起低温反应伴有尾部皮肤散热增加的现象,因为乙醇不仅能明显降低热中性环境中大鼠的尾部Tsk,而且随着环境温度的降低乙醇降温作用更明显。
[1]Grφnbaek M. The positive and negative health effects of alcohol-and the public health implications[J]. J Intern Med, 2009, 265(4): 407-420.
[2]Verster J C, Penning R. Treatment and prevention of alcohol hangover[J]. Curr Drug Abuse Rev, 2010, 3(2): 103-109.
[3]Gordon C J. Response of the thermoregulatory system to toxic insults[J]. Front Biosci (Elite Ed), 2010, 2: 293-311.
[4]Westerman A T, Roma P G, Price R C,etal. Assessing the role of the medial preoptic area in ethanol-induced hypothermia[J]. Neurosci Lett, 2010, 475(1): 25-28.
[5]Yoda T, Crawshaw L I, Saito K,etal. Effects of alcohol on autonomic responses and thermal sensation during cold exposure in humans[J]. Alcohol, 2008, 42(3): 207-212.
[6]Taylor A N, Tio D L, Bando J K,etal. Sex differences in ethanol-induced hypothermia in ethanol-na ve and ethanol-dependent/withdrawn rats[J]. Alcohol Clin Exp Res, 2009, 33(1): 60-69.
[7]昝旺, 杨永录, 王诚, 等. 乙醇引起大鼠低温反应与棕色脂肪组织产热变化的关系[J]. 医学研究杂志, 2013, 42(10): 65-68.
[8]Freund B J, O’brien C, Young A J. Alcohol ingestion and temperature regulation during cold exposure[J]. Journal of Wilderness Medicine, 1994, 5(1): 88-98.
[9]Mund R A, Frishman W H. Brown adipose tissue thermogenesis: β3-adrenoreceptors as a potential target for the treatment of obesity in humans[J]. Cardiol Rev, 2013, 21(6): 265-269.
[10] Morrison S F, Madden C J. Central nervous system regulation of brown adipose tissue[J]. Compr Physiol, 2014, 4(4): 1677-1713.
[11] Gordon C J, Puckett E, Padnos B. Rat tail skin temperature monitored noninvasively by radiotelemetry: characterization by examination of vasomotor responses to thermomodulatory agents[J]. J Pharmacol Toxicol Methods, 2002, 47(2): 107-114.
[12] Yang Y L, Liu X, Luo R,etal. Sinoaortic denervation attenuates vasopressin-induced hypothermia and reduction of sympathetic nerve activity innervating brown adipose tissue in rats[J]. J Therm Biol, 2017, 66: 10-16.
[13] Yoda T, Crawshaw L I, Nakamura M,etal. Effects of alcohol on thermoregulation during mild heat exposure in humans[J]. Alcohol, 2005, 36(3): 195-200.
[14] Yang Y L, Wang N, Song H X,etal. Simultaneous telemetric monitoring of the circadian changes in core and BAT temperature in rats: Endogenous vasopressin may contribute to reduced BAT themogenesis and body temperature in the light phase of the circadian cycle[J]. J Therm Biol , 2012, 37(4): 316-322.
[15] 杨永录. 体温与体温调节生理学[M]. 北京:人民军医出版社, 2015: 73-149.
[16] Mund R A, Frishman. Brown adipose tissue thermogenesis: β3-adrenoreceptors as a potential target for the treatment of obesity in humans[J]. Cardiol Rev, 2013, 21(6): 265-269.
[17] Streitparth F, Walter A, Stolzenburg N,etal. MR-guided periarterial ethanol injection for renal sympathetic denervation: a feasibility study in pigs[J]. Cardiovasc Intervent Radiol, 2013, 36(3): 791-796.
[18] 杨永录, 昝旺, 卜舒, 等. 5-HT1A受体阻断剂对乙醇引起大鼠低体温和行为性体温调节反应的影响[J]. 中国应用生理学杂志, 2017, 33(1): 26-30.

