玫瑰转录因子RrMYB10的克隆及表达分析
邹 凯,李忠健,李政宏,赵兰勇,徐宗大
(山东农业大学林学院,山东 泰安 271018)
花青素(Anthocyanins)是植物组织呈色的重要非光合色素,决定花、果实、种子的颜色[1-2]。在高等植物中,花青素的合成由苯丙烷途径中类黄酮合成途径完成[3],研究表明植物通过合成酶和蛋白来调控花青苷的合成,而MYB、WD40和bHLH三类转录因子是这些酶和蛋白合成过程中的主要转录因子,三者组成三元复合体来调控花青苷的合成和积累[4-5]。其中,R2R3-MYB转录因子在植物花青苷合成的中起着重要的作用,前人研究结果表明,在月季[6]、金鱼草[7]、拟南芥[8]以及葡萄[9]中,R2R3-MYB 转录因子对花青苷的合成起着至关重要的作用。
玫瑰(Rusa rugosa)为蔷薇科蔷薇属的一种落叶灌木,观赏价值高,芳香四溢,在园林造景中具有重要作用[10]。玫瑰花色单一是制约玫瑰应用的主要问题,玫瑰花色主要为玫红色、粉色、白色,鲜见其他花色。所以,克隆玫瑰花瓣中有关调控花青苷的基因,对阐明玫瑰花瓣中花色苷的调控机理,进而改变玫瑰的花色具有重要意义。
1 材料与方法
1.1 试验时间和地点
试验于2016年4月至2017年1月在山东农业大学南校花卉实验基地及花卉研究室进行。
1.2 试验材料
试验材料为玫瑰品种 ‘紫枝’(Rosa rugosa‘Zizhi’)、‘白紫枝’(Rosa rugosa‘Baizizhi’)以及‘粉紫枝’(Rosa rugosa‘Fenzizhi’),于 2016 年 4 月-5月份选取生长势强,花色稳定单株,采集花瓣经液氮处理后,于-80℃冰箱中保存备用。
1.3 试验方法
1.3.1 基因克隆
玫瑰花瓣参照改良CTAB法[11]以及EASYspin植物RNA快速提取试剂盒的说明书提取其总RNA于用-80℃冰箱中保存备用,运用紫外分光光度法检测所提取RNA的纯度和浓度。将浓度及参数符合要求的RNA参照abm反转录试剂盒说明书反转录合成cDNA第一链。根据玫瑰花瓣转录组数据,查找得到目的基因的RrMYB10的部分cDNA序列,根据所得序列设计特异性引物[20]:
RrMYB10 F:5’ -ATGGAGGGTTTCGGCGTGAGA-3’
RrMYB10 R:5’ -CAACCCAGAAGTTTGTAAAGAAGTCG-3’
以上一步合成的cDNA为模板,用设计的特异性引物PCR扩增目的基因。PCR反应体系为:灭菌ddH2O 9.5ul、2×EasyTaqSuperMix 12.5?l、 目的基因上下游引物各 1?l、模板cDNA 1ul,总计25ul。PCR反应条件为:94℃预变性 5min;94℃变性 30s,56℃退火 30s,72℃延伸 1min,35 个循环,72℃保温 10min。将PCR产物经1%的琼脂糖凝胶电泳检测,紫外灯下参照Magen胶回收试剂盒说明书回收目的条带,将目的条带连接到PMD18-T载体上,转化大肠杆菌后送华大测序。
3’RACE扩增,根据测序得到目的基因的cDNA序列,设计巢式PCR基因特异性引物[20],进行巣式PCR扩增:
RrMYB10-1:5’-ATGGAGGGTTTCGGCGTGAGA-3’
RrMYB10-2:5’-ACTTCTTTACAAACTTCTGGG-3’;
B26:5’ -GACTCTAGACGACATCGATTTTTTT TTTTTTTTTT-3’。
将浓度及参数符合要求的RNA参照abm反转录试剂盒说明书反转录合成cDNA第一链。以上一步合成的cDNA为模板,用设计的特异性引物进行巣式PCR扩增。第一轮PCR:引物RrMYB10-1与B26做第一轮PCR的引物,PCR反应体系同上,反应条件为 94℃预变性 5min;94℃变性 30s,58℃退火30s,72℃延伸 1min,35 个循环,72℃保温 10min。第二轮PCR:引物RrMYB10-2与B26作为第二轮PCR引物,第一轮PCR产物稀释100、500、700倍作模板,反应体系同上,反应条件为94℃预变性5min;94℃变性 30s,56℃退火 30s,72℃延伸 1min,35 个循环,72℃保温10min。将PCR产物经1%的琼脂糖凝胶电泳检测。参照Magen胶回收试剂盒说明书回收目的条带,将目的条带连接PMD18-T载体上,转化大肠杆菌后送华大测序。
1.3.2 生物信息学分析
利用NCBI中的Blast比对软件对目的基因的氨基酸序列进行同源性分析,利用DNAMAN软件对目的基因和其他物种的氨基酸序列进行多重比对分析;利用ExPasy服务器中在线软件ProtParam对目的基因进行理化性质预测;通过NCBI中在线软件CD-Search对目的基因的保守域进行预测;利用在线软件SOPMA对目的基因编码的蛋白进行二级结构预测;利用在线软件NetPhos 3.1Serve和NetOGLyc 4.0 Server对目的基因编码的蛋白进行磷酸化位点、糖基化位点和信号肽进行预测;利用在线软件TMpred对目的基因编码蛋白进行跨膜结构域的预测;利用MEGA5.0构建RrMYB10的系统树。
1.3.3 构建表达载体
根据RrMYB10的测序结果,除去终止子,设计分别含有NcoI和BstEII酶切位点的引物[20]。
RrMYB10 NF:5’-CCCATGGCCATGGAGGGTTT CGGCGTGAGA-3’
RrMYB10 BR:5’-CACGTGGTCAACGACTAGA TCATGGC-3’
以反转录得到的cDNA为模板,PCR扩增得到带有酶切位点的目的条带,其扩增产物通过NcoI和BstEII双酶切后,利用SolutionI将同样双酶切的pc1304载体与双酶切后的扩增产物在16℃条件下连接4h,连接产物转化大肠杆菌感受态细胞DH5α,筛选阳性克隆,送华大进行测序验证得到构建好的表达载体pc1304-RrMYB10。
2 结果与分析
2.1RrMYB10的克隆
以玫瑰花瓣cDNA为模板,扩增得到643bp的cDNA序列,通过3’RACE扩增后得到251bp的一段cDNA序列,两者经过拼接后得到871bp的cDNA序列全长 (图2),利用DNAMAN对RrMYB10的碱基序列进行分析,发现其包括完整的开放阅读框 (ORF),含有起始密码子ATG和终止密码子TAG,开放阅读框长度699bp,编码232个氨基酸,含有polyA尾巴(图1)。经过NCBI中blastx比对显示,该基因与其他物种中MYB10的基因序同源性蛋白。构成RrMYB10蛋白的232个氨基酸中,一共包括20中氨基酸,其中亮氨酸(Leu)所占比例最大为 9.4%;其次是赖氨酸(Lys)和甘氨酸(Gly),所占高,故将基因命名为RrMYB10。

图1 RrMYB10基因的cDNA序列及氨基酸序列Fig.1 RrMYB10 cDNA nucleotide sequence and the deduced amino acid sequence
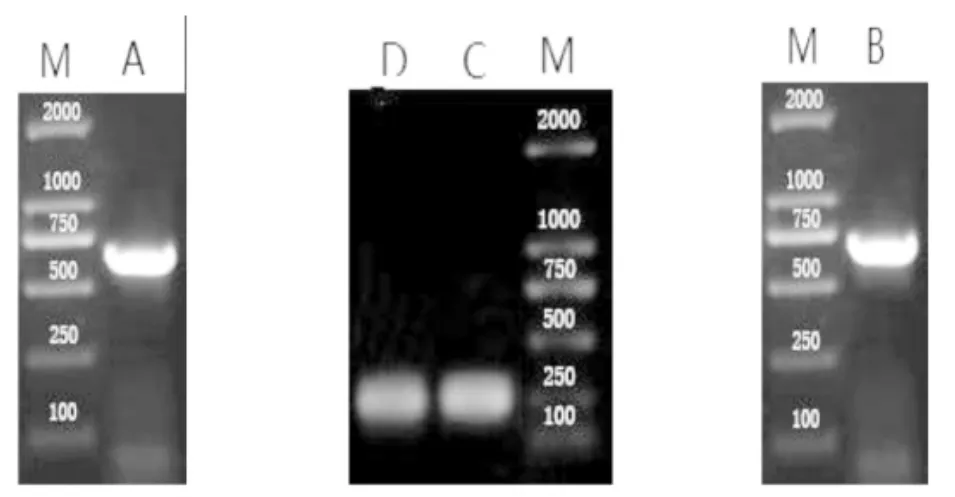
图2RrMYB10基因的扩增Fig.2 PCR amplification of RrMYB10
2.2 RrMYB10生物信息学分析
2.2.1 蛋白基本理化性质分析
RrMYB10编码232个氨基酸,利用在线软件ProtParam分析表明,RrMYB10蛋白的分子式为C1230H1904N348O356S6,相对分子质量为27455.13Da,原子总数为3844个,等电点pI=9.01,该蛋白不稳定系数为42.31(>40),所提推测出该蛋白为碱性不稳定比例都是8.2%;所占比例最小的氨基酸是半胱氨酸(Cys)和蛋氨酸(Met),所占比例均为 1.3%。利用在线软件ProtScale预测RrMYB10蛋白的疏水性,疏水性最大值为1.400,最小值为-3.189,平均疏水指数为-0.762,说明该蛋白偏亲水蛋白。利用NCBI中在线软件CD-Search对RrMYB10蛋白进行分析表明该蛋白含有Myb的保守域,序列在5’端22-165位具有pfam00249结构域,属于MYB的保守结构域(图 3)。

图3 RrMYB10基因编码蛋白保守结构预测Fig.3 Prcdicts conservative structure domain of RrMYB10
经在线软件SOPMA分析,发现RrMYB10蛋白的二级结构以α-螺旋(Alpha helix)和无规则卷曲(Random coil)为主,其数量和所占比例分别为95个(40.77%)和 76个(32.62%);其次是延伸链(Extended strand)和 β-转角(Beta turn),其数量和所占比例分别为 41个(17.60%)和 21个(9.01%)(图 4)。
经在线软件NetPhos 3.1 Server分析,发现4.0Server分析,发现RrMYB10蛋白无糖基化位点,N端没有发现信号肽。经在线软件TMHMM分析RrMYB10蛋白的跨膜结构与,发现RrMYB10蛋白无跨膜结构域。
2.2.2 蛋白序列同源性及系统发育分析

图4 RrMYB10基因蛋白二级结构预测Fig.4 Predication of secondary structure of RrMYB10

图5RrMYB10与其它物种MYB蛋白序列对Fig.5 Multiple alignment of theRrMYB10 with other MYB
根据NCBI中blast比对结果,选择同源性较高的野草莓(Fragaria vesca)78% 、梅(Prunus mume)62%、甜樱桃(Prunus avium)62%以及桃树(Prunus RrMYB10基因编码的蛋白中,含有15个Ser磷酸化位点,15个Thr磷酸化位点,8个Tyr磷酸化位点,这些磷酸位点的存在说明该蛋白在可逆磷酸化调控中具有一定的作用。经在线软件NetOGLyc persica)62%进行多重序列比对,比对结果如图,结果表明RrMYB10蛋白具有MYB保守结构域(图5)。

图6 RrMYB10与其它物种MYB蛋白系统进化树分析Fig.6 The phylogenetic tree derived from the alignment of amino acid secquences of RrMYB10 and other MYB
为了进一步探究RrMYB10蛋白与其他植物中MYB蛋白的亲缘关系,从Blast比对的结果中选取了野草莓、梅、甜樱桃在内的13个物种的氨基酸序列,利用MEGA5构建系统进化树[12]。结果表明玫瑰先与同科的草莓、野草莓最先聚合,说明在进化上玫瑰与草莓亲缘关系最近,接着与同科的苹果、沙梨聚合为一个亚类,再与其他科物种聚合,说明,同科的植物之间亲缘关系近,与不同科的其他植物亲缘关系远(图6)。
2.3 RrMYB10载体构建
为了明确RrMYB10蛋白的功能,将构建好的载体pc1304-RrMYB10利用液氮速冻法转化到农杆菌GV3101中,将转化的农杆菌配制成侵染液侵染拟南芥,计划后续进行转基因功能验证。
3 结论与讨论
MYB家族是植物生命体中最为重要的转录因子家族之一,参与调控植物生长发育、生理代谢的各个方面[13]。R2R3-MYB主要参与植物次生代谢、细胞分化以及各种胁迫的调控[14]。本研究通过RTPCR以及RACE技术从玫瑰花瓣中分离得到了一个R2R3-MYB基因,该基因包含完整的开放阅读框699bp,编码232个氨基酸,其蛋白分子式为C1230H1904N348O356S6,相对分子质量为27455.13Da,等电点 pI为 9.01,该蛋白不稳定系数为 42.31(>40),为不稳定蛋白。
花青素属于类黄酮类物质,也是植物组织着色的重要代谢产物[15]。Vimolmangkang等[16]发现超量表达苹果R2R3型Md MYB3促进烟草的花青素苷和黄酮醇的合成,使转基因烟草的花色变深。赵佳[6]等发现R2R3型 RhMYBs4-1和 RhMYBs6-1蛋白均可能促进花青苷的合成,本文研究所得到RrMYB10蛋白聚类分析发现与已报到的野草莓(ABX79948.1)、梅花(XP_008244325.1)以及甜樱桃(AJB28496.1)等聚为一类,而这些MYB均有典型的R2R3结构,说明RrMYB10也具有典型的R2R3结构。
近几年的研究过程中,植物中花青素的合成与其相关调控的转录因子的研究有了一定进展。Khar[17]等发现不同植物体内花青素的合成受到不同调控位点以及转录因子的控制;谢吉容等[18]发现R3型的MYB蛋白基因RhMYB1在粉红色花瓣中的表达比黄色花瓣高,李军[19]等发现在桑树花青素的合成调控过程中,不同的MYB蛋白是有正负调控之分的。故本研究所克隆的RrMYB10只能确定其与花青素的调控有关,其具体作用还需要进行转基因功能验证。
[1]Ogata J,Kanno Y,Itoh Y,et al.Plant biochemistry:anthocyanin biosynthesis in roses[J].Nature,2005,435:757-758.
[2]Buer C S,Imin N,Djordjevic M A.Flavonoids:new roles for oldmolecules [J].Journal of Integrative Plant Biology,2010,52:98-111.
[3]Kose R,Verweij W,Quattrocchio F.Flavonoids:a colorful model for the regulation and evolution of biochemical pathways [J].Trends in Plant Science,2005,10(5):236-242.
[4]Hichri I,Barrieu F,Bogs J,et al.Recent advances in the transcriptional regulation of the flavonoid biosynthetic pathway [J].Journal of Experimental Botany,2011,62:2465-2483.
[5]Katsumoto Y,Fukuchi-Mizutani M,Fukui Y,et al.Engineering of the rose flavonoid biosynthetic pathway successfully generated blue-hued flowers accumulating delphinidin [J].Plant and Cell Physiology,2007,48:1589-1600.
[6]赵佳,刘荣,杨帆,等.月季花青素苷相关R2R3-MYB蛋白基因的克隆和表达分析[J].中国农业科学,2015,48(7):1392-1404.
[7]Schwinn K,Venail J,Shang.A small family of MYB-regulatory genes controls floral pigmentation intensity and patterning in the Genus Antirrhinum [J].Plant Cell,2006,18(4):831-851.
[8]Mehrtens F,Kranz H,Bednarek P,et al.The Arabidopsis transeription factor MYB12 is a flavonol-specific regulator of phenylpropanoid biosynthesis [J].Plant Physiol,2005,138(2):1083-1096.
[9]Bogs J,Jaffe FW,Takos AM,et al.The Grapevine transcription factor VvMYBPA1 regulates proanthocyanidin synthesis during fruit development [J].Plant Physiol,2007,143(3):1347-1361.
[10]齐宇.玫瑰查尔酮合酶CHS基因的克隆及生物信息学分析[J].农学学报,2015,5(11):91-96.
[11]冯立国,李婷林,陈陈等.玫瑰花组织总RNA提取方法研究[J].扬州大学学报,
[12]张剑亮,潘大仁,周以飞.观赏向日葵花青素苷合成途径同源基因的克隆与表达[J].园艺学报,2009,36(1):73-80.
[13]陈俊,王宗阳.植物 MYB 类转录因子研究进展[J].植物生理与分子生物学学报,2002,28(2):81-88.
[14]许志茹,李春雷,崔国新,等.植物花青素合成中的MYB 蛋白[J].植物生理学通讯,2008,44(3):597-598.
[15]刘仕芸,黄艳岚,张树珍.植物花青素生物合成中的调控基因[J].植物生理学通讯,2006,42(4):747-754.
[16]Vimolmangkang S,Han Y,Wei G,et al.An apple MYB transcription factor Md MYB3 is involved in regulation of anthocyanin biosynthesis and flower develop-2013,34(4):105-107.ment[J].BMC Plant Biology,2013,13:176.
[17]Khar A,Jakse J,Havey MJ.Segregations for onion bulb colors reveal that red is controlled by at least three loci[J].J Am Soc Hort Sci,2008,133(1):42-47.
[18]谢吉容,熊运海,程在全,等.月季 MYB基因 c DNA全长克隆和表达分析.中国农业科学,2008,41(12):4173-4179.
[19]李军,赵爱春,刘长英,等.桑树花青素合成相关MYB类转录因子的鉴定与功能分析 [J].西北植物学报,2016,36(6):1110-1116.
[20]任亮,朱宝芹,张轶博,等.利用软件 Primer Premier 5.0进行PCR引物设计的研究[J].锦州医学院学报,2004,25(6):43-46.

