农业害虫对螺虫乙酯抗性的研究进展
钱雨农,叶 鑫,王圣印
(浙江农林大学农业与食品科学学院,浙江杭州 311300)
螺虫乙酯(spirotetramat)是由拜耳公司(Bayer)开发的一类新型内吸性杀虫、杀螨剂[1],于2011年在大陆地区取得正式登记,与螺螨酯(spirodiclofen)及螺甲螨酯(spiromesifen)同属季酮酸类化合物[2-3],与之具有相似的化学结构和作用机制[4],对粉蚧、蚜虫、飞虱等刺吸式口器害虫也具有良好的药效[5-6],并且适用于包括棉花、大豆、柑橘、果树、马铃薯、蔬菜等在内的多种作物[7]。螺虫乙酯在进入植物体内后,会迅速水解成螺虫乙酯烯醇(spirotetramat-enol)[1],其结构式见图1,该化合物具有双向传导能力,能同时保护植株新生叶片及其根系。
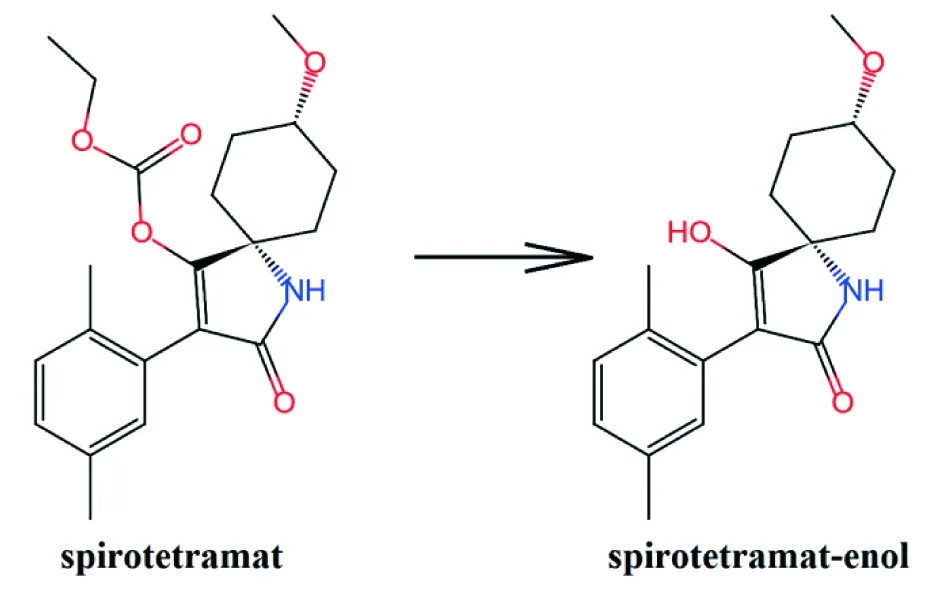
图1 螺虫乙酯及螺虫乙酯-烯醇结构式[13]Fig.1 Structures of spirotetramat and spirotetramat-enol
螺虫乙酯作为乙酰辅酶A羧化酶的抑制剂(Acetyl CoA carboxylase,ACC),能通过抑制ACC活性,干扰生物的脂肪酸生物合成,达到杀灭害虫的目的。在昆虫及螨中,ACC为单基因编码的多结构域酶[8-9],是脂肪酸生物合成的关键酶及限速酶,催化乙酰辅酶A(acetyl-CoA)形成丙二酸单酰辅酶A(malonyl-CoA)[10]。ACC作为农药的作用靶标,最初用于杂草的防治[11-12]。螺虫乙酯与这一类除草剂具有相似的作用位点与方式,能通过作用于ACC的羧基转移功能域(carboxyl transferase domain),从而抑制ACC的催化活性[13]。笔者主要介绍了目前田间害虫对螺虫乙酯抗性的研究进展。
1 抗性监测
自螺虫乙酯登记使用以来,在田间多用于防治粉蚧、粉虱、红蜘蛛等农业害虫,国内外针对药剂靶标害虫开展了一系列抗性监测研究。
Ouyang等[14]研究发现加利福尼亚州的圣华金河谷地区柑橘全爪螨(Panonchuscitri)卵及若虫对螺虫乙酯还未表现出抗性。王然等[15]监测了湖北烟粉虱(Bemisiatabaci)种群对螺虫乙酯的抗药性,发现田间种群均已出现了低水平的抗性,认为褐飞虱在连续药剂压力作用下有产生抗性的潜在风险。Peng等[16]对中国多地不同寄主上的Q型烟粉虱进行取样,发现从2012年开始烟粉虱卵及若虫已逐渐产生对螺虫乙酯的抗性,到2016年抗性达到中等至极高水平。De等[17]分析了澳大利亚多个地区桃蚜(Myzuspersicae)对螺虫乙酯抗药性,测定的品系中未发现对该药剂敏感性的变化。Voudouris 等[18]调查发现,希腊中部及北部桃园中桃蚜也未对螺虫乙酯产生抗性。可见,螺虫乙酯在多数地区仍对害虫有效,但具有抗性发生的风险。虽然在螺虫乙酯抗性未发展的地区,利用该药剂代替敏感性较差的其他类药剂进行害虫防治是一种比较可行的方法,但鉴于目前已有螺虫乙酯抗耐药性且田间害虫抗药性逐渐加重的报道,因此急需对该药剂的使用进行规范严格管理,以延缓抗药性的产生。
2 交互抗性
ACC作为螺虫乙酯的作用靶标,与传统的杀虫剂具有靶标的异质性,因此具有较低的交互抗性风险。Guillén等[19]对柑橘全爪螨的研究表明,螺虫乙酯对氟丙菊酯、甲硫威、伐虫脒、多杀菌素均无交互抗性。Hu等[20]研究发现,福州、重庆等地柑橘园内柑橘全爪螨从2006年开始逐渐出现对季酮酸类药剂螺螨酯的抗药性,并且对螺虫乙酯表现出低水平抗性。由于上述试验样本的收集早于螺虫乙酯在田间投入使用的时间,该抗性的产生表明螺虫乙酯与螺螨酯之间很可能存在交互抗性[20]。Yu等[21]、Demaeght等[9]通过抗性筛选,同样证明了螺虫乙酯与另一类季酮酸类药剂螺甲螨酯存在交互抗性。上述结果表明,螺虫乙酯与同属季酮酸类的其他杀虫剂由于具有相似的作用位点,存在交互抗性风险较大。除此之外,螺虫乙酯与田间常用于防治烟粉虱与扶桑绵粉蚧(Phenacoccussolenopsis)的多种药剂(如吡虫啉、氟啶虫胺腈、灭多威、乙酰甲胺磷、氟氯氰菊酯、氰戊菊酯、毒死蜱、丙溴磷及联苯菊酯)均存在中低水平的交互抗性风险[15],而对氰戊菊酯、联苯菊酯及阿维菌素具有高水平的交互抗性[22-23]。螺虫乙酯最初的抗性报道来自于害螨对该药剂的抗药性,螨类是季酮酸类另外2种杀螨剂螺螨酯及螺甲螨酯的主要防治对象,而这2类药剂在田间的使用时间均早于螺虫乙酯,因此害虫对螺虫乙酯最初的抗性可能与这2种药剂及其他常用杀虫剂之间的交互抗性有关。
交互抗性风险涉及田间药剂的合理规划与使用,是必须考虑的重要因素之一,也能为农业害虫对螺虫乙酯的抗性机制研究以及抗性治理提供理论依据。由于螺虫乙酯靶标的独特性,其与多种田间常用杀虫剂并未表现出交互抗性风险,可作为该类杀虫剂的代替药剂,但与同属季酮酸类杀虫剂螺螨酯、螺甲螨酯具有交互抗性风险,因此在田间使用时应注意避免连续使用该类杀虫剂。
3 抗性机制
昆虫抗药性发生的主要原因是田间杀虫剂的连续使用所产生的选择压力,抗性来源包括靶标抗性、代谢抗性,昆虫对螺虫乙酯的抗性机制研究也主要集中在这2个方面。
3.1靶标抗性靶标抗性是指昆虫体内杀虫剂靶标发生特异性改变,导致其对有毒物质敏感性下降所产生的抗性。Karatolos等[24]报道了温室白粉虱(Trialeurodesvaporariorum)ACC 645号位点上谷氨酸突变为赖氨酸使其产生对螺甲螨酯的抗药性。如上文所述,螺虫乙酯作用于昆虫ACC中的CT功能域,但该报道中的突变位点存在于BC功能域,不涉及药剂与蛋白结合位点,可能通过变构交互作用影响了药剂与靶标的结合。Lümmen等[13]基于大穗看麦娘(Alopecurusmyosuroides)对环己二酮类与芳氧苯氧丙酸酯类除草剂靶标抗性机制对比,发现害螨ACC 羧基转移酶功能域上L1736I、L1736A、A1739V和A1739S这4个对应突变位点均能轻微影响ACC的活性,但是所有突变对药剂依然敏感,表明该突变不涉及二斑叶螨对螺虫乙酯的抗性。而Pan等[25]对抗螺虫乙酯棉蚜(Aphisgossypii)品系进行ACC基因序列测定,发现了14个与抗性可能相关的非同义氨基酸残基碱基位点突变,其中5个位点定位到生物素羧化酶功能域,9个位点定位到羧基转移酶功能域,认为ACC氨基酸残基改变所导致其构象发生变化,可能影响了螺虫乙酯与其作用靶标的结合。综上所述,昆虫体内ACC突变所导致的对药剂敏感性下降可能是害虫抗药性发生的原因之一。
除了ACC氨基酸突变导致的抗药性产生之外,昆虫体内ACC基因表达量的改变也与抗性有关。Wei等[26]研究发现,抗性棉蚜品系中ACC基因表达量显著高于敏感品系,并且利用双链RNA干扰抗性品系中ACC基因的表达能显著增加其在螺虫乙酯处理后的死亡率。这表明棉蚜抗性品系通过ACC基因的过量表达,获得一部分对螺虫乙酯的抗性。
3.2代谢抗性代谢抗性是指昆虫体内代谢解毒酶对外源性的有害物质进行代谢,减少对昆虫造成的危害。一些学者对同属季酮酸类杀螨剂螺甲螨酯代谢抗性机制的研究,发现P450酶系相关基因的表达与昆虫对该种药剂的抗药性有关,Demaeght等[9]发现抗性二斑叶螨品系CYP392E10受到螺甲螨酯诱导高表达,并通过LC-MS/MS分析证明了该基因所调控的蛋白能通过羟基化代谢螺螨酯与螺甲螨酯,但该蛋白不能代谢螺虫乙酯,杨顺义等[27]也通过基因表达量的探究佐证了这一结果。
Pan等[28]对棉蚜抗性和敏感品系进行转录组测序,并分析比较了差异基因表达量,发现抗性品系中多条UDP-葡萄糖醛酸转移酶基因、细胞色素P450单加氧酶基因、热激蛋白基因显著上调,表明这些解毒酶基因所调控的蛋白可能与棉蚜对螺虫乙酯的抗性有关。此后,Peng等[22]进一步研究转录组结果发现,CYP6A2在抗性棉蚜成虫、若虫中均过量表达,与之前转录组结果一致;增效剂胡椒基丁醚能显著提升螺虫乙酯对棉蚜抗性品系的毒力,而抑制抗性品系蚜虫该基因表达后,对螺虫乙酯敏感性显著上升,表明蚜虫很可能是通过P450酶系及羧酸酯酶对螺虫乙酯进行代谢。杨顺义等[27]研究发现,CYP392E1和CYP392E9在二斑叶螨抗螺虫乙酯品系中显著下调,P450酶系相关基因表达量在昆虫体内处于一种动态平衡状态,该表达模式的改变可能涉及二斑叶螨对螺虫乙酯的抗性。Gong等[29]研究表明,在高浓度(LC75)螺虫乙酯压力下,棉蚜羧酸酯酶活性及其调控基因CarE-YS1表达量上升,表明棉蚜能通过高表达CarE对螺虫乙酯进行代谢。
对螺虫乙酯代谢抗性的研究表明,昆虫可以通过其体内代谢解毒酶对药剂进行代谢,但其代谢途径与其他季酮酸类杀虫剂具有差异,目前发现P450酶系及羧酸酯酶参与该代谢过程。该类研究为螺虫乙酯制剂中增效剂的添加提供了基础,另外,对于药剂的混用及轮用也具有指导意义。
4 抗药性的治理
害虫的抗药性治理是在将农业害虫控制在经济阈值以下的基础上,预防或减缓潜在的农业害虫抗药性发生。抗性治理在抗性水平较低时开展较为有效,随着害虫抗药性的增加,治理效果越来越差、治理成本越来越高[30]。考虑到螺虫乙酯作为一种在田间应用时间较短、使用量较小的新型杀虫剂,害虫对其抗性发生并不严重,因此需要及时地对该药剂进行抗药性治理。目前对螺虫乙酯的抗性治理研究主要集中在以下2个方面。
(1)将螺虫乙酯与其他田间常用的杀虫剂进行混用,当同时使用作用方式不同的杀虫剂时,能有效降低药剂对害虫的选择压力,从而达到减缓抗药性产生的目的。国内通过大量大田试验,筛选出多种对刺吸式口器节肢动物具有良好防效的螺虫乙酯复配药剂。如螺虫乙酯150 OD与1.8%阿维菌素EC复配后,对烟粉虱各个虫态都具有良好的药效,并且持效期长达21 d,显著高于对照药剂[31]。螺虫乙酯与新烟碱类药剂复配后,对田间取食不同寄主的烟粉虱具有良好的防效,并且能改善螺虫乙酯单剂在田间速效性差的缺点,同时仍具备较好的持效性[32-36]。螺虫乙酯用于防治害螨时,表现出良好的速效性,与防治有害昆虫有所区别。而将螺虫乙酯与乙螨唑混配后,对柑橘全爪螨及苹果全爪螨具有显著增效作用,并能改善乙螨唑在田间速效性差的缺点,且还能提高2种药剂的持效性[37-38]。此外,螺虫乙酯与杀菌剂的混用能同时防治植物上发生的病害与虫害,24%螺虫乙酯SC与25%溴菌腈WP及2.5%适乐时FS复配后,对棉花田常见的炭疽病、红腐病和立枯病均有良好的防效,并且能有效控制棉花田害虫绿盲蝽(Apolyguslucorum)和棉蚜的发生[39]。以上复配研究扩大了螺虫乙酯的适用范围,当该药剂与其他类杀虫剂混用后,不仅能减少用药量、减缓抗药性的发生,更能扩大杀虫谱、提高速效性,是一种值得在田间推广应用的施药方式之一。
(2)抑制昆虫对螺虫乙酯的代谢能力,从而提升药剂的药效。综上所述,害虫能通过多P450酶系相关蛋白及羧酸酯酶对螺虫乙酯进行代谢,而胡椒基丁醚作为该类代谢解毒酶的抑制剂,其在杀虫剂制剂中的添加能有效提高药效,从而减少杀虫剂的使用量,提升对田间害虫品系抗性杂合子的杀灭率,使种群中抗性基因频率长期保持在较低水平,以延缓种群抗药性的发生。若田间害虫种群已出现较低水平的抗药性,此种方法能在一定程度上缓解进一步抗药性的发生与增强。
5 展望
近年来,市场对杀虫剂的安全性、环境相容性具有更高的要求,其中越来越多的新型杀虫剂以其高效性、安全性受到广泛选择,由此可见,能够有效延缓抗药性发生的、具有新型作用靶标的杀虫剂仍然是市场所需。目前,田间害虫种群对螺虫乙酯的抗药性依然处于较低水平,螺虫乙酯作为一种新型杀虫剂将在农业害虫防治中发挥重要作用。但随着使用量的增加和使用范围的扩大,农业害虫对其抗药性会呈上升趋势,必须对其进行有效的抗性治理。除了通过控制药剂的使用量、频率及与其他靶标相异的杀虫剂轮用、混用外,还可以通过害虫新靶标位点的研究,开发具有全新作用机制的新型杀虫剂,对于延长现有杀虫剂的使用寿命以及采取有害生物综合治理都具有重要的现实意义。
[1] NAUEN R,RECKMANN U,THOMZIK J,et al.Biological profile of spirotetramat(Movento®):A new two-way systemic(ambimobile)insecticide against sucking pest species[J].Bayer crop science journal,2008,61(2):245-278.
[2] WACHENDORFF U,NAUEN R,SCHNORBACH H J,et al.The biological profile of spirodiclofen(Envidor®):A new selective tetronic acid acaricide[J].Pflanzenschutz-nachrichten bayer,2002,55:149-176.
[3] BRETSCHNEIDER T,BENETBUCHHOLZ J,FISCHER R,et al.Spirodiclofen and spiromesifen-novel acaricidal and insecticidal tetronic acid derivatives with a new mode of action[J].Chimia international journal for chemistry,2003,57(11):697-701.
[4] NAUEN R.Spirodiclofen:Mode of action and resistance risk assessment in Tetranychid pest mites[J].Journal of pest science,2005,30(3):272-274.
[5] CANTONI A,DE MAEYER L,IZQUIERDO J,et al.Development of Movento® on key pests and crops in European countries[J].Bayer crop science journal,2008,61:349-376.
[6] BRÜCK E,ELBERT A,FISCHER R,et al.Movento®,an innovative ambimobile insecticide for sucking insect pest control in agriculture:Biological profile and field performance[J].Crop protection,2009,28(10):838-844.
[7] 张庆宽.双向内吸性新杀虫剂螺虫乙酯的开发[J].农药2009,48(6):445-447.
[8] PARVY J P,NAPAL L,RUBIN T,et al.Drosophilamelanogasteracetyl-CoA-carboxylase sustains a fatty acid-dependent remote signal to waterproof the respiratory system[J].PLoS Genetics,2012,8(8):1-16.
[9] DEMAEGHT P,DERMAUW W,TSAKIRELI D,et al.Molecular analysis of resistance to acaricidal spirocyclic tetronic acids inTetranychusurticae:CYP392E10 metabolizes spirodiclofen,but not its corresponding enol[J].Insect biochemistry & molecular biology,2013,43(6):544-554.
[10] BARBER M C,PRICE N T,TRAVERS M T.Structure and regulation of acetyl-CoA carboxylase genes of metazoa[J].Biochimica et biophysica acta,2005,1733(1):1-28.
[11] BURTON J D,GRONWALD J W,SOMERS D A,et al.Inhibition of corn acetyl-CoA carboxylase by cyclohexanedione and aryloxyphenoxypropionate herbicides[J].Pesticide biochemistry & physiology,1989,34(1):76-85.
[12] YU L P,KIM Y S,TONG L.Mechanism for the inhibition of the carboxyltransferase domain of acetyl-coenzyme A carboxylase by pinoxaden[J].Proceedings of the national academy of sciences of the United States of America,2010,107(51):22072-22077.
[13] LÜMMEN P,KHAJEHALI J,LUTHER K,et al.The cyclic keto-enol insecticide spirotetramat inhibits insect and spider mite acetyl-CoA carboxylases by interfering with the carboxyltransferase partial reaction[J].Insect biochemistry & molecular biology,2014,55:1-8.
[14] OUYANG Y L,MONTEZ G H,LIU L,et al.Spirodiclofen and spirotetramat bioassays for monitoring resistance in citrus red mite,Panonychuscitri(Acari:Tetranychidae)[J].Pest management science,2012,68(5):781-787.
[15] 王然,刘诗宇,渠成,等.烟粉虱对螺虫乙酯的抗性监测及交互抗性测定[J].植物保护学报,2016,43(1):117-122.
[16] PENG Z K,ZHENG H X,XIE W,et al.Field resistance monitoring of the immature stages of the whiteflyBemisiatabacito spirotetramat in China[J].Crop protection,2017,98:243-247.
[17] DE LITTLE S C,UMINA P A.Susceptibility of AustralianMyzuspersicae(Hemiptera:Aphididae)to three recently registered insecticides:Spirotetramat,cyantraniliprole,and sulfoxaflor[J].Journal of economic entomology,2017,110(4):1764-1769.
[18] VOUDOURIS C C,WILLIAMSON M S,SKOURAS P J,et al.Evolution of imidacloprid resistance inMyzuspersicaein Greece and susceptibility data for spirotetramat[J].Pest management science,2017,79(3):1084-1812.
[19] GUILLéN J,NAVARRO M,BIELZA P.Cross-resistance and baseline susceptibility of spirotetramat inFrankliniellaoccidentalis(Thysanoptera:Thripidae)[J].Journal of economic entomology,2014,107(3):1239-1244.
[20] HU J F,WANG C F,WANG J,et al.Monitoring of resistance to spirodiclofen and 5 other acaricides inPanonychuscitricollected from Chinese citrus orchards[J].Pest management science,2010,66(9):1025-1030.
[21] YU D Y,WANG C F,YU Y,et al.Laboratory selection for spirodiclofen resistance and cross-resistance inPanonychuscitri[J].African journal of biotechnology,2011,10(17):3424-3429.
[22] PENG T,PAN Y,CHEN Y,et al.Over-expression ofCYP6A2,is associated with spirotetramat resistance and cross-resistance in the resistant strain ofAphisgossypii,Glover[J].Pesticide biochemistry & physiology,2016,126:64-69.
[23] EJAZ M,ALI S S.Spirotetramat resistance selected in thePhenacoccussolenopsis(Homoptera:Pseudococcidae):Cross-resistance patterns,stability,and fitness costs analysis[J].Journal of economic entomology,2017,110(3):1226-1234.
[24] KARATOLOS N,WILLIAMSON M S,DENHOLM I,et al.Resistance to spiromesifen inTrialeurodesvaporariorumis associated with a single amino acid replacement in its target enzyme acetyl-coenzyme A carboxylase[J].Insect molecular biology 2012,21(3):327-334.
[25] PAN Y,ZHU E,GAO X,et al.Novel mutations and expression changes of acetyl-coenzyme A carboxylase are associated with spirotetramat resistance inAphisgossypiiGlover[J].Insect molecular biology,2017,26(4):383-391.
[26] WEI X,ZHENG C,PENG T F,et al.miR-276 andmiR-3016-modulated expression of acetyl-CoA carboxylase accounts for spirotetramat resistance inAphisgossypiiGlover[J].Insect biochemistry & molecular biology,2016,79:57-65.
[27] 杨顺义,岳秀利,王进军,等.二斑叶螨不同抗性品系最佳内参基因的筛选及CYP392E亚家族基因的表达分析[J].昆虫学报,2013,56(10):1152-1159.
[28] PAN Y O,YANG C,GAO X W,et al.Spirotetramat resistance adaption analysis ofAphisgossypiiGlover by transcriptomic survey[J].Pesticide biochemistry & physiology,2015,124:73-80.
[29] GONG Y H,SHI X Y,DESNEUX N,et al.Effects of spirotetramat treatments on fecundity and carboxylesterase expression ofAphisgossypiiGlover[J].Ecotoxicology,2016,25(4):655-663.
[30] 向志国,郑榜高,吴学渊.昆虫抗药性的产生及其治理对策[J].植物医生,2009,22(5):6-8.
[31] 马标,张素峰,高凡昌,等.螺虫乙酯150 OD与1.8%阿维菌素EC桶混防治辣椒烟粉虱田间试验初报[J].安徽农学通报,2012,18(24):70-72.
[32] 张凯,高广春,王向阳.21.6%螺虫乙酯·噻虫啉悬浮剂对烟粉虱的田间防效评价[J].安徽农学通报,2013(15):78-79.
[33] 王虹.螺虫乙酯·噻虫啉21.6%悬浮剂防治大棚黄瓜烟粉虱试验总结[J].新疆农业科技,2015(2):25-26.
[34] 蔡美艳,冯永斌,陈海波.螺虫乙酯·噻虫啉240SC等药剂防治西瓜烟粉虱田间药效试验[J].上海农业科技,2014(4):149-150.
[35] 邹华娇.螺虫乙酯与噻虫嗪混配对菊花烟粉虱的毒力、防效及安全性研究[J].福建农业学报,2015(4):357-361.
[36] 孙海,郑翔,王晓青,等.高效防治烟粉虱的药剂筛选[J].中国蔬菜,2015,1(8):46-49.
[37] 钟小领,石绪根,熊件妹.螺虫乙酯与乙螨唑混配对柑橘红蜘蛛的增效作用研究[J].生物灾害科学,2016,39(4):228-232.
[38] 焦蕊,李立涛,于丽辰,等.三种杀螨剂及其复配对苹果全爪螨的田间防效[J].北方园艺,2017(4):109-111.
[39] 娄殿国,邢光耀.不同杀菌剂和杀虫剂混配拌种对棉苗病害、棉蚜和绿盲蝽的效果[J].中国棉花,2014,41(3):27-29.

