猪源大肠埃希菌药敏试验及耐药基因检测
晏云涛,赵 汝,苗淑淑,高 洪,俸江琴
(云南农业大学动物医学院,云南昆明 650201)
在我国,大肠埃希菌(Escherichiacoli)已确定为耐药性检测的指示菌株,可引起人畜共患病,其主要特点是有多血清型、多抗原性、能引起全身性临床症状和病理变化,又由于家畜的年龄、免疫力、病毒携带因子和感染途径有所差异[1],就使得所产生的病理变化和主要症状不同,主要可引发败血症、腹膜炎、卵黄囊炎、仔猪黄痢、仔猪白痢、猪水肿病等[2-3],对畜禽养殖业、食品加工、水质环境造成严重危害和污染[4]。由于大肠埃希菌缺乏有效的疫苗,使得大肠杆菌病一直都依靠药物进行控制。目前兽医临床治疗大肠杆菌病的常见药物有β-内酰胺类、氨基糖苷类、四环素类、喹诺酮类等[5]。由于大肠杆菌病的用药可选择范围大、用药不规范等种种原因导致了大肠埃希菌的耐药性越来越严重,并且逐渐成为人类健康的潜在威胁之一,而且耐药基因介导的耐药菌株正逐步趋向于多重耐药,因此对其耐药性的检测显得尤为迫切[6]。
氨基糖苷类药物是一类作用于细菌核糖体,进而使细菌蛋白质合成受阻来迫使细菌死亡的抗菌药物[7],由于氨基糖苷类药物广谱抗菌、效果显著、廉价、药代动力学特征良好,特别是对需氧型革兰阴性菌的感染有良好的治疗作用,因此被广泛应用于兽医临床[8]。随着这类药物的广泛应用尤其是滥用,细菌耐药性的产生也在逐年增加[9]。研究表明,革兰阴性菌对氨基糖苷类药物耐药机制主要为其携带aac、ant(aad)、aph基因,它们分别编码N-乙酰转移酶、O-核苷转移酶(O-腺苷转移酶)、O-磷酸转移酶等氨基糖苷类修饰酶,致氨基糖苷类药物被修饰从而失去生物活性,这是细菌产生耐药性的最主要机制[10-12]。本研究旨在探讨云南省楚雄州某猪场撒坝猪大肠埃希菌对6种氨基糖苷类抗生素的耐药性以及耐药基因aadA1和aph(3′)的携带情况,为兽医临床合理使用此类抗生素提供依据。
1 材料与方法
1.1 材料
1.1.1试验菌株从云南楚雄州某猪场有腹泻症状的撒坝猪的粪便中,由云南农业大学动物医学院病理实验室分离鉴定的51株大肠埃希菌。
1.1.2主要试剂LB培养基和伊红美蓝培养基,广东环凯微生物科技有限公司产品;药敏试纸片,杭州微生物试剂有限公司产品;细菌基因组DNA提取试剂盒,北京百泰克生物技术有限公司产品;DNA Marker DL 2 000 、核酸染料、2×Real Star Green Power Mixture,宝生物工程(大连)有限公司产品。
1.2 方法
1.2.1细菌的纯化培养将保存于-80℃的51株大肠埃希菌在无菌环境下接种到事先高压灭菌过且制备好的LB固体培养基上和伊红美蓝培养基上,倒置于37℃恒温箱培养12 h,观察细菌生长情况。
1.2.2药敏试验药敏试验和判断标准,依照美国临床试验室标准委员会(CLSI)所推荐的抗菌药物敏感试验纸片法[13],选用链霉素、新霉素、庆大霉素、妥布霉素、阿米卡星、卡那霉素6种氨基糖苷类药物进行药敏试验。
1.2.3大肠埃希菌DNA的提取挑取单个菌落接种到6 mL的LB液体培养基中,置于摇床中37℃、200 r/min培养过夜;将培养好的51株大肠埃希菌菌液用移液枪分别吸取1.5 mL到离心管内,12 000 r/min离心1 min,弃上清;按照百泰克细菌基因组DNA提取试剂盒说明书操作,最后将提取出来的DNA保存在-20℃冰箱备用。
1.2.4PCR扩增参照文献[14-15]的引物,在NCBI上对编号为13905339和4364198进行查找,并利用Primer6设计引物( 表1 ),引物由上海生工生物工程技术服务有限公司合成。扩增体系共25 μL:2×Real Star Green Power Mixture 12.5 μL、ddH2O 9.5 μL,底物模板2 μL,上、下游引物各0.5 μL。扩增条件:95℃预变性3 min;95℃ 30 s,aadA1 60℃ 30 s(aph(3′)55℃ 30 s),72℃ 1min,共32个循环;72℃ 5 min,置-4℃保存。PCR产物经10 g/L琼脂糖凝胶电泳检测,凝胶成像系统读取结果。

表1 引物核酸序列
2 结果
2.1 大肠埃希菌的纯化鉴定
37℃培养12 h后,在LB琼脂平板上形成的菌落形态为小凸起的圆形、边缘整齐、表面光滑、半透明的菌落,直径约为2 mm~3 mm (图1A);最典型的是在伊红美蓝培养基上,形成深紫黑色、光滑、湿润、带有金属光泽的圆形菌落(图1B)[16],可判定为大肠埃希菌。

A.LB琼脂;B.伊红美蓝培养基
A.LB agar media;B.Eosinosilan plate tablet
图1菌落形态
Fig.1Colonial morphology
2.2 大肠埃希菌药敏试验结果
2.2.1耐药率实验室保存的51株猪源致病性大肠埃希菌的耐药结果显示,E.coli对6种氨基糖苷类抗生素都表现出了不同程度的耐药性,其中卡那霉素的耐药率最高达到70.6%,其次是链霉素49.0%、妥布霉素47.1%、庆大霉素43.1%、新霉素35.3%,耐药率最低的是阿米卡星15.7% (表2)。
2.2.2多重耐药率51株大肠埃希菌对6种氨基糖苷类药物的耐药率显示,无耐药菌株21.6%(11株),单耐药菌株3.9%(2株),双耐药菌株27.5%(14株),三耐药菌株15.7%(8株),四耐药菌株9.8%(5株),五耐药菌株9.8%(5株),六耐药菌株11.8%(6株),其中以双耐药菌株所占比例最多。
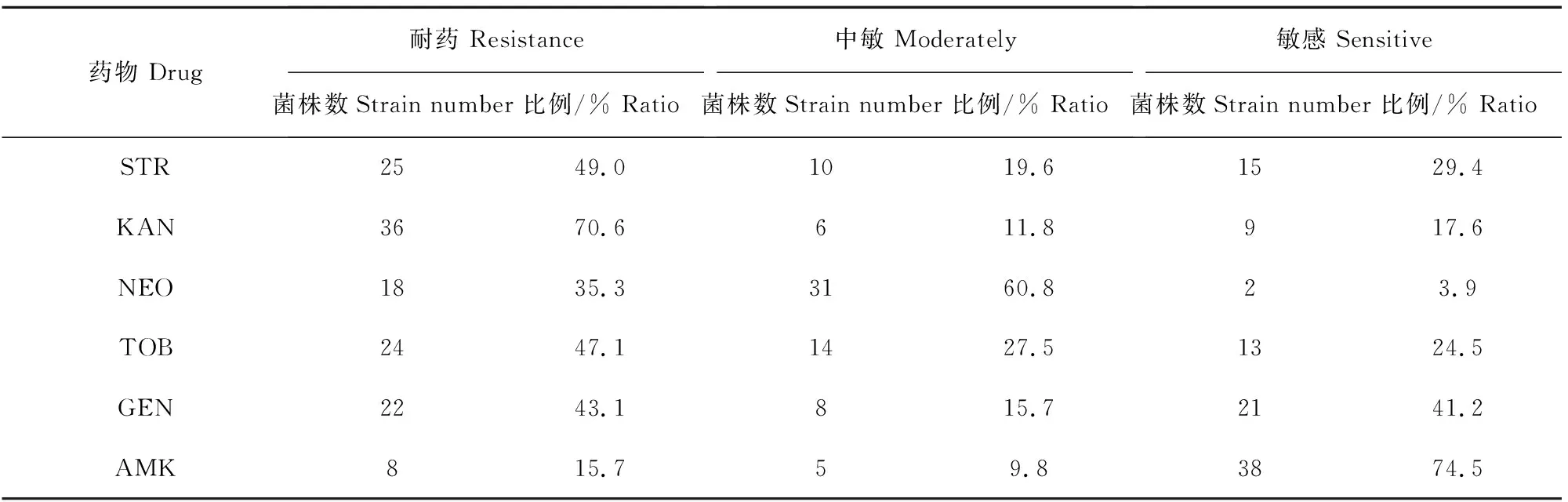
表2 51株大肠埃希菌耐药结果
2.3 aadA1和aph(3′)基因的检测结果
2.3.1aadA1耐药基因检测结果以51株大肠埃希菌DNA作为模板,以aadA1作为引物进行PCR扩增,经10 g/L琼脂糖凝胶电泳对aadA1耐药基因携带情况进行检测,结果表明,在51株大肠埃希菌分离菌株中,有28株大肠埃希菌的aadA1基因片段扩增出阳性,其阳性检出率为54.90%(图2)。
2.3.2aph(3′)耐药基因检测结果以51株大肠埃希菌DNA作为模板,以aph(3′)作为引物进行PCR扩增,经10 g/L琼脂糖凝胶电泳对aph(3′)耐药基因携带情况进行检测,结果表明,在51株大肠埃希菌分离菌株中,有44株大肠埃希菌的aph(3′)基因片段扩增出阳性,其阳性检出率为86.27%(图3)。

M.DNA 标准DL 2 000;1~51.大肠埃希菌分离株;N.阴性对照
M.DNA Marker DL 2 000;1-51.Isolate ofE.coli;N.Negative control
图251株大肠埃希菌分离株aadA1基因扩增产物
Fig.2Amplification products of aadA1 gene of 51E.coliisolates
3 讨论
在短短数十年之间,高度抗生素选择性压力使动物源性的耐药菌的耐药特点从最初的单一耐药、耐药率低、传播速度缓慢,到如今变为耐药谱宽、耐药率高、耐药性传播速度快的局面[17]。从大量耐药性检测报告可看出,近年来猪源性E.coli耐药性有增长趋势,且多重耐药问题严重[18-19]。
根据薛原等[20]对黑龙江省分离的60株致病性大肠埃希菌对6种抗生素耐药性的检测,其药敏试验结果对卡那霉素耐药率达73%。本次药敏试验对卡那霉素耐药率70.6%,结果与其一致。毕保良等[21]研究了2012年云南省某规模化猪场大肠埃希菌多重耐药性,结果显示多重耐药菌株占分离株的70%。本次药敏试验51株撒坝猪大肠埃希菌多重耐药率高达74.6%,结果与其近似,提示云南楚雄州某猪场撒坝猪大肠埃希菌耐药性普遍存在,且多重耐药率有上升的趋势,为猪场建立防控措施提供了可靠的依据。矫薇薇等[22]研究了2015年江西猪源大肠埃希菌耐药性,结果大肠埃希菌对庆大霉素的耐药率高达97.1%,而本次药敏试验结果显示对庆大霉素耐药率仅为43.1%。张俊丰等[23]等分析92株猪腹泻大肠埃希菌耐药性,结果大肠埃希菌对庆大霉素、新霉素、链霉素的耐药率均高于50%,对阿米卡星的耐药率在20%以上,本次药敏试验结果显示撒坝猪大肠埃希菌对庆大霉素、新霉素、链霉素、阿米卡星的耐药率分别为41.3%、35.3%、49.0%和15.7%,与上述报道存在差异,这可能是撒坝猪与普通商品猪对大肠埃希菌的易感性和耐药性方面存在差异,也可能与猪的年龄、性别和地域相关。通过本次药敏试验结果可看出,同一种药物对各个菌株的敏感性不同,而同一菌株对各种药物的敏感性差异就更加显著,所以临床用药前必须做好药敏试验,以便筛选出对大肠埃希菌敏感的药物。

M.DNA 标准DL 2 000;1~51.大肠埃希菌分离株;N.阴性对照
M.DNA Marker DL 2 000;1-51.Isolates ofE.coli;N.Negative control
图351株大肠埃希菌分离株aph(3′)基因扩增产物
Fig.3Amplification products of aph(3′) gene of 51E.coliisolates
根据汤景元等[24]调查,我国规模化猪场大肠埃希菌氨基糖苷类抗生素耐药基因的流行情况,结果检测到aadA1、aacC2、aacC4、aphA3共4种基因型,其中以aadA1检出率最高,超过50%。陈琳等[25]对猪肠道氨基糖苷类药物耐药基因分析结果显示,aac(3)-Ⅱ检出率最高(93.5%),其次为aph(3′)(超过70%)。根据本次PCR结果显示,aadA1和aph(3′)的阳性检出率分别为54.90%和84.67%,PCR结果与上述文献基本吻合,提示云南省某猪场猪源性大肠埃希菌中aadA1和aph(3′)基因的流行率较高,均超过50%,这一流行率普遍与国内其他养殖场猪源性E.coli中aadA1和aph(3′)基因的流行率相似,说明猪源性E.coli对氨基糖苷类药物耐药水平在不断提高,猪场应该针对性用药,采用多种抗生素交叉或联合使用,按照相关规定合理使用抗生素,以提高疗效,降低毒性,延缓和避免抗药性产生。

