柱前衍生化—高效液相色谱法测定大鼠灌服朱砂后血浆中活性硫的药动学特征
霍韬光 郭婧潭 张颖花 刘求 付忠星 姜泓 康廷国
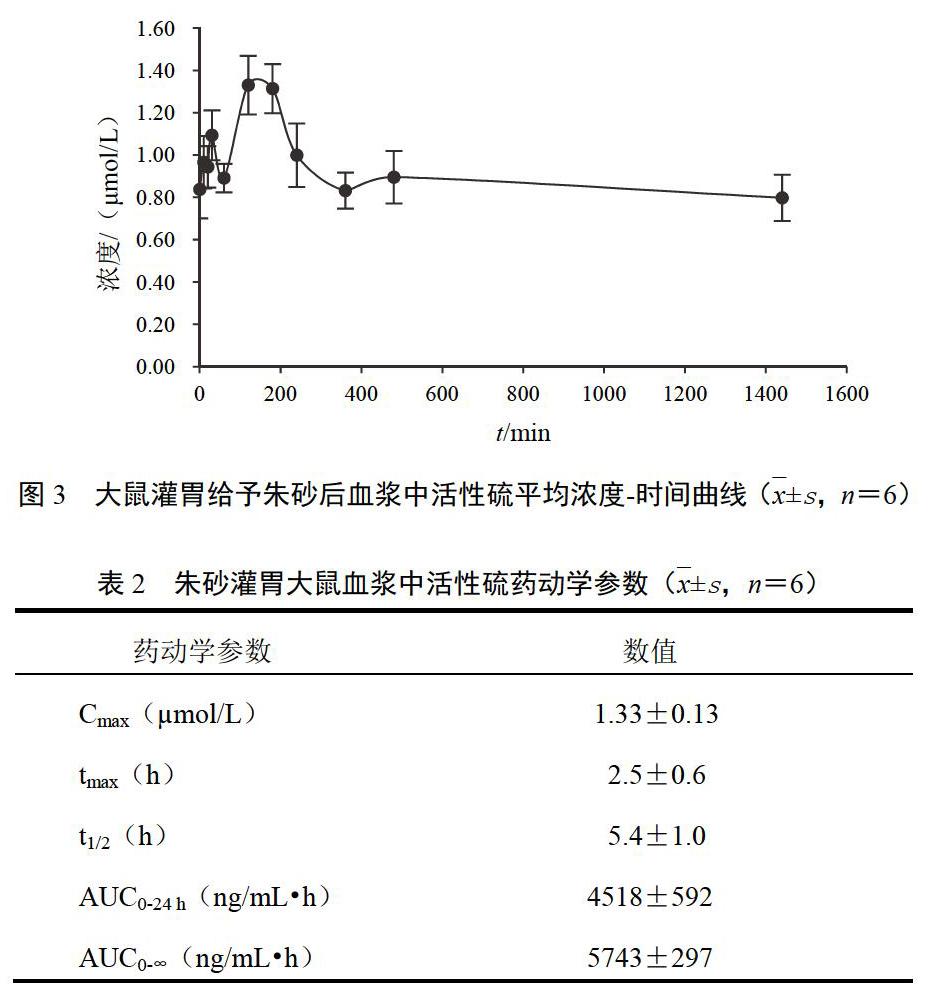
摘要:目的 测定朱砂给药后活性硫的药动学特征。方法 建立单溴二胺(MBB)柱前衍生化-高效液相色谱法测定朱砂灌胃后大鼠血浆中活性硫水平的方法,并将该法用于大鼠灌服朱砂后血浆中活性硫的药动学研究。结果 大鼠血浆中活性硫在0.25~15 ?mol/L范围内线性关系良好(r>0.99),定量限和检测限分别为0.1 ?mol/L和0.02 ?mol/L,方法的日内、日间精密度分别小于4.4%、3.5%,准确度为-9.9%~6.0%,平均回收率为74.9%。灌胃给予大鼠朱砂0.6 g/kg,血浆中活性硫Cmax为(1.33±0.13)?mol/L,tmax为(150±34)min,t1/2为(323±62)min,AUC0-∞为(5743±297)ng/mL·h。结论 本研究建立了灵敏、专属、准确的柱前衍生化-高效液相色谱法测定血浆中活性硫含量的方法,可用于朱砂灌胃大鼠血浆中活性硫的动力学特征研究。
关键词:朱砂;活性硫;柱前衍生化-高效液相色谱法;药动学特征
DOI:10.3969/j.issn.1005-5304.2018.03.019
中图分类号:R285.5 文献标识码:A 文章编号:1005-5304(2018)03-0086-04
Abstract: Objective To study the pharmacokinetic features of reactive sulfide in rats after oral administration of Cinnabaris. Methods An HPLC coupled with precolumn derivatization method was developed for the pharmacokinetic features study on reactive sulfide in rats after oral administration of Cinnabaris. Results Good linearity (r>0.99) was found for reactive sulfide in plasma in the concentration range of 0.25–15 ?mol/L (r>0.99). The LOQ and LOD of the method were 0.1 ?mol/L and 0.02 ?mol/L, respectively. The intra- and inter-day precision was less than 4.4% and 3.5% respectively, and the accuracy was -9.9%–6.0%. The average recovery rate was 74.9%. 0.6 g/kg Cinnabaris was given the rats for gavage, and the time-course pharmacokinetics parameters were as follows: Cmax (1.33±0.13) ?mol/L, tmax (150±34) min, t1/2 (323±62) min, AUC0-∞ (5743±297) ng/mL·h. Conclusion A sensitive, robust and accurate precolumn derivatization-HPLC method for the determination of plasma reactive sulfide is developed and validated. The method is successfully applied in the pharmacokinetic features study on reactive sulfide in plasma of rats after administration of Cinnabaris.
Keywords: Cinnabaris; reactive sulfide; precolumn derivatization-HPLC; pharmacokinetic features
朱砂為硫化物类矿物辰砂族辰砂,主含硫化汞(HgS),具有清心镇惊、安神解毒的功效[1-2],广泛应用于内、外、妇、儿等各科,发挥着不可替代的疗效作用。很多著名中成药制剂(安宫牛黄丸、朱砂安神丸、小儿至宝定、小儿金丹片等)中均含朱砂。现代药理研究表明,朱砂具有镇静、催眠、抗惊厥、抗心律失常作用,能降低大脑中枢神经兴奋性[3-4],而朱砂的药效作用活性成分目前尚未见报道。
近年研究表明,硫化氢(H2S)作为第3种气体信号分子,广泛参与神经系统、心血管系统、呼吸系统、消化系统、氧化应激、细胞代谢及炎症反应等众多病理生理调节过程,在生物体内发挥着重要的生物学作用[5-7]。在前期研究中,我们发现朱砂中有可溶性硫存在[8]。然而,朱砂中的可溶性硫是否可以作为体内活性硫的供体在机体内发挥着某种生物学作用,朱砂给药后硫在体内的动力学特征如何,均尚待进一步研究。
本研究建立血浆中活性硫含量的测定方法并探讨朱砂灌胃大鼠血浆中活性硫的动力学参数,确定朱砂中的硫可引起血浆中活性硫水平的改变,为揭示朱砂体内作用机制及药效/毒性作用物质基础的进一步研究提供实验基础。
1 仪器、试药与动物
高效液相色谱仪,包括1525型输液泵、2487型紫外检测器、Empower 2色谱数据工作站,美国Waters公司。ER-182A全自动电子天平(十万分之一),日本A&D;公司;3K-18超速冷冻离心机,Sigma公司;pH-3c型酸度计,上海精密科学实业有限公司;Easypure纯水系统,美国Barnstead公司。
朱砂(批号20050321),沈阳市药材公司;硫化钠标准品,天津光复精细化工所;单溴二胺(MBB),Sigma公司;色谱甲醇,天津光复精细化工所;色谱乙腈,山东禹王有限公司;三氟乙酸,天津光复精细化工有限公司;磺基水杨酸,辽宁永强医药机械化玻有限公司;其他试剂均为分析纯。
SPF级雄性Wistar大鼠18只,15周龄,体质量250~300 g,中国医科大学实验动物中心,动物许可证号SYXK(辽)2008-0005。饲养环境:室温(24±1)℃,相对湿度(50±5)%,室内人工照明(12 h光/暗循环,光照时间6:00-18:00),标准饲料喂养,自由摄食饮水。
2 方法与结果
2.1 柱前衍生化-高效液相色谱法测定活性硫含量
2.1.1 标准曲线和质控样品的制备
精密称取硫化钠标准品适量,用去离子水溶解,配制成浓度为600 ?mol/L的标准贮备液。精密量取硫化钠贮备液适量,用去离子水稀释成浓度分别为0.5、1.0、2.5、6.0、15、30 ?mol/L的硫标准溶液。
取6只大鼠的混合血浆15 ?L,加入15 ?L硫标准溶液,得相当于浓度为0.25、0.5、1.25、3.0、7.5、15 ?mol/L的硫血浆标准样品。
取大鼠混合血浆15 ?L,加入15 ?L浓度为2.0、8.0、24 ?mol/L的硫标准溶液,得浓度为1.0、4.0、12 ?mol/L的硫血浆质控(QC)样品。
2.1.2 衍生化试剂的制备及衍生化反应原理
精密称取MBB标准品适量,用乙腈溶解并定容至10 mL容量瓶中,得浓度为1.5 mmol/L MBB衍生化试液,避光保存。MBB与硫氢根离子在碱性环境下反应生成硫乙二胺(SDB)衍生物,在380 nm波长处有较强的紫外吸收。反应原理见图1。
2.1.3 血浆样品的处理
血浆中活性硫含量的测定参照SHEN X等[9-10]的方法,取血浆30 ?L,加入70 ?L Tris-HCl缓冲溶液(pH=9.5),涡旋混匀2 min,加入MBB衍生化试剂50 ?L(1.5 mmol/L),涡旋混匀2 min,室温避光放置30 min,加入50 ?L磺基水杨酸(200 mmol/L),离心10 min(12 000 r/min,4 ℃),取上清液,经0.22 ?m滤膜过滤后进样分析。
2.1.4 色谱条件
衍生化样品在Thermo C18柱(250 mm×4.6 mm,5 ?m)上分离,流动相A为水(含0.1%三氟乙酸)、B为乙腈(含0.1%三氟乙酸),梯度洗脱(0~5 min,15%~35%B;5~16 min,35%~55%B;16~23 min,55%~70%B;23~24 min,70%~90%B,维持2 min),流速为0.6 mL/min,检测波长为380 nm,进样量为20 ?L。在此色谱条件下,空白试剂、硫化钠标准品(6.0 μmol/L)和血浆样品经衍生化后典型色谱图见图2。可见,活性硫衍生物与其他内源性化合物分离良好,活性硫衍生物的保留时间为19 min。
2.1.5 方法学考察
2.1.5.1 标准曲线与检测限
取血浆标准样品,按“2.1.3”项下方法处理后,进入高效液相色谱分析,制备标准曲线。以血浆样品中硫浓度为横坐标,衍生物色谱峰面积为纵坐标,用加权最小二乘法进行回归计算,求得直线的回归方程,即为标准曲线。检测限为空白的3倍积分面积。结果表明血浆中活性硫在0.25~15 ?mol/L范围内线性关系良好。典型的回归方程为Y=865.05X-143.67(r=0.997 0),检测限为0.02 ?mol/L。
2.1.5.2 方法的精密度与准确度
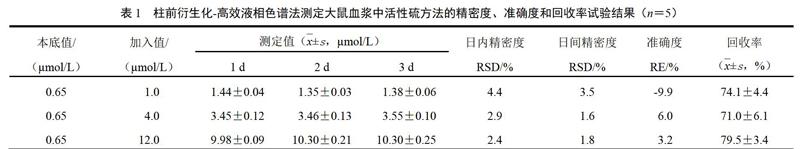
取硫血浆QC样品,按“2.1.3”项下方法处理,每个浓度分别制备5个样本,重复3个分析,连续测定3 d,以当日的标准曲线计算QC样品的测得浓度,并与配制的浓度进行对照,求得方法的准确度与精密度。结果表明,方法的日内、日间精密度RSD分别小于4.4%、3.5%,准确度的RE为-9.9%~6.0%,見表1。
2.1.5.3 方法的回收率
取硫血浆QC样品,按“2.1.3”项下方法处理,每个浓度5个样本,按上述方法进行分析。另取大鼠混合血浆15 ?L,加入15 ?L去离子水,得空白样品,同法测定。方法的回收率(%)=(测得的QC样品浓度-测得的空白样品浓度)÷加入的硫标准溶液浓度×100%。结果表明,活性硫低、中、高3个浓度血浆样品的回收率分别为74.1%、71.0%、79.5%,见表1。
2.2 朱砂灌胃大鼠血浆中活性硫药动学研究
2.2.1 分组、给药及取样
SPF级雄性Wistar大鼠18只,随机分为3组,每组6只,实验前适应性喂养1周。大鼠禁食12 h,分别灌胃给予0.5%CMC-Na溶液、0.6 g/kg朱砂混悬液及50 mg/kg硫化钠溶液,分别于给药前及给药后10、20、30、60、120、180、240、360、480、1440 min于眼后缘静脉采血0.2 mL,分离血浆,-70 ℃冰箱贮存,待测。
2.2.2 样品测定
未知血浆样品按“2.1.3”项下方法分析,测定不同时间点血浆样品中活性硫浓度。
2.3 药动学特征
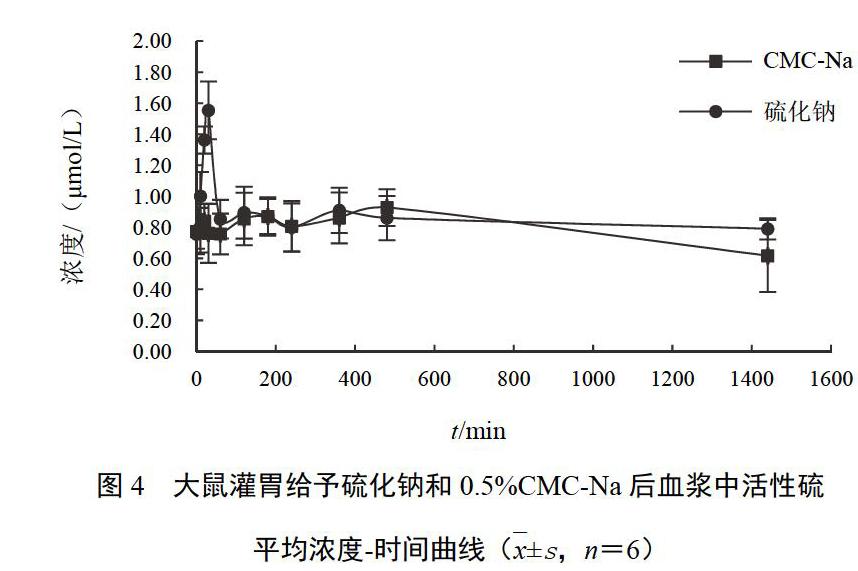
计算大鼠灌胃给予朱砂后不同时间点血浆中活性硫浓度,并绘制出血浆中平均活性硫浓度-时间曲线,采用药动学软件计算药动学参数。数据用—x±s表示。朱砂灌胃大鼠血浆中活性硫平均浓度-时间曲线见图3。可见,灌胃朱砂后,大鼠血浆中活性硫浓度于灌胃后30 min和150 min分别2次达到峰值。朱砂灌胃大鼠血浆中活性硫主要药动学参数见表2。同时观察灌胃给予0.5%CMC-Na和硫化钠后大鼠不同时间点血浆中活性硫浓度的变化,发现灌胃给予0.5%CMC-Na的大鼠血浆中活性硫平均浓度无明显变化,而灌胃给予硫化钠的大鼠血浆中活性硫平均浓度在灌胃后30 min达到最大值(见图4)。
3 讨论
有文献报道测定血浆活性硫采用高效液相色谱-荧光检测法[9-10],本研究采用高效液相色谱-紫外检测,虽然检测灵敏度低于荧光检测,但扩大了HPLC方法的应用范围。目前,虽然已有关于MBB法测定生物体内硫化氢水平的方法研究报道,但并未对方法学进行系统确证及将方法进行应用。本研究对方法的专属性、灵敏度、精密度、准确度、回收率和稳定性进行了系统研究,为方法的实际应用提供试验依据。
朱砂药用范围十分广泛。2015年版《中华人民共和国药典》收载含朱砂的成方制剂共362种,占其收载成方制剂总数的5.2%。朱砂的主要成分为HgS,但迄今为止,仅研究了朱砂中汞在体内的动力学过程[11-12],而硫在体内的过程研究目前尚未见报道。
本研究采用柱前衍生化-高效液相色谱-紫外检测法测定朱砂灌胃大鼠血浆中活性硫的药动学特征。由大鼠灌胃给予朱砂后血浆中活性硫的平均浓度-时间曲线可见,灌胃给予朱砂后,大鼠血浆中活性硫平均浓度随时间发生变化,并在灌胃后30 min和150 min分别2次达到最大值。而大鼠灌胃给予CMC-Na后血浆中活性硫水平随时间无明显变化。灌胃给予硫化钠后大鼠血浆中活性硫水平也在灌胃后30 min达到最大值。通过比较,我们推测朱砂中的游离硫离子首先吸收入血,并在30 min达到最大值(与硫化钠趋势一致)。朱砂中主要成分HgS在胃和肠道内可通过发生化学反应(胃: ;肠道: )释放出硫离子[13],这可能是朱砂灌胃后150 min时血浆中活性硫平均浓度升高的原因,提示朱砂中的硫能起到活性硫供体的作用。
本研究建立了一种灵敏、专属、准确的柱前衍生化-高效液相色谱测定血浆中活性硫含量的方法,并将其成功用于测定朱砂灌胃大鼠血浆中活性硫的平均血浆浓度-时间曲线,计算出药动学参数。确定了朱砂中的硫可作为活性硫供体,引起血浆中活性硫水平的改变。
参考文献:
[1] 国家药典委员会.中华人民共和国药典:一部[M].北京:中国医药科技出版社,2015:137.
[2] KUMAR A, NAIR A G, REDDY A V, et al. Bhasmas: unique ayurvedic metallic-herbal preparations, chemical characterization[J]. Biol Trace Elem Res,2006,109(3):231-254.
[3] ZHANG F, LU Y, WU Q, et al. Role of cinnabar and realgar of WSHFD in protecting against LPS-induced neurotoxicity[J]. J Ethnopharmacol,2012,139(3):822-828.
[4] WANG Q, YANG X, ZHANG B, et al. The anxiolytic effect of cinnabar involves changes of serotonin levels[J]. Eur J Pharmacol,2007, 565(1/2/3):132-137.
[5] KOLLURU G K, SHEN X, KEVIL C G. A tale of two gases: NO and H2S, foes or friends for life?[J]. Redox Biol,2013,1:313-318.
[6] SZAB? C. Hydrogen sulphide and its therapeutic potential[J]. Nat Rev Drug Discov,2007,6(11):917-935.
[7] WALLACE J L, DICAY M, MCKNIGHT W, et al. Hydrogen sulfide enhances ulcer healing in rats[J]. FASEB J,2007,21(14):4070- 4076.
[8] 郭婧潭,張颖花,霍韬光,等.水飞法炮制对朱砂中可溶性硫和汞的影响[J].中华中医药学刊,2015,33(5):1113-1115.
[9] SHEN X, PATTILLO C B, PARDUE S, et al. Measurement of plasma hydrogen sulfide in vivo and in vitro[J]. Free Radic Biol Med, 2011,50(9):1021-1031.
[10] SHEN X, CHAKRABORTY S, DUGAS T R, et al. Hydrogen sulfide measurement using sulfide dibimane: critical evaluation with electrospray ion trap mass spectrometry[J]. Nitric Oxide,2014, 41:97-104.
[11] 杨堃,李秀芳,孙艳,等.大鼠口服朱砂的毒代动力学研究[J].中国医院药学杂志,2009,29(7):534-537.
[12] 付中祥,杨虹,陈秀芬,等.朱砂、朱砂安神丸及氯化汞在小鼠体内吸收、分布对比[J].中国实验方剂学杂志,2013,19(1):162-166.
[13] ZHOU X, ZENG K, WANG Q, et al. In vitro studies on dissolved substance of cinnabar: chemical species and biological properties[J]. J Ethnopharmacol,2010,131(1):196-202.
(收稿日期:2017-08-21)
(修回日期:2017-10-16;编辑:陈静)

