新高考背景下化学选考微专题复习策略研究
浙江
何小伟
浙江省自2014年实行新高考改革以来,化学选考已进行了六次,六次试题难度参差不齐,但知识点大同小异。不管是刚进入高三的11月份选考,还是下学期4月份选考,相信很多教师都有疑问:化学选考到底该怎么复习?笔者也有同样的疑惑。从2014年9月到2018年4月浙江省完成了六次新高考背景下的化学选考,结合四年新高考背景的从教经历,对照《考试说明》及六次选考试卷,探究新高考背景下化学选考微专题复习策略。
一、微专题复习研究背景
“微专题”是指以某一知识、方法或者某个问题情景为中心,整合相关基本概念、基本原理、基本模型和基本规律,所形成的一种联系紧密、逻辑清晰的微型专题复习结构。其目的在于针对化学选考复习时间紧、内容多、题型相对稳定的特点,设置高效合理的微型专题,使得化学选考复习更具实效性和针对性。
1.传统高考专题复习的实践与思考
传统高考化学复习分三轮:第一轮知识梳理,第二轮专题复习,第三轮综合训练。专题复习教学是化学复习中重要环节,是连接知识梳理与综合训练的桥梁。传统高考题型灵活,每个题目知识点分散,导致传统高考专题复习切口宽、内容多、跨度大,缺乏针对性、灵活性和选择性等问题,教学效果通常不能令人满意。
2.教学秩序和教学进度的改变
传统高考化学在高三下学期6月份进行,高考复习按部就班,时间相对宽裕。而新高考背景下化学选考分两次进行,高三上学期第一次参加选考,时间很紧张,按照传统复习方式,知识梳理都是不能完成的,要想在第一次考试中取得理想成绩,必须转变复习方式,专题复习须穿插到知识梳理中,小而精的微专题应运而生。
3.新高考背景下化学选考试题的分析
新高考背景下化学选考已进行六次,六次试题难度参差不齐,但知识点大同小异。很多教师也对六次选考试题中各小题的知识点进行了罗列与比对,通过比对不难看出,选考试题对于专题复习指明了方向,各小题考点明确,如选择题第22题阿伏加德罗常数,第23题酸碱中和滴定曲线分析。各小题切口小、内容窄、强调知识的深度而非知识跨度,转变传统专题复习方式,探究微专题复习势在必行。
二、微专题复习策略研究
1.微型专题的设置依据
微专题复习模式首先要求设置微型专题,怎么设置?设置哪些微型专题?这些都是值得深思的问题,每个微型专题的设置对于化学选考的复习都有着举足轻重的作用,不可大意。研究“考纲”是基础,分析试题是关键,总结考点是精华。
(1)《考试说明》的研究
新高考方案实施后,浙江省教育厅颁布的《浙江省普通高中学业水平考试暨高考选考科目考试标准(2014版)》对于化学学科教学就是最好的纲领性文件。认真研读《考试说明》,把握《考试说明》对不同知识点所提出的能力要求,把握命题趋势,设置出针对性更强、更实用的微专题。
(2)六次选考试题的研究
分析选考试题,有利于把握选考的方向,相对稳定的题型也有利于教学和复习中的有的放矢,化学选考试卷一共32道题,学考29道题,3道加试题,命题风格和题型基本保持稳定。不少教师也做过六次试题考点的对比,如第22题阿伏加德罗常数,第23题酸碱中和滴定曲线分析,第24题化工生产流程题等。针对这些题型设置相应的微专题进行针对性训练并加以强化。
(3)选考考点的研究
考点是命题的导向,在研究试题的基础上,认真分析尤其是非选择题部分涉及的考点对选考复习具有很强的指导意义。如第32题有机综合推断,常涉及:①官能团的名称和反应类型的判断;②某有机化合物X的分子式或结构式的推断;③限定条件下同分异构体的书写;④目标产物的合成路线流程图等。这些拆分的考点一一设置成微型专题来进行各个突破,然后再把拆分的考点整合起来进行综合训练,复习效果可能会更好。
2.微型专题的实施流程
设置好微型专题,如何去合理高效地安排教学?首先要明确“考纲”要求,研究选考真题。传统高考形式下也有很多对于微专题复习模式的研究,实施微专题复习教学一般按照问题情境、思维模型、问题解决的逻辑顺序等进行,笔者结合教学实践,初步探究微专题复习模式的实施流程。
(1)坚持目标导向,把握选考试题脉络
微专题复习教学中首先将该专题所对应的选考背景揭示出来,使学生一开始就能明确该专题的学习目标,这种目标导向策略既符合选考考查的实际需求,同时能充分发挥学生学习的主体性作用。如选考第31题以物质的制备实验为载体,考查相关实验原理,可按照如下知识脉络展开问题探究,进行微专题复习。
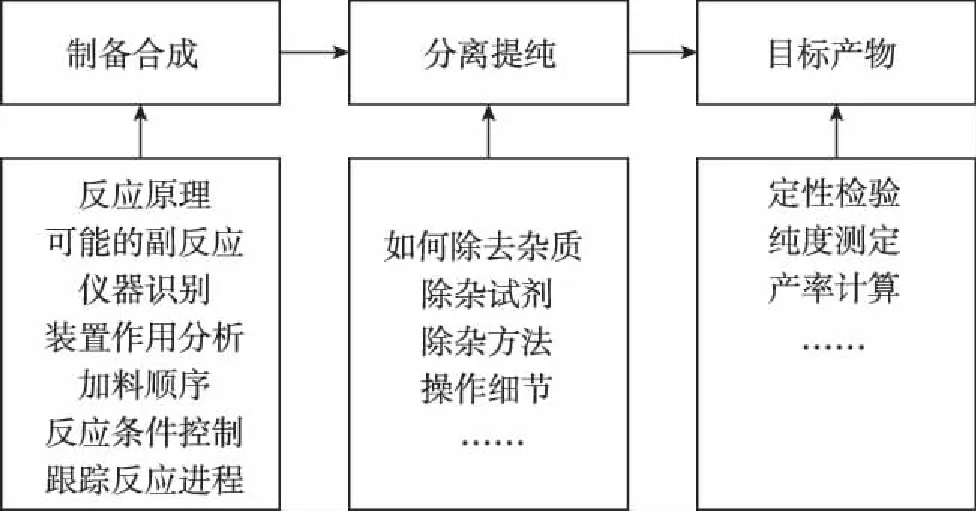
物质制备类实验题脉络
(2)构建知识体系,萃取知识精华
微专题复习教学中最重要的环节就是构建该知识体系下的思维模型,也是微专题能以小见大的原因之一。课堂教学中通常指导学生回顾教材中基本知识和基本情景,按照逻辑关系进行整理归纳,尽可能以思维导图形式展现出来并加以解读。如元素周期律微专题可以按照如下教学片段展开思维模型教学。
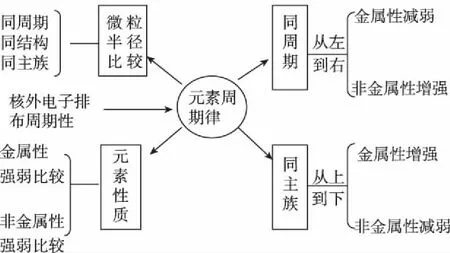
元素周期律知识体系
(3)精心设计训练,强化落实与矫正
不管是传统的专题复习模式还是微型专题复习模式,都是为了强化学生的应考能力,设计相关的反馈巩固训练是必不可少的。微型专题的反馈训练要求内容精炼,针对性强,这就要求教师精心设计的训练,既要紧密契合思维模型,又要有效提升训练效率和应考技能。
综上所述,微型专题的实施流程可概括为明确“考纲”要求,确定微型专题主题、教学设计(真题检测、互动释疑、归纳总结)、针对训练、反馈矫正。其中确定微型专题主题是关键,各微专题设计要精准,直击考点。做好这项工作是十分繁重的,各学校可以发挥教师的合力,编写出不同微专题的教学设计,形成适合学生学习的校本教材,切实提高微专题复习的针对性和实效性。
3.微型专题实施课例展示——守恒计算教学设计

守恒思想在计算中的应用【设计意图】选考试卷难度加大,很重要的一方面表现在计算难度加大,如2016年4月选考中第29题氧化还原计算,第31题氧化还原滴定计算,2016年10月选考中第27题无机化合物的定性分析与定量判断。守恒计算是计算题重要题型,以计算题为切口,梳理高中化学重要思想———守恒思想,突破计算难题,并能够综合利用守恒思想解决化学问题。【教学目标】1.知识目标:(1)掌握质量守恒、元素守恒、电荷守恒、得失电子守恒的原理。(2)学会熟练运用守恒规律,建立守恒模型,解决化学问题。2.能力目标:通过守恒原理的分析利用,培养学生的化学学科思维与素养。【教学重点】常见的守恒类型题的分析。【教学难点】守恒思想的综合应用。【教学过程】一、导入(课前小练,通过两个习题,让学生回答做题过程中所用到的思想)1. 1 L混合溶液中含0.025 mol SO2-4,0.05 mol Cl-,0.025 mol NO-3,0.025 mol Na+,其余为H+,则H+物质的量浓度为( )A.0.25 mol·L-1B.0.01 mol·L-1C.0.1 mol·L-1D. 0.5 mol·L-1【答案】C【解析】应用电荷守恒,设H+物质的量浓度为c,则所有阳离子所带电荷数=阴离子所带电荷数,即0.025 mol·L-1+c=0.025 mol·L-1×2+0.05 mol·L-1+0.025 mol·L-1,解得c=0.1 mol·L-1,故选C。2.某氧化剂中,起氧化作用的是X2O2-7离子,在溶液中0.2 mol 该离子恰好能使0.6 mol SO2-3离子完全氧化,则X2O2-7离子还原后的化合价为( )A.+1 B.+2C.+3 D.+4【答案】C【解析】反应前X2O2-7中X的化合价为+6价,设反应后的化合价为+n,则得电子数为0.2×2×(6-n),反应前SO2-3中S元素的化合价为+4价,完全氧化后S元素化合价为+6价,则失电子数为0.6×2,应用得失电子守恒有0.2×2×(6-n)=0.6×2,解得n=3,故选C。(设计意图:通过简单的守恒练习,创设情境,引出本堂课的主题———守恒)

二、回顾讲解常见守恒类型(1)质量守恒依据:反应物的总质量=生成物的总质量。(2)元素(物料)守恒依据:化学反应前后原子的种类和数目不发生变化。(3)电荷守恒依据:阳离子所带正电荷总数=阴离子所带负电荷总数。(4)得失电子守恒依据:氧化剂得电子总数=还原剂失电子总数。三、通过典型例题分析守恒思想的运用【例1】向一定量的Fe、FeO、Fe2O3的混合物中加入100 mL、1 mol/L的盐酸,恰好使混合物完全溶解,放出224 mL(标准状况)的气体,向所得溶液中加入KSCN溶液无血红色出现,若用足量的CO在高温下还原相同质量的此混合物,能得到铁的质量为( )A. 11.2 g B. 5.6 gC. 2.8 gD.无法计算【答案】C【解析】混合物与盐酸恰好反应完之后加入KSCN溶液无血红色出现,说明溶液中只剩下FeCl2,根据元素守恒n(Cl-)=0.1 mol,所以n(Fe2+)=0.05 mol,再根据铁元素守恒计算得m(Fe)=0.05 mol×56 g/mol=2.8 g,故选C。(设计意图:再次感悟守恒法解题,突破传统的方法,先写化学方程式再计算)(2016年4月选考第29题,有改编)Cl2与NaOH溶液反应可生成NaCl、NaClO和NaClO3,c(Cl-)和c(ClO-)的比值与反应的温度有关。用24 g NaOH配成的250 mL溶液,与Cl2恰好完全反应(忽略Cl2与水的反应、盐类的水解及溶液体积变化)。(1)消耗掉的Cl2标况下的体积为 L;(2)某温度下,反应后溶液中c(Cl-)=6c(ClO-),则溶液中c(ClO-)= mol·L-1。【答案】(1)6.72 (2)0.3【解析】(1)不管是生成NaCl、NaClO还是NaClO3,n(Na)∶n(Cl)=1∶1,又根据钠元素守恒得n(Cl)=n(Na)=2440=0.6 mol,所以n(Cl2)=0.3 mol,V(Cl2)=n·Vm=0.3 mol×22.4 L·mol-1=6.72 L。(2)已知氯元素总物质的量浓度=nV=0.6250 mL×10-3=2.4 mol·L-1。设c(ClO-)=x,则有c(Cl-)=6x mol·L-1,c(ClO-4)=2.4-7x(氯元素守恒),6x=x+5×(2.4-7x)(得失电子守恒),解得x=0.3,故c(ClO-)=0.3 mol·L-1。(设计意图:真题感悟,训练利用守恒思想建立等量关系式)

【例2】38.4 g铜与适量的浓硝酸反应,铜全部作用后,共收集到气体22.4 L(标准状况)(不考虑生成N2O4)。则①反应消耗的HNO3的物质的量是多少?②生成的NO和NO2物质的量各为多少?【答案】①2.2 mol ②n(NO2)=0.9 mol n(NO)=0.1 mol【解析】①硝酸反应之后有两种去向,一是作氧化剂被还原为氮氧化物NO和NO2共1 mol,二是作酸反应产物为Cu(NO3)2,n[Cu(NO3)2]=0.6 mol,故反应消耗的硝酸为2.2 mol;②设n(NO2)=x mol,n(NO)=y mol,应用得失电子守恒,x+3y=1.2,x+y=1,解得x=0.9 mol,y=0.1 mol,故n(NO2)=0.9 mol,n(NO)=0.1 mol。(设计意图:感悟守恒思想在计算中的综合运用)思考讨论:不同守恒规律适用于什么样的体系?1.溶液中常用离子的电荷守恒和物料守恒。2.氧化还原反应得失电子守恒。 3.多步反应中考虑某一元素的始态和终态,联系元素守恒。 4.化学反应中涉及质量有关的问题可考虑质量守恒。 5.具体问题具体分析,综合考虑,往往是几种守恒关系联合运用,如选考第23题酸碱中和滴定联系电荷守恒、物料守恒、质子守恒。四、课堂小结,作业布置本堂课我们系统地学习了应用守恒思想解决化学中的计算问题,以守恒思想作为微专题复习的开端,也希望大家在后续的微专题复习过程中多一些思考,对所学知识形成体系,把握好每一个微专题的学习,以更好的精神状态迎接选考。
三、小结
如何上好高三复习课一直是老师们在不断探究和思考的问题,新高考背景下切实提高复习效率必须转变传统的专题复习模式。选考分两次进行,第一次考试前怎么复习,考完之后怎么复习,都是摆在高三老师面前的难题。
微专题复习教学以全新的组织形式展开专题复习,有效解决了传统专题复习内容跨度大、教学时间长、教学效率低等问题。在高三第一学期参加化学选考,必须打破传统的一轮、二轮、三轮这种按部就班的复习模式,把微专题复习和一轮复习进行有效整合,不断探索、优化适合学生的有效的复习模式。


