超高压及酶解对虹鳟鱼I型胶原蛋白抗原性的影响
李晓辉,倪赛巧,王 翀,王彦波,张 岩,傅玲琳,
(1.浙江工商大学食品与生物工程学院,浙江食品质量安全工程研究院,浙江 杭州 310018;2.河北省食品检测研究院,河北 石家庄 050091)
鱼类过敏主要是由免疫球蛋白E(immunoglobulins E,IgE)介导的即时型过敏,主要症状为呕吐、腹泻等,严重时会引发过敏性休克,危及生命[1]。早在2001年,I型胶原蛋白(collagen,CO)已被证实有较强的过敏原性[2],是仅次于小清蛋白的鱼类过敏原,而且有研究表明日本50%左右的鱼过敏患者对I型胶原蛋白过敏[3]。I型胶原蛋白由2 条α1亚基和1 条α2亚基组成,呈三股螺旋结构,分子质量约为300 kDa[4]。I型胶原蛋白具有良好的生物相容性、易于生物降解、无毒性、结构稳定,已经广泛应用于食品、化妆品、生物医学材料等领域[5]。目前对鱼I型胶原蛋白的研究主要集中在提取与纯化以及其理化性质方面[6],但鲜见鱼I型胶原蛋白作为食物过敏原的研究。因此,鱼I型胶原蛋白的安全性问题更需要引起人们的重视。
超高压是一种非热力加工技术,通过破坏蛋白质的非共价键,改变蛋白质的三、四级结构,导致蛋白质变性,研究证实可以降低过敏原的致敏性[7]。而蛋白酶通过水解致敏蛋白质,改变蛋白质的三级结构,破坏构象表位,或者断裂酰胺键,破坏线性表位,减弱其免疫原性。Long Fangyu等[8]证实55 ℃时,500 MPa超高压维持10 min可降低南美白对虾原肌球蛋白(tropomyosin,TM)73.59%的致敏性。Yu Huilin等[9]分别采用煮沸、超声波煮沸结合、高压蒸煮处理拟穴青蟹中的TM,并对3 种方法进行比较分析,发现高压蒸煮是加快胃肠消化、减弱IgG/IgE结合力最有效的方式。韩建勋[10]对原肌球蛋白进行超高压处理,研究表明超高压处理导致TM致敏性发生波动性变化,200~300 MPa致敏性下降,400~500 MPa致敏性上升,600 MPa时致敏性又略微下降。Kato等[11]研究表明加压增强渗透性,使得部分蛋白溶解到周围溶液中,从而减少大米中的过敏蛋白含量。Shimakura等[12]发现经α-糜蛋白酶、胰蛋白酶、蛋白酶P酶解处理后,甲壳类的蛋白抽提物的免疫原性几乎完全丧失。经碱性蛋白酶水解后,大豆过敏原P34的过敏原性基本为0[13]。但是迄今为止,鲜见鱼I中型胶原蛋白抗原性消减的相关研究。鉴于此,本实验以虹鳟鱼过敏原I型胶原蛋白为研究对象,探讨了超高压和酶解技术对其抗原性的影响,为鱼类产品中胶原蛋白的过敏原消减提供技术支撑。
1 材料与方法
1.1 材料与试剂
虹鳟鱼(Oncorhynchus mykiss) 宁波今日食品有限公司。
Anti-Collagen I抗体(兔抗鱼I型胶原蛋白抗体)英国Abcam公司;辣根过氧化物酶(horseradish peroxidase,HRP)标羊抗兔IgG抗体 杭州联科生物技术有限公司;牛血清白蛋白(bovine serum albumin,BSA) 北京索莱宝科技有限公司;TMB显色液美国eBioscience公司;胰蛋白酶、α-糜蛋白酶 美国Sigma公司;木瓜蛋白酶 上海阿拉丁生化科技股份有限公司。
1.2 仪器与设备
HPB.A2-600/0.6超高压处理设备 天津市华泰森森生物工程技术有限公司;Versamax酶标仪美国Molecular Devices公司;全套电泳系统 美国Bio-Rad公司;Alpha化学发光凝胶成像仪 美国Protein Simple公司。
1.3 方法
1.3.1 胶原蛋白的提取与纯化
胶原蛋白的提取与纯化根据Liu Dasong[14]和Duan Rui[15]等的方法,并略作修改,操作均在4 ℃进行。首先将虹鳟鱼皮用剪刀剪成0.5 cm×0.5 cm的碎鱼皮,加入20 倍体积的0.1 mol/L NaOH溶液,搅拌,浸提36 h,每6 h换液1 次,去除杂蛋白和色素。过滤后用双蒸水反复清洗,直至洗出液为中性。沥干后加入20 倍体积的10%正丁醇溶液,搅拌,浸提24 h,每6 h换液一次,去除鱼皮中的脂肪。此后用双蒸水反复清洗碎鱼皮,沥干后加入30 倍体积的0.5 mol/L醋酸溶液,搅拌,浸提72 h,8 000×g离心15 min,取上清液。加入预先研磨好的NaCl粉末进行盐析,搅拌,直至最终盐浓度为0.8 mol/L,8 000×g离心15 min,取沉淀。沉淀复溶于0.5 mol/L醋酸,分别在外液为0.1 mol/L醋酸溶液和双蒸水中透析48 h,冻干得到虹鳟鱼I型胶原蛋白,保存于-80 ℃冰箱备用。
1.3.2 超高压处理
采用磷酸盐缓冲液(phosphate buffered saline,PBS)将胶原蛋白溶解并稀释至1 mg/mL,真空包装密封(无气泡),在25 ℃下超高压处理10 min,压力分别设置为100、200、300、400、500 MPa,阳性对照组为未进行超高压处理(0.1 MPa)的I型胶原蛋白。
1.3.3 酶处理
分别采用α-糜蛋白酶、木瓜蛋白酶、胰蛋白酶对1 mg/mL同批次I型胶原蛋白酶解处理20 min[16]。酶解温度为酶最适温度,pH值为酶相应最适pH值[17-19],酶与底物质量比(enzyme∶substrate,E∶S)分别为1∶100 000、1∶10 000、1∶1 000、1∶100、1∶10,酶解结束沸水浴5 min灭酶[12],灭酶后立即将样品置于冰上。阳性对照组为未进行酶处理的I型胶原蛋白。

表1 酶最适温度及pH值Table1 Optimal temperature and pH of proteases
1.3.4 SDS-PAGE分析
采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electropheresis,SDS-PAGE)对提取的I型胶原蛋白进行鉴定以及对处理前后蛋白分子质量变化进行检测[20]。分离胶为10%,浓缩胶为5%,样品的蛋白质量浓度均为1 mg/mL,上样量均为10 μL,初始电压为80 V,溴酚蓝指示剂到达分离胶与浓缩胶交界处改变电压为120 V。电泳结束后,用考马斯亮蓝R-250染色40 min,再用脱色液脱色直至蛋白条带清晰,用凝胶成像仪进行拍照,最后用AlphaView SA 3.4.0电泳图像处理软件进行分析。
1.3.5 抗原性分析
采用间接酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)法对超高压及酶解处理前后胶原蛋白的抗原性进行检测。用包被缓冲液将处理前后的I型胶原蛋白稀释至5 μg/mL,酶标板每孔加入100 μL,4 ℃包被过夜。去除包被液后每孔加入200 μL PBST(PBS+吐温20),清洗5 次,每次1 min,去除洗涤液后拍干。每孔加入200 μL封闭液(PBS+3% BSA),37 ℃下封闭2 h。去除封闭液,用洗涤液清洗5 次,拍干。每孔加入100 μL Anti-Collagen I抗体(稀释倍数4 000),37 ℃下孵育1.5 h。去除酶标板中的液体,用PBST清洗5 次,拍干。每孔加入100 μL HRP标羊抗兔IgG抗体(稀释倍数6 000),37 ℃下孵育1.5 h。去除酶标板中的液体,用PBST清洗5 次,拍干。每孔加入100 μL TMB显色液,37 ℃下避光孵育20 min。每孔加入50 μL 2 mol/L H2SO4终止反应,测定每孔在450 nm波长处的OD值[21]。未经任何处理的I型胶原蛋白为阳性对照,BSA为阴性对照。以OD450nm表示各组蛋白抗原性,两者呈正相关,并根据下式计算消减率[22]。
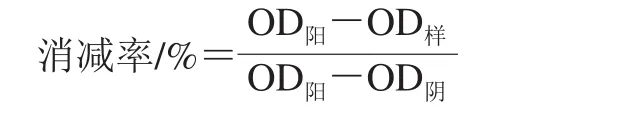
式中:OD阳为未经任何处理的I型胶原蛋白的OD值;OD样为处理后的I型胶原蛋白样品的OD值;OD阴为BSA的OD值。
1.4 数据处理
实验重复3 次,数据分析采用SPSS 16.0软件,各组数据采用单因素方差分析(One-way ANOVA),P<0.05表示具有显著差异。
2 结果与分析
2.1 I型胶原蛋白的提取与纯化
如图1所示,在电泳条件下,虹鳟鱼胶原蛋白稳定的三股螺旋结构被破坏,亚基发生解离。经0.5 mol/L醋酸提取以及盐析纯化得到的虹鳟鱼胶原蛋白由α1(约119.5 kDa)、α2(约107.5 kDa)、β(由α1和α2亚基组成,约200 kDa)以及少量γ亚基组成。经AlphaView SA 3.4.0电泳图像软件分析,提取的胶原蛋白纯度为85%,符合后续实验要求。这些结果与文献[23-25]报道的其他鱼I型胶原蛋白一致。
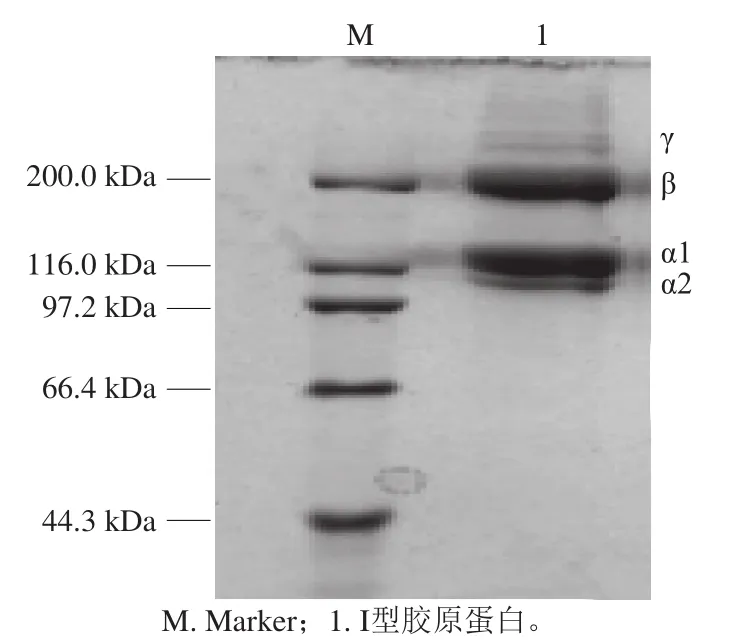
图1 I型胶原蛋白SDS-PAGE分析Fig. 1 Sodium dodecyl sulfate-polyacrylamide gel electrophoresis analysis of type I collagen
如图2所示,BSA是阴性对照,提取的胶原蛋白的OD450nm是阴性对照组的2.1 倍,所提蛋白能与鱼Anti-Collagen I抗体发生特异性反应,证实纯化得到的蛋白为I型胶原蛋白。
2.2 超高压对虹鳟鱼I型胶原蛋白分子质量的影响
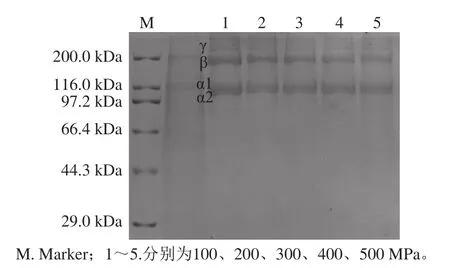
图3 超高压对I型胶原蛋白分子质量的影响Fig .3 Effect of HHP on molecular mass of type I collagen
图3 (超高压处理的蛋白)与图1(未处理的蛋白)进行比较,经超高压(100~500 MPa)处理后,虹鳟鱼I型胶原蛋白的α1、α2、β、γ亚基均未发生降解,表明压力的升高对I型胶原蛋白的分子质量没有影响。
2.3 酶解对虹鳟鱼I型胶原蛋白分子质量的影响
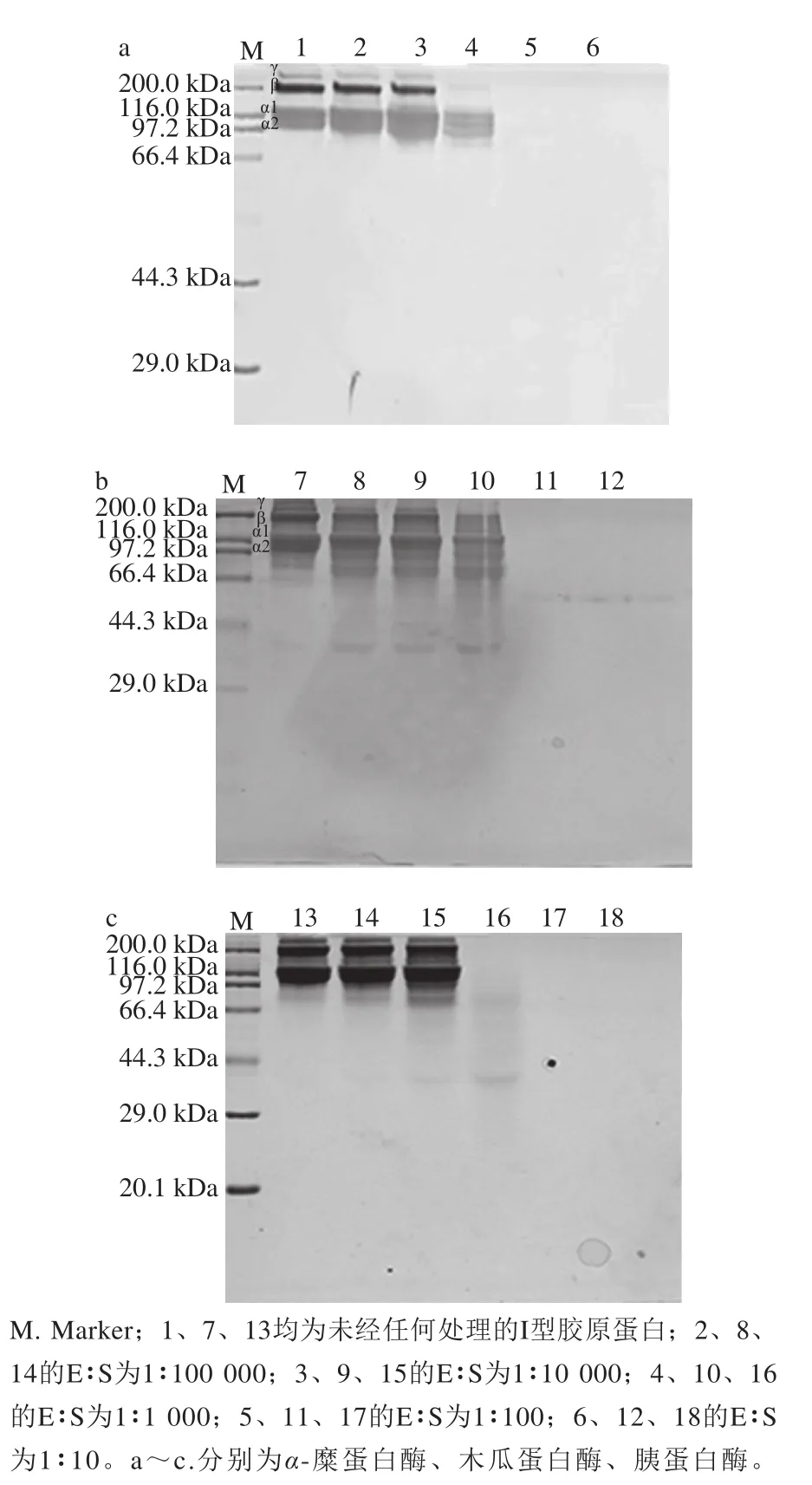
图4 酶解对I型胶原蛋白分子质量的影响Fig. 4 Effect of enzymatic hydrolysis on molecular mass of type I collagen
如图4所示,α-糜蛋白酶、木瓜蛋白酶及胰蛋白酶均能水解I型胶原蛋白。随着E∶S逐渐增大,α1、α2、β、γ亚基逐渐降解,直至电泳图中已无法观察到任何条带,表明I型胶原蛋白已充分水解成小分子质量蛋白或多肽。上述这3 种蛋白酶水解度都比较大,相比而言,胰蛋白酶的水解能力更强。SDS-PAGE只能反映蛋白质降解情况,无法反映蛋白质的抗原性,因此还需进行后续ELISA分析[26]。
2.4 超高压对虹鳟鱼I型胶原蛋白抗原性的影响
如图5、6所示,阳性对照组与超高压处理组进行比较,发现经过超高压处理后,I型胶原蛋白的抗原性均明显下降。超高压处理组间进行比较,随着压力逐渐升高至200 MPa时,I型胶原蛋白的抗原性呈下降趋势。25 ℃,200 MPa下,超高压处理10 min时,抗原性降至最低,抗原性消减了42.66%,可能是因为随着压力上升,I型胶原蛋白的空间构象发生改变,其构象表位被破坏,抗原性随之下降。而压力从200 MPa升至500 MPa时,抗原性又有所上升,但仍然低于阳性对照组,可能是因为结构发生变化,包埋于内部的线性表位暴露出来,抗原性也因此升高[27]。综上所述,超高压处理能有效降低虹鳟鱼I型胶原蛋白的抗原性。
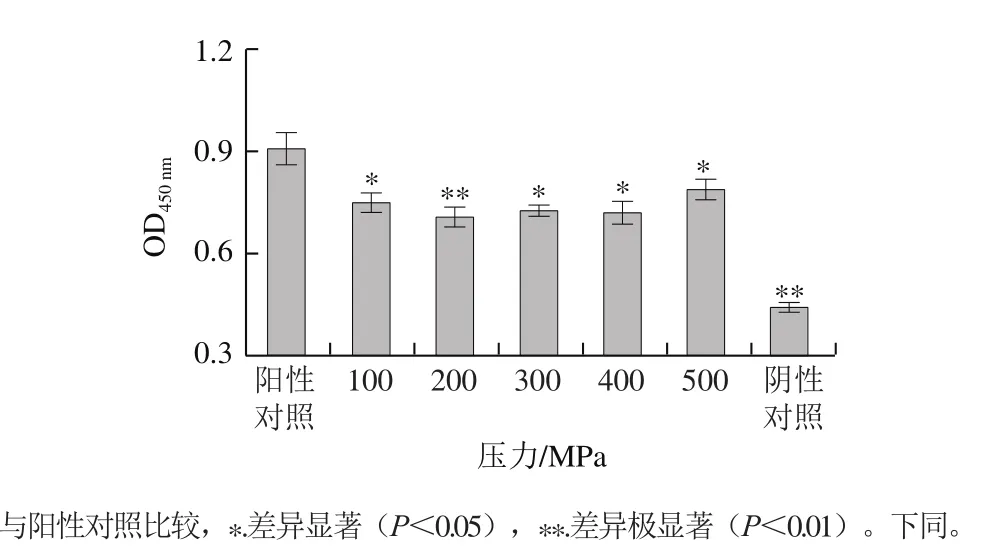
图5 压力对I型胶原蛋白抗原性的影响Fig. 5 Effect of pressure on antigenicity of type I collagen
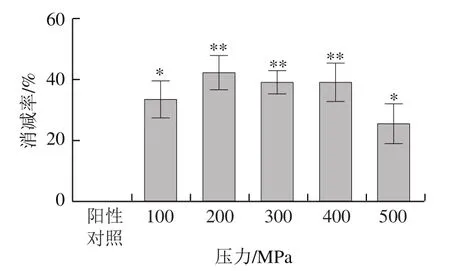
图6 压力对I型胶原蛋白抗原性消减率的影响Fig. 6 Effect of pressure on reduction rate of antigenicity of type I collagen
2.5 酶解对虹鳟鱼I型胶原蛋白抗原性的影响
2.5.1 α-糜蛋白酶水解对虹鳟鱼I型胶原蛋白抗原性的影响
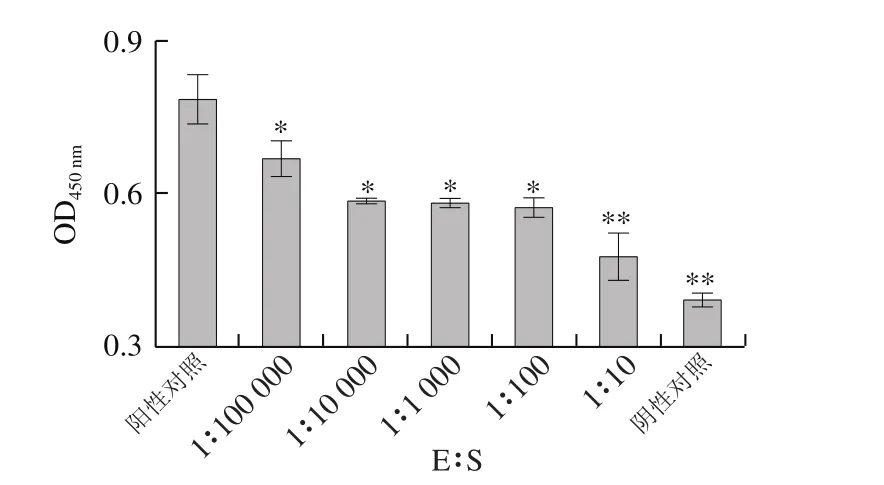
图7 α-糜蛋白酶与底物比对I型胶原蛋白抗原性的影响Fig. 7 Effect of chymotrysin/substrate ratio on antigenicity of type I collagen
如图7、8所示,阳性对照组与α-糜蛋白酶酶解处理组进行比较,发现经过α-糜蛋白酶水解后,I型胶原蛋白的抗原性均明显下降。而且随着E∶S增大,I型胶原蛋白的抗原性呈下降趋势,当37 ℃、pH 7.8、E∶S为1∶10,α-糜蛋白酶水解20 min时,I型胶原蛋白的抗原性最弱,抗原性减弱了78.21%。因此,α-糜蛋白酶水解能有效降低虹鳟鱼I型胶原蛋白的抗原性。
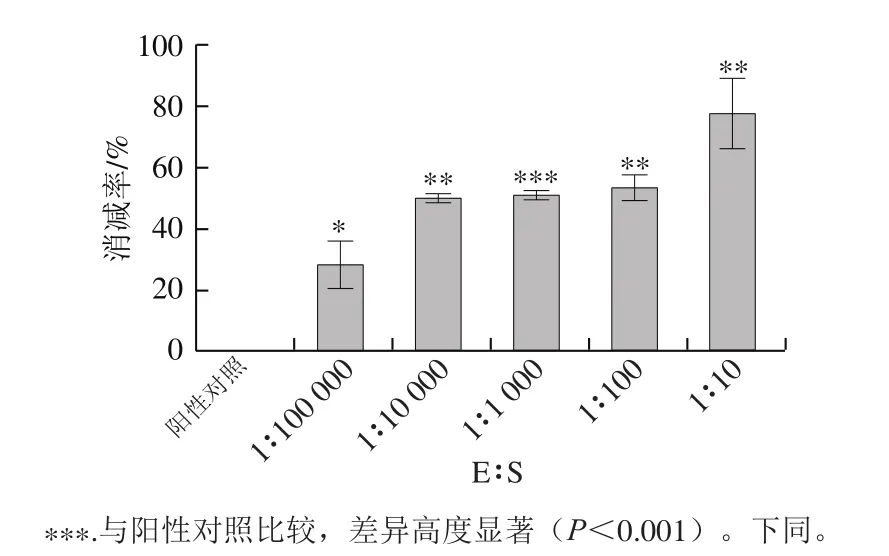
图8 α-糜蛋白酶与底物比对I型胶原蛋白抗原性消减率的影响Fig. 8 Effect of chymotrypsin/substrate ratio on reduction rate of antigenicity of type I collagen
2.5.2 木瓜蛋白酶水解对虹鳟鱼I型胶原蛋白抗原性的影响
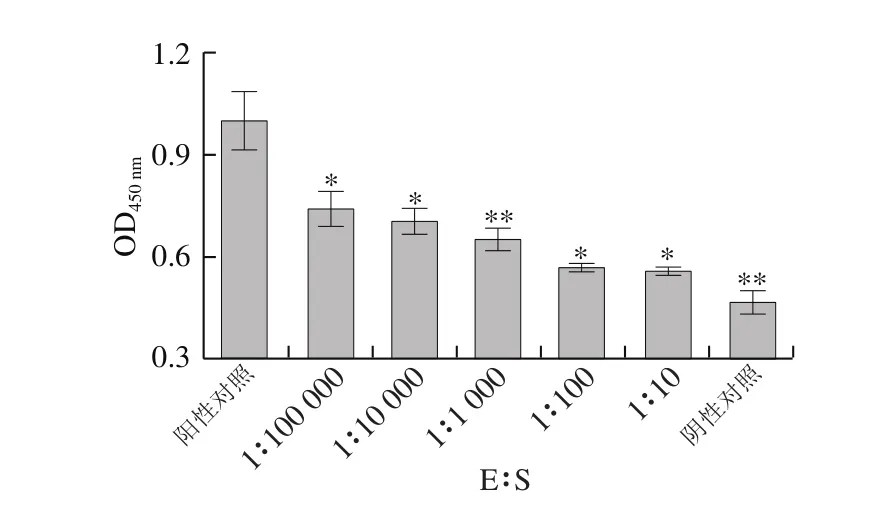
图9 木瓜蛋白酶与底物比对I型胶原蛋白抗原性的影响Fig .9 Effect of papain/substrate ratio on antigenicity of type I collagen
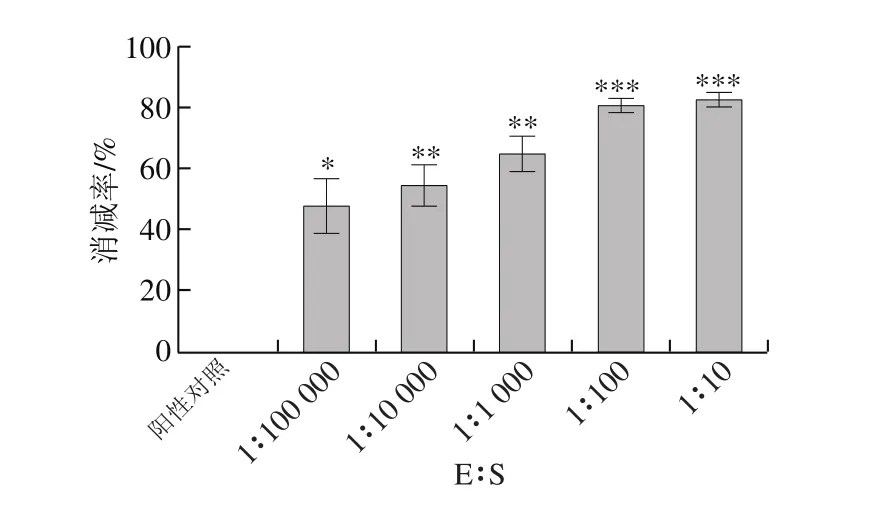
图10 木瓜蛋白酶与底物比对I型胶原蛋白抗原性消减率的影响Fig .10 Effect of papain/substrate ratio on reduction rate of antigenicity of type I collagen
如图9、10所示,阳性对照组与木瓜蛋白酶酶解处理组进行比较,发现经过木瓜蛋白酶水解后,I型胶原蛋白的抗原性均得到有效消减。而且E∶S越大,I型胶原蛋白的抗原性越弱,当37 ℃、pH 7.8、E∶S为1∶10,木瓜蛋白酶水解20 min时,I型胶原蛋白的抗原性最弱,抗原性降低了78.21%。综上所述,与α-糜蛋白酶比较,木瓜蛋白酶水解能更有效降低虹鳟鱼I型胶原蛋白的抗原性。
2.5.3 胰蛋白酶水解对虹鳟鱼I型胶原蛋白抗原性的影响
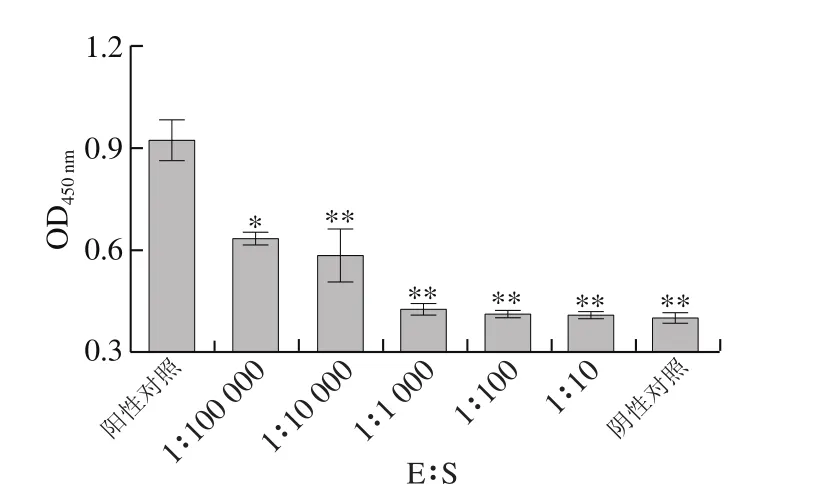
图11 胰蛋白酶与底物比对I型胶原蛋白抗原性的影响Fig. 11 Effect of trypsin/substrate ratio on antigenicity of type I collagen
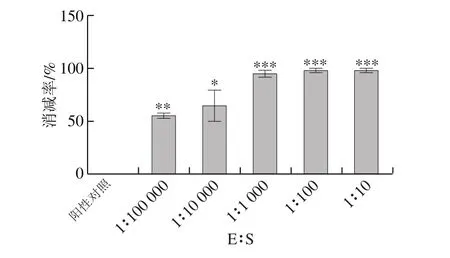
图12 胰蛋白酶与底物比对I型胶原蛋白抗原性消减率的影响Fig .12 Effect of trypsin/substrate ratio on reduction rate of antigenicity of type I collagen
如图11、12所示,阳性对照组与胰蛋白酶酶解处理组进行比较,发现经过胰蛋白酶水解后,I型胶原蛋白的抗原性急剧下降。当E∶S从1∶100 000增加至1∶1 000,I型胶原蛋白的抗原性快速下降,当E∶S从1∶1 000增加至1∶10时,鱼I型胶原蛋白抗原性下降缓慢。因此,温度45 ℃、pH 8.0、酶解时间20 min、E∶S为1∶10,是胰蛋白酶水解消减I型胶原蛋白抗原性的最佳酶解条件。E∶S为1∶10的酶解组与阴性对照组进行比较,没有显著差异(P>0.05),表明经E∶S为1∶10的胰蛋白酶水解后,虹鳟鱼I型胶原蛋白的抗原性几乎完全丧失。与上述两种蛋白酶进行比较,胰蛋白酶是降低虹鳟鱼I型胶原蛋白抗原性的最佳蛋白酶。
3 讨 论
有研究表明不仅I型胶原蛋白有较强的致敏性,变性胶原蛋白(明胶)也存在过敏原免疫活性[28]。即使140 ℃加热10 min或100 ℃加热320 min,I型胶原蛋白发生降解,但其过敏原性仍未改变[29],表明热处理无法消减鱼I型胶原蛋白的过敏原活性。相比于其他食物过敏原消减技术,超高压及酶解操作较为简便,而且这两种技术已成功降低了多种过敏原的致敏性。因此,本实验采用这两种技术探讨其对I型胶原蛋白抗原性的影响。
间接ELISA结果表明I型胶原蛋白的抗原性随着压力的升高呈“U”形趋势,而在最佳超高压条件即200 MPa时,I型胶原蛋白的抗原性能减弱42.66%。另外,经α-糜蛋白酶、木瓜蛋白酶、胰蛋白酶酶解后,I型胶原蛋白的抗原性均明显下降,而且随着E∶S的增加呈下降趋势。酶处理后I型胶原蛋白发生水解,这是酶解降低虹鳟鱼I型胶原蛋白的抗原性的机制之一。是否存在其他机制,还有待于进一步的研究。胰蛋白酶对I型胶原蛋白的抗原效果最佳,木瓜蛋白酶次之,α-糜蛋白酶最弱,尤其当酶为胰蛋白酶,45 ℃、pH 8.0、E∶S为1∶10、水解20 min时,虹鳟鱼I型胶原蛋白的抗原性几乎完全丧失,抗原性能减弱97.69%。上述结果可能是胰蛋白酶的水解能力比α-糜蛋白酶和木瓜蛋白酶的水解能力强导致的。超高压处理与酶解处理的I型胶原蛋白是同一批次提取的I型胶原蛋白,因此,超高压及酶解这两种方法对虹鳟鱼I型胶原蛋白抗原性的影响具有可比性。与超高压处理比较,酶解是消减虹鳟鱼I型胶原蛋白的抗原性更为有效的方式。造成该结果的原因可能是超高压只能通过改变空间结构破坏构象表位,而酶解处理既可以破坏构象表位又可以破坏过敏原的线性表位。综上所述,45 ℃、pH 8.0、E∶S为1∶10,胰蛋白酶酶解20 min是消减虹鳟鱼I型胶原蛋白的抗原性的最佳方式。
虽然超高压处理最高只能降低I型胶原蛋白42.66%的抗原性,而酶解能使I型胶原蛋白的抗原性几乎完全丧失。但是超高压作为非热加工技术,用于食物保存,能够延长保质期,对食品本身的口味及营养影响较小,而在酶解过程中,可能会产生苦味肽等物质,影响口味[30]。而且蛋白酶不只水解过敏蛋白,还会水解食物中的其他蛋白,可能会造成营养损失。因此,在以后的研究中需进行品质研究及感官评价,并建立一个既能降低过敏原性又不影响营养、感官等品质的方法。

