羊口疮病毒榆林株B2L和F1L串联基因在昆虫杆状病毒系统的表达
冯 平,李云章,孙丰廷,屈 雷,闫海龙
(1内蒙古农业大学 兽医学院,内蒙古 呼和浩特 010018;2榆林学院 生命科学学院,陕西 榆林 719000;3武汉中拓康明生物科技有限公司,湖北 武汉 430040)
羊口疮病毒(Orf virus,ORFV)又称为接触传染性脓疱皮炎病毒(Contagious pustular dermatitis virus,CPDV),是人畜共患、接触性、嗜上皮性传染病羊口疮的病原[1]。ORFV属于痘病毒科脊索动物痘病毒亚科的副痘病毒属,病毒粒子呈椭圆形,大小约260 nm×160 nm,外面包绕着螺旋丝状结构,病毒粒子外常有囊膜包裹[2]。ORFV基因组庞大,约有135个基因Orf001-Orf135,其中Orf001-Orf008及Orf112-Orf135为末端反向重复序列区域,Orf009-Orf111为中央区基因组区域[3-4]。这些基因片段编码多种不同的蛋白,主要有抗细胞凋亡蛋白、羊口疮病毒干扰素抗性蛋白(Interferon resistance protein,IFNR)、粒细胞-巨噬细胞集落刺激因子(Granulocyte-macrophage colony stimulating factor,GM-CSF)、GM-CSF/IL-2(The inhibitor of granulocyte-macrophage colony stimulation factor/interleukin-2,GIF)、CEV-IL-10(A cytokine interleukin-10 orthologue,vIL-10)、血管内皮生长因子(Vascular endothelial growth factor,VEGF)、dUTPase 蛋白、 锚蛋白(ANK)重复蛋白、 趋化因子结合蛋白(Chemokine-binding protein,CBP)、42 ku 蛋白、39 ku 蛋白、10 ku 蛋白、DNA 聚合酶以及 RNA 聚合酶等[5-9]。目前,国内外学者对ORFV的研究主要集中在与病毒毒力、免疫调节以及免疫原性相关的蛋白方面,如与病毒毒力和免疫逃避有关的 IL-10和VEGF 等,与宿主免疫防御机制和免疫逃避有关的免疫调节蛋白OV_IFNR、GIF、vIL-10和VEGF等,以及能刺激机体产生强烈免疫反应且具有免疫原性的39和42 ku蛋白等[10-13]。
ORFV免疫反应以细胞免疫反应为主,但体液免疫反应也发挥着一定的作用[14-15]。42 ku蛋白由Orf011(B2L)基因编码,又称为B2L蛋白,是病毒表面囊膜的组成成分之一,能够刺激机体产生强烈的体液免疫应答,同时还可引起淋巴细胞的增殖分化[16],被广泛应用于副痘病毒属的实验室检测[17-18]。
39 ku蛋白又称为F1L蛋白,由Orf059(F1L)基因编码,F1L基因长1 005 bp,位于ORFV基因组比较保守的中部区域[19]。有研究证实,利用纯化的不同ORFV毒株分别制备单克隆抗体,然后通过免疫荧光技术成功检测到3种单克隆抗体均与病毒颗粒表面的囊膜特异性结合,而F1L蛋白和22 ku蛋白则是ORFV单克隆抗体的主要结合位点。蛋白免疫印迹试验发现,利用ORFV制备的兔抗羊口疮病毒多克隆血清,也能检测到F1L蛋白和22 ku蛋白条带,这表明F1L蛋白为免疫原性蛋白[20]。同时还有研究表明,宿主体液免疫产生的抗体主要与F1L蛋白结合,该蛋白是病毒表面微管的组成成分之一,能够刺激宿主产生中和抗体,该结果进一步证实F1L蛋白是免疫原性蛋白[21]。此外,该蛋白能够与表达于大多数哺乳动物细胞表面的硫酸乙酰肝素(HS)受体结合,在病毒吸附和侵入过程中起重要作用[12]。鉴于此蛋白的重要性,国内外学者对其高度关注,以期将其应用于基因工程疫苗的研制及疾病的诊断等方面。
目前,疫苗接种被认为是预防和控制该病可靠且有效的手段。国外已有羊口疮弱毒疫苗,但我国市场上尚无口疮弱毒疫苗供应。由于弱毒疫苗本身存在毒力返强、病毒扩散等缺陷。因此,研制使用简单、方便、免疫效果确实的羊口疮基因工程亚单位疫苗已成为防控羊口疮疫病的必然趋势。目前,ORFV的2种主要抗原基因B2L和F1L已经在不同的系统中获得了单独或共同表达,如原核系统和真核表达载体pCDNA3.1、pVAX1等[22-25]。此外,国内已经研发出B2L基因的重组菌,该重组菌可以传代且高效表达B2L蛋白[26]。然而,原核系统表达的蛋白缺乏相关的翻译后修饰,而目的蛋白在pCDNA3.1、pVAX1质粒中的表达具有水平低、费用高、操作复杂、周期长等缺点。
本课题组从陕西榆林发病的陕北白绒山羊病料中分离出ORFV-Yulin株,并在杆状病毒表达系统中对其B2L全长基因进行了表达[27],本研究拟进一步对ORFV-Yulin株的F1L全长基因进行扩增和序列分析,并采用杆状病毒表达系统对B2L和F1L进行串联表达,以期为羊口疮基因工程亚单位疫苗的研制奠定基础。
1 材料与方法
1.1 材 料
1.1.1 载体、菌株与主要试剂 MDBK细胞、昆虫杆状病毒表达系统质粒pBac5、线性化的 Bacmid、陕北白绒山羊ORFV榆林株ORFV-YulinB2L基因T载体(pGT-B2L),均由本实验室保存;Top10大肠杆菌感受态细胞、预染蛋白Marker(CW0986M)、SDS-PAGE上样缓冲液(CW0027A),购自康为世纪生物科技有限公司;PCR 反应试剂、pGEM-Teasy载体、PrimeSTAR®HS高保真聚合酶、总DNA提取试剂盒、DNA Marker,均购自TaKaRa公司;质粒DNA小量制备试剂盒和DNA凝胶回收试剂盒,购自OMGA公司;细胞转染试剂(Sofast,11103),购自梭华公司;抗His-Tag Mouse(KM8001)、HRP标记的山羊抗鼠二抗(LK2003),购自天津三箭生物科技有限公司;昆虫细胞培养基SFX-Insect(SH30278.02),购自HyClone。
1.1.2 引物设计 参照GenBank中登录的ORFVF1L基因序列(GenBank登录号KU199840.1)设计引物1F/1R,用于扩增F1L基因。根据B2L[27]和F1L的测序结果,分别设计串联的杆状病毒表达引物2F/2R和3F/3R,引物均由中美泰和公司合成,其序列见表1。
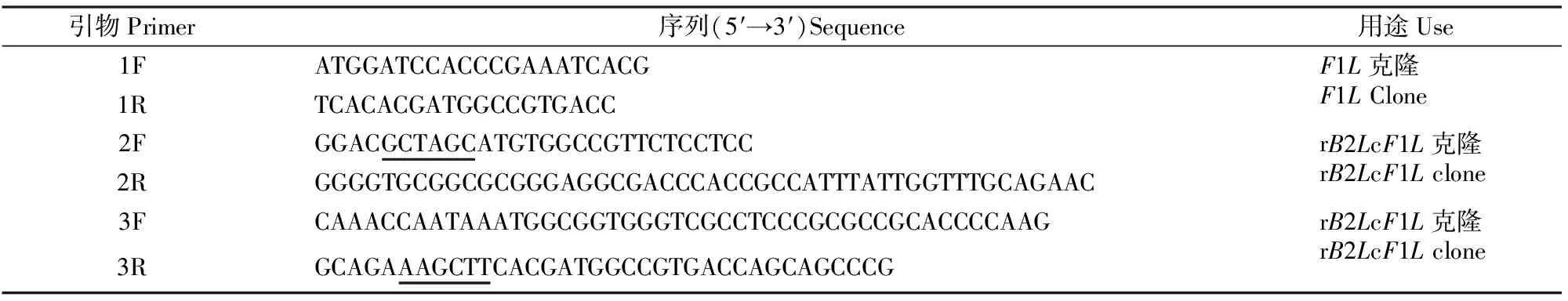
表1 本研究中所用到的引物及其序列Table 1 Primers and their sequences used in this study
注:2F和3R序列中的下划线部分分别是NheⅠ和HindⅢ酶切位点。
Note: The underlined in sequences of 2F and 3R represent the cleavage sitesNheⅠ andHindⅢ,respectively.
1.2 F1L全长基因的扩增
用总DNA提取试剂盒从ORFV-Yulin株转染细胞中提取ORFV的DNA,以之为模板,用表1中的克隆引物1F/1R进行PCR扩增。PCR反应体系为50 μL:5×PrimeSTAR®Buffer(Mg2+plus)10 μL,dNTPs(25 mmol/L) 4 μL,引物1F和1R(25 pmol/μL)各1 μL,DNA模板4 μL,PrimeSTAR®HS高保真聚合酶0.5 μL,加ddH2O补足50 μL。扩增条件为:98 ℃ 1 min;98 ℃ 10 s,55 ℃ 30 s,72 ℃ 80 s,35个循环;72 ℃ 10 min。PCR 产物用1%琼脂糖凝胶进行电泳检测。
1.3 F1L全长基因的遗传变异分析
用DNA凝胶回收试剂盒回收PCR产物,将其与pGEM-Teasy载体连接后,转化Top10大肠杆菌感受态细胞,挑单菌落进行PCR鉴定(PCR反应程序同上),提取阳性菌落质粒送中美泰和公司测序,将阳性质粒命名为pGT-F1L。从GenBank中选取其他15株ORFV毒株(表2)的F1L基因序列,利用DNAStar分析本试验分离毒株与这15株参考毒株核苷酸和推导的氨基酸序列的相似性并构建遗传进化树。
1.4 融合基因rB2LcF1L的PCR扩增与pGT-rB2LcF1L的构建
分别以pGT-B2L和1.3中获得的阳性质粒pGT-F1L为模板,用表1中的表达载体引物2F/2R和3F/3R,分别扩增B2L融合基因(rB2L)和F1L去掉编码1-70位氨基酸信号肽的核苷酸融合基因(cF1L),反应体系和程序同上。rB2L和cF1L融合基因的PCR产物经1%琼脂糖凝胶电泳检测后,回收纯化,送中美泰和公司测序后进行融合PCR扩增。

表2 本研究中用到的其他ORFV毒株信息Table 2 Information of ORFV strains used in this study
利用碱基linker连接,通过重叠PCR扩增获得ORFV rB2L-linker-cF1L融合基因(rB2LcF1L)。融合PCR扩增体系为50 μL:5×PrimeSTAR®Buffer(Mg2+plus) 10 μL,dNTPs(25 mmol/L) 4 μL,rB2L和cF1L融合PCR模板各4 μL,PrimeSTAR®HS高保真聚合酶0.5 μL,加ddH2O补足50 μL。扩增程序为:98 ℃ 1 min;98 ℃ 10 s,56 ℃ 30 s,72 ℃ 70 s ,10个循环。然后取1 μL前述 PCR产物作为第2次PCR的模板,以2F和3R为引物进行PCR扩增,反应体系为50 μL:5×PrimeSTAR®Buffer(Mg2+plus)10 μL,dNTPs(25 mmol/L) 4 μL,模板1 μL,引物2F、3R(25 pmol/μL)各1 μL, PrimeSTAR®HS高保真聚合酶0.5 μL,加ddH2O补足50 μL。扩增程序为:98 ℃ 1 min;98 ℃ 10 s,55 ℃ 30 s,72 ℃ 120 s ,35个循环;72 ℃ 10 min。PCR 产物用1%琼脂糖凝胶进行电泳检测。
切胶回收rB2LcF1L基因,将其与pGEM-Teasy载体连接后,转化Top10大肠杆菌感受态细胞,挑取单菌落进行PCR鉴定(反应体系和反应程序同第2次PCR),提取阳性菌落质粒进行NheⅠ和HindⅢ双酶切鉴定后,送中美泰和公司测序,将阳性质粒命名为pGT-rB2LcF1L。
1.5 rB2LcF1L在昆虫杆状病毒表达系统中的表达
1.5.1 昆虫杆状病毒表达载体pBac-rB2LcF1L的构建 将pGT-rB2LcF1L和杆状病毒表达载体pBac5分别用NheⅠ和HindⅢ双酶切后连接,均转化Top10大肠杆菌感受态细胞,挑取单菌落进行PCR鉴定(反应体系和反应程序同1.4节第2次PCR扩增),提取阳性菌落质粒进行NheⅠ和HindⅢ双酶切鉴定,将鉴定正确的质粒送中美泰和公司测序。将阳性质粒命名为pBac-rB2LcF1L。
1.5.2 昆虫杆状病毒的包装 取6孔细胞培养板,以1×106mL-1的细胞密度接种生长状态良好的sf9细胞,置于27 ℃培养2 h,待细胞的融合度达到80%左右时进行转染。用100 μL无血清培养基将3 μg pBac-rB2LcF1L与3 μg线性化的 Bacmid混匀,作为溶液Ⅰ;用100 μL无血清培养基稀释5 μL的梭华转染试剂后,缓慢滴加到溶液Ⅰ中,混匀,静置20 min。将混合液加入到上述接种了sf9的细胞板中,27 ℃孵育5~7 d,荧光显微镜下观察报告基因cGFP的表达情况,待病变细胞达到90%以上后收获细胞上清液于1 mL离心管中,标注为P1代重组杆状病毒,-80 ℃长期保存。
1.5.3 B2L和F1L重组蛋白在sf9细胞中的表达与验证 将sf9细胞按照2.5×106mL-1的细胞总数铺入T25方瓶,待细胞贴壁2 h后,用1 mL注射器将100 μL P1代病毒盲接到T25方瓶中,培养5~7 d,观察荧光,收取细胞上清液和细胞样品备用。向细胞样品中加入适量的SDS-PAGE上样缓冲液,沸水浴5~10 min后,以8 000 r/min离心5 min,取上清液。对细胞上清液和细胞处理后的样品,用12%的SDS-PAGE检测重组蛋白的表达情况。切取凝胶上的目的蛋白条带,送华大基因公司进行质谱鉴定。与此同时,将上述样品经SDS-PAGE电泳后转印至硝酸纤维素膜(NC膜)上,分别以His标签抗体为一抗、HRP标记的山羊抗鼠IgG为二抗进行孵育,用ECL显色液进行显色,最后在化学发光仪中曝光。
2 结果与分析
2.1 F1L全长基因的PCR扩增及序列分析
琼脂糖凝胶电泳结果(图1)显示,扩增产物条带长度为1 029 bp左右,与预期结果相符。序列分析结果显示,ORFV-Yulin株的F1L高度保守,与表2中15株参比毒株核苷酸的相似性为96.7%~99.0%,氨基酸的相似性为96.1%~99.4%,其中与ORFV FJ-MH2015株F1L序列核苷酸和氨基酸的相似性最高,分别为99.0%和99.4%。F1L基因的遗传进化分析结果(图2)显示,该毒株与参考毒株XP(KM675408.1)、FJ-MH2015(KU199840.1)以及Shanxi(HQ221964.1)株处于同一进化分支上。
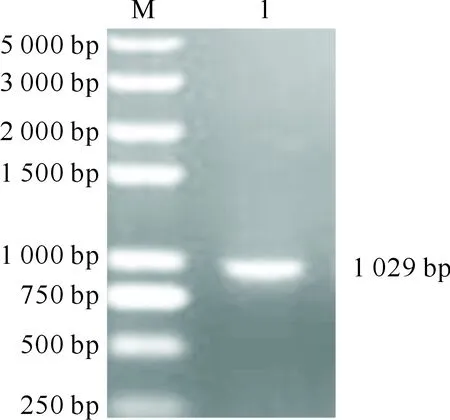
M.DL5000 DNA Marker;1.F1L基因全长扩增产物M.DL5000 DNA Marker;1.Amplification product of full-length F1L gene图1 ORFV-Yulin株F1L基因的PCR扩增结果Fig.1 PCR amplification of F1L of ORFV-Yulin
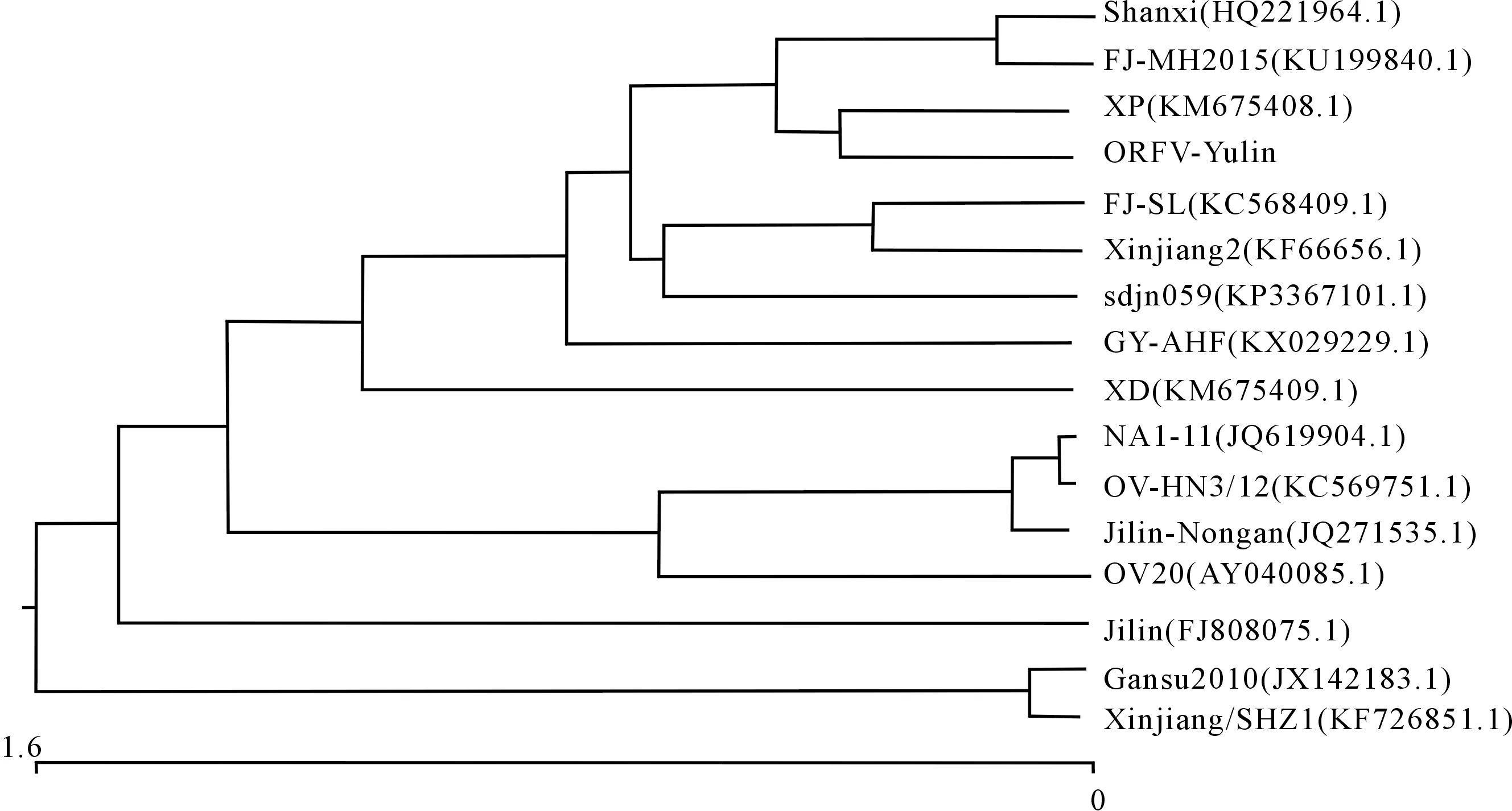
图2 ORFV-Yulin株F1L基因的遗传进化分析Fig.2 Phylogenetic tree according to F1L gene of ORFV-Yulin
2.2 rB2LcF1L融合基因的扩增
2.2.1 cF1L融合基因的扩增 由图3可知,cF1L扩增获得了855 bp的片段,与预期结果相符。将纯化后的PCR产物送中美泰和公司测序,结果正确。
2.2.2 rB2L融合基因的扩增 图4显示,rB2L扩增获得了1 180 bp的片段,与预期结果相符。将纯化后的PCR产物送中美泰和公司测序,结果正确。

M.DL5000 DNA Marker;1.cF1L基因扩增产物M.DL5000 DNA Marker;1.Amplification product of cF1L gene
2.2.3 rB2LcF1L融合基因的扩增 利用2.2.1和2.2.2中获得的PCR模板进行融合PCR,获得目的片段(1 983 bp)后与pGEM-Teasy载体连接,获得载体pGT-rB2LcF1L。对pGT-rB2LcF1L进行NheⅠ和HindⅢ双酶切鉴定,结果获得了3 000和1 983 bp的片段(图5),与预期结果相符。将该质粒送美泰和公司测序,结果正确。

M.DL5000 DNA Marker;1.质粒pGT-rB2LcF1LM.DL5000 DNA Marker;1.The plasmid pGT-rB2LcF1L图5 pGT-rB2LcF1L的NheⅠ和HindⅢ双酶切鉴定Fig.5 Double digestion of pGT-rB2LcF1L with NheⅠ and HindⅢ
2.3 pBac-rB2LcF1L载体的鉴定
菌落PCR鉴定获得了1 983 bp的片段(图略),与预期结果一致。pBac-rB2LcF1L载体经NheⅠ和HindⅢ双酶切后获得了6 640和1 983 bp的片段(图6),其长度与预期结果相符,质粒pBac-rB2LcF1L测序鉴定结果正确,表明pBac-rB2LcF1L载体构建成功。
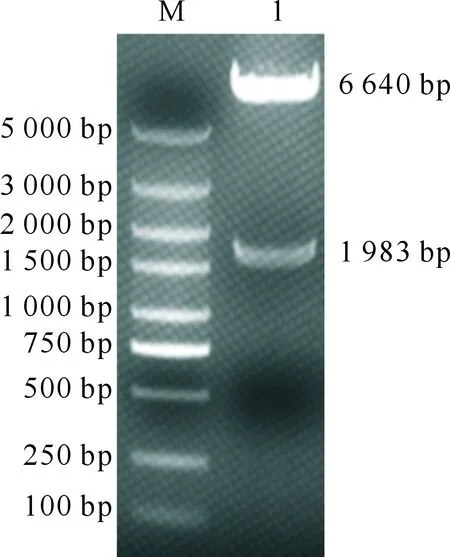
M.DL5000 DNA Marker;1.质粒pBac-rB2LcF1LM.DL5000 DNA Marker;1.The plasmid named pBac-rB2LcF1L图6 昆虫杆状病毒表达重组质粒pBac-rB2LcF1L的NheⅠ和HindⅢ双酶切鉴定Fig.6 Double digestion of recombinant baculovirus expression vector pBac-rB2LcF1L with NheⅠ and HindⅢ
2.4 rB2LcF1L融合蛋白在昆虫杆状病毒表达系统中的表达
2.4.1 表达rB2LcF1L的昆虫杆状病毒的包装 将质粒pBac-rB2LcF1L转染sf9细胞,27 ℃孵育5 d后即可观察到报告基因cGFP的表达,细胞可见绿色荧光(图7),表明杆状病毒包装成功,获得了表达rB2LcF1L融合蛋白的杆状病毒。
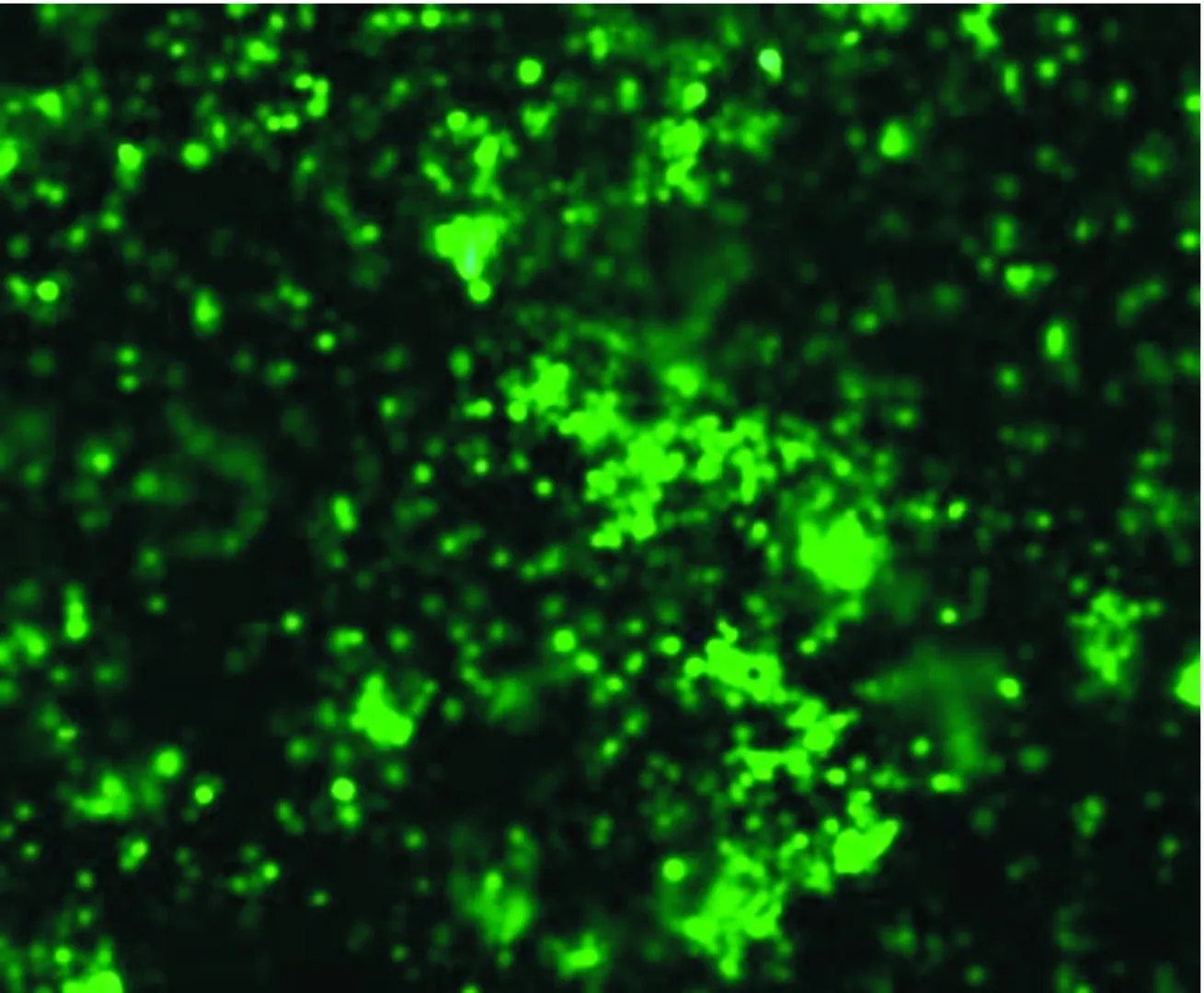
图7 表达融合蛋白rB2LcF1L的昆虫杆状病毒cGFP基因的表达(×200)Fig.7 Expression of cGFP in baculovirus expressing the rB2LcF1L protein of ORFV-Yulin (×200)
2.4.2 rB2LcF1L在sf9细胞中的表达 SDS-PAGE结果显示,细胞培养上清、细胞样品中均有1条明显的条带,分子质量约为80 ku(图8),表明融合蛋白rB2LcF1L在sf9细胞中得到了表达,且表达的蛋白有一部分可分泌到细胞外。
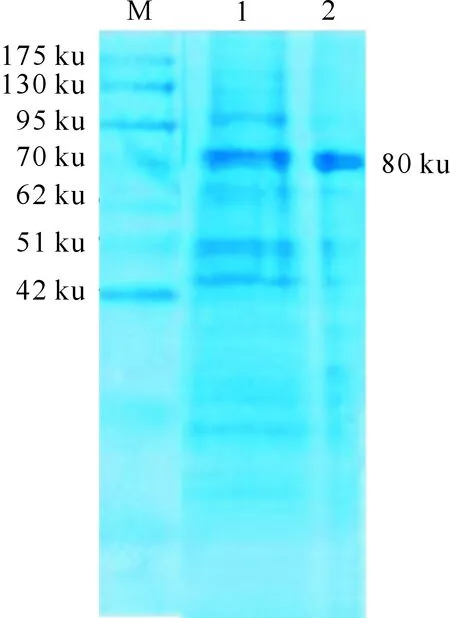
M.蛋白Marker;1.细胞上清;2.细胞沉淀M.Protein Marker;1.Cell supernatant;2.Cell precipitation图8 ORFV-Yulin 株rB2LcF1L在sf9细胞中的表达Fig.8 Expression of rB2LcF1L of ORFV-Yulin in sf9 cells
Western blotting结果(图9)和后续的谱鉴定结果均证实,B2LcF1L表达成功。
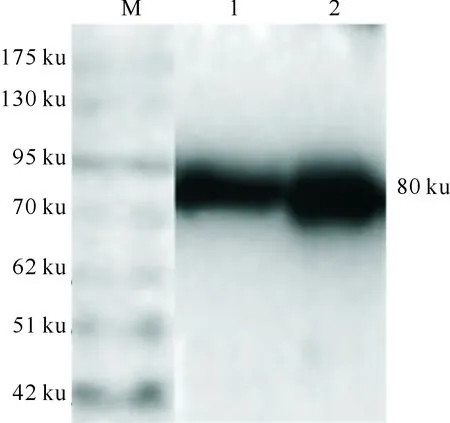
M.蛋白Marker;1.细胞上清;2.细胞沉淀M.Protein Marker;1.Cell supernatant;2.Cell precipitation图9 ORFV-Yulin株rB2LcF1L在sf9细胞中表达的Western blotting鉴定Fig.9 Western blotting of rB2LcF1L of ORFV-Yulin in sf9 cells
3 讨 论
李雯丽[28]对陕西省4个区/县的白绒山羊和奶山羊主要养殖基地进行了口疮病原的检测和发病率调查,结果发现,检出率最高的达82.6%,最低的也达到了24.1%,而且检出率最高羊场发生过相当严重的羊口疮疫情,导致大批量新生羔羊被淘汰,这说明陕西山羊口疮病毒携带率和发病情况不容乐观。本研究以本课题组前期从榆林市某白绒山羊场分离到的ORFV-Yulin株为研究对象,对其F1L的全长基因进行了克隆分析,发现ORFV-Yulin株的F1L与参考毒株FJ-MH2015(KU199840.1)、Shanxi(HQ221964.1)及XP(KM675408.1)F1L基因的相似度均高达99.0%,这表明羊口疮病毒的F1L基因高度保守。系统发育进化树分析表明,ORFV-Yulin株与FJ-MH2015(KU199840.1)、Shanxi(HQ221964.1)以及XP(KM675408.1)株同属于一个分支,而FJ-MH2015(KU199840.1)、Shanxi(HQ221964.1)以及XP(KM675408.1)等毒株的宿主均为山羊。综上所述,本课题组从白绒山羊疑似病例分离到的毒株可能与近年来山羊的频繁流动,既跨地区引种等因素有关。对F1L基因进行克隆和序列分析,有利于从分子水平上了解ORFV-Yulin株病毒,并且对白绒山羊种群中ORFV的流行病学调查、分子生物学研究及工程苗的研制和开发等具有重要意义。
由于ORFV具有免疫逃避机制,因此在动物感染该病毒后,机体无法获得终身免疫力,而且容易引起继发性感染。此外,由于羔羊免疫机制还未健全,因此尚不能通过注射疫苗的方式提高新生羔羊抵抗ORFV感染的能力,而母源特异性抗体的保护时间又较短,若ORF一旦流行,羔羊淘汰率势必增加。现在国外临床生产中应用的羊口疮疫苗多为弱毒苗,而羊口疮弱毒苗在生产和应用过程中会面临病毒扩散、毒力返强的风险。为此,安全性能高、免疫原性强、不存在宿主致病风险的羊口疮基因工程亚单位疫苗的研制就显得极为迫切。已有研究表明,F1L具有肝素结合活性,使该蛋白在细胞的吸附和侵入过程中可能起重要的作用[21]。与之相一致,Gallina等[12]研究发现,F1L重组蛋白能够刺激机体产生功效高效的中和抗体,可能通过阻止ORFV对宿主细胞的吸附而发挥免疫保护作用。而作为ORFV囊膜的重要组分,B2L蛋白够诱导机体产生高水平的IgG,王延璞等[26]将B2L基因与pGEM-4Z载体重组,获得了具有较高表达水平且能够传代的重组菌,这为ORFV亚单位疫苗的研制奠定了良好的基础。鉴于F1L和B2L蛋白的重要性,赵魁[7]构建了F1L和B2L基因单独表达以及串联表达的核酸疫苗,免疫效果优于单独F1L或B2L基因核酸疫苗,这说明F1L和B2L基因串联表达的重组蛋白的免疫效果应该更好。本试验将去掉信号肽区域的F1L和B2L基因串联,并在昆虫杆状病毒表达系统成功获得了部分分泌型的F1L和B2L串联重组蛋白,为以后ORFV基因工程亚单位疫苗的批量生产提供了一定的理论依据。

