乳清蛋白水解物结合吐温对O/W型乳状液稳定性的影响
王芳,李月,曹传爱,商旭,刘骞,*
(1.黑龙江职业学院,黑龙江哈尔滨150080;2.东北农业大学食品学院,黑龙江哈尔滨150030)
水包油型(Oil-in-water,O/W)乳状液是一种由分散在水相中的油滴组成的典型体系,存在于许多食品中,如沙拉酱、沙司、饮料、汤和婴儿配方食品等[1]。不幸的是,这种乳状液是一种高度不稳定的体系,因为它们由两种不混溶的液体组成[2]。乳化剂必须在均质前使用,才能获得动力学稳定的乳状液[3]。因此,乳化剂的选择对于食品乳液体系的高效设计至关重要。Ogawa等[4]研究表明食品乳化剂在均质过程中能粘附在新生成的液滴表面,在乳化液的贮存和利用过程中显著地降低了界面张力,稳定了液滴[5]。大多数研究都采用低分子量合成表面活性剂制备食品乳状液,主要是由于其界面扩散性能优于生物大分子,如蛋白质、多糖等[6-8]。Panya等[9]研究表明低分子量合成表面活性剂能提供更高的乳状液的表面积,从而提高物理稳定性,因为这种反应经常发生在油水界面上[10]。然而,pH值仍然是蛋白质稳定乳状液的最大缺点。此外,多糖用作乳化剂时,低浓度下很难制备出较为分散的乳状液,高浓度下非吸附性的多糖又容易导致乳状液絮凝,这对最终产品的质量有重大影响[11-13]。因此,需要找到可持续和生物相容的乳化剂用于食品乳状液中。
蛋白质水解物和相关的分离肽由于其不同的生物活性,近年来受到越来越多的关注。然而,更广泛的酶水解处理显著降低了蛋白质的乳化性能,却仅提高了溶解度[14]。Scherz等[15]表示尽管具有较高的水解度的蛋白水解产物具有增加溶解度和界面的扩散能力,但它们在常规乳化体系中也表现出较低的物理稳定性。Adjonu等[16]还建议通过研究更大的链蛋白水解物,可以提高多肽制备乳状液的物理稳定性。此外,最近的研究表明,限制/控制酶水解的蛋白质可以显著提高他们的乳化能力[17-18]。Lam等[19]表明高水解度的蛋白质水解物的乳化性能较弱主要是由于水相中残留的肽比例较大,而不是吸附在油水界面上。Ye等[20]还宣布,广泛地水解蛋白得到的水解产物由于短肽的大量生产而不利于O/W型乳状液的稳定性。因此,限制性水解的蛋白在两相乳化体系中能够增加相关产品的质量参数的稳定作用。通过研究限制性水解的蛋白以及在乳化体系中的作用机理,能够为生产健康、安全的食品提供理论基础,具有生产加工的理论和实际意义。
本试验研究了以Tween 20为乳化剂的大豆油水包油型(O/W型)乳状液,并添加不同浓度的限制性水解乳清蛋白,通过测定浊度、ζ-电势以及粒径等指标来探讨乳状液乳化稳定性的变化,为限制性水解蛋白质在食品体系中的应用提供理论依据。
1 材料与方法
1.1 材料
乳清分离蛋白:北京银河路商贸有限责任公司;中性蛋白酶(酶活为2.1 AU/g):丹麦Novozymes公司;大豆油:哈尔滨九三油脂;十二烷基磺酸钠(sodium dodecyl sulfate,SDS):Sigma 公司;磷酸二氢钠、磷酸氢二钠:天津市巴斯夫化工有限公司;氢氧化钠、盐酸:哈尔滨市万太生物药品公司。
1.2 仪器与设备
JJD500-2电子天平:沈阳龙腾电子称量仪器有限公司;AL-104型精密电子天平、FE20K型pH计:上海梅特勒-托利多仪器设备有限公司;DK-8B电热恒温水浴锅:上海惊宏实验设备有限公司;JB-2恒温磁力搅拌器:上海雷磁新径仪器有限公司;GL-21M冷冻离心机:湖南湘仪实验室仪器开发有限公司;Bakeman离心机;TU-1800紫外可见光分光光度计:北京普析通用仪器有限公司;T18匀浆机:德国IKA公司。
1.3 试验方法
1.3.1 乳清蛋白水解物的制备
根据 Liu等[19]的方法将加热处理(95℃,5 min)的乳清蛋白水溶液(4%,pH 7.5)用中性蛋白酶在50℃下水解1 h,酶与底物浓度质量比为2∶100,反应过程中不断加入1mol/L的NaOH,使pH值保持不变。水解结束后95℃水浴5 min进行灭酶,然后用1 mol/L HCl将水解液pH值调至7.0。水解物以9000g离心10min除去不溶颗粒。
1.3.2 乳状液的制备
分别向不同乳化剂的水溶液中加入10%的大豆油,用高速均质机在13 500 r/min下乳化2 min后,35 Mpa下经高压均质机均质两次。加入叠代钠(0.03%)进行抑菌。水相为10 mg/mL的Tween 20和不同浓度的WPH(0、1.25、2.5、5、7.5、10 mg/mL,终浓度)溶液的混合物。
1.3.3 乳清蛋白水解物水解度的测定
根据pH-Stat法[21]
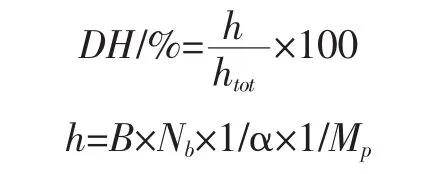
式中:h为单位质量蛋白质中被水解的肽键的量,mmol/g;htot为单位质量蛋白质中肽键的总量,mmol/g;B为水解过程中所消耗的碱量,mL;Nb为碱液的浓度,mol/l;Mp为水解液中蛋白质的质量,g;1/α 为校正系数。
1.3.4 乳清蛋白水解物乳化活性和乳化稳定性的测定
参照Pearce等[22]的方法,并略作修改。取8 mL的水解样品(1 mg/mL),将其加入到2 mL的大豆油中,分散乳化1 min,其参数设定为20 000 r/min。在乳化0和10 min后,分别取50 μL乳状液于装有5 mL 0.1%SDS溶液的离心管中,混匀后,在波长500 nm处进行比色,计算公式如下:
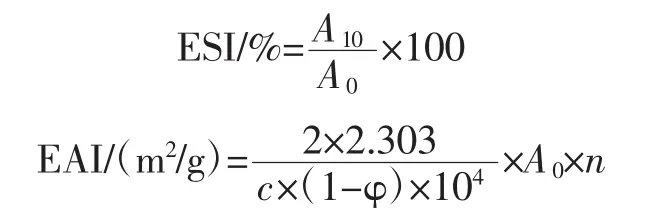
式中:A0为初始乳状液的吸光值;A10为乳状液静置10 min后的吸光值;C为样品溶液的蛋白浓度,g/mL;φ为乳状液中油相的比例;n为稀释倍数。
1.3.5 乳状液浊度的测定
参照Cheng等[23]的方法。新制备的乳状液立即加入离心管中,室温放置0和10 h。从距离心管底0.5 cm处取乳状液50 μL,加入装有5 mL 0.1%SDS的离心管中振荡混匀,在500 nm处测得的吸光度。浊度用500 nm下的吸光值A500表示。
1.3.6 乳化颗粒电位和粒径的测定
将乳状液 50 μL,加入到装有 5 mL,0.1 mol/L,pH 7.0的磷酸盐缓冲溶液中,混匀后注入到弯曲毛细管中,在常温下使用Malvern激光粒度仪测定稀释乳化颗粒的电位和粒径。
1.4 统计分析
每个试验重复3次,结果表示为平均值±标准差。数据统计分析采用Statistix 8.1(分析软件,St Paul,MN)软件包中Linear Models程序进行,差异显著性(P<0.05)分析使用Tukey HSD程序,采用Sigmaplot 11.0软件作图。
2 结果与分析
2.1 乳清蛋白水解物的乳化性质
使用中性蛋白酶不同水解时间制备的乳清蛋白水解物的水解度(degree of hydrolysis,DH)、乳化活性(emulsifying activity index,EAI) 和乳化稳定性(emulsion stability index,ESI)见表1。
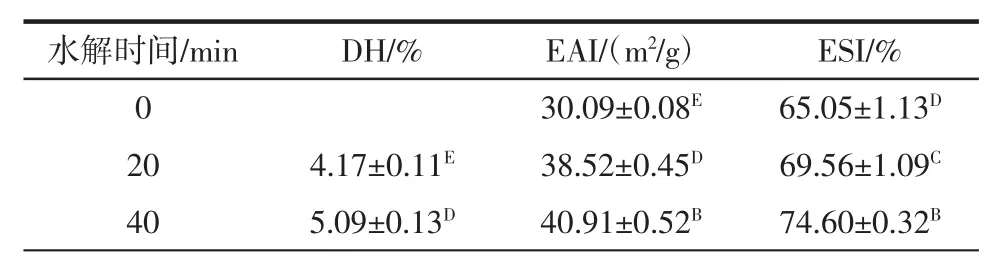
表1 使用中性蛋白酶不同水解时间制备的乳清蛋白水解物的水解度、乳化活性和乳化稳定性Table 1 Degree of hydrolysis(DH),emulsifying activity index(EAI)and emulsion stability index(ESI)of WPH prepared using neutral protease with different hydrolysis time
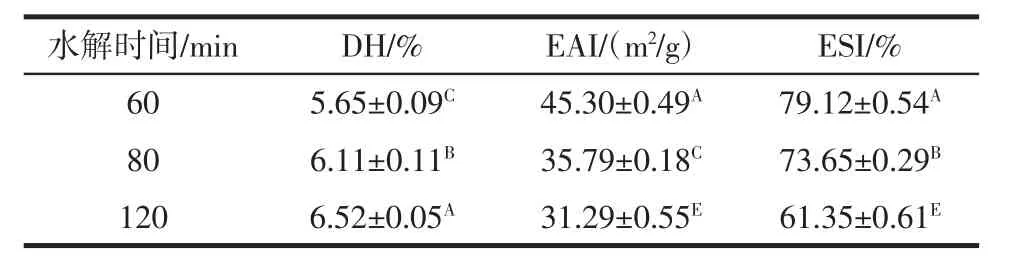
续表1 使用中性蛋白酶不同水解时间制备的乳清蛋白水解物的水解度、乳化活性和乳化稳定性Continue table 1 Degree of hydrolysis(DH),emulsifying activity index(EAI)and emulsion stability index(ESI)of WPH prepared using neutral protease with different hydrolysis time
随着反应时间从20 min增加到120 min,水解度显著增加(P<0.05),在乳清蛋白水解120 min时水解度达到6.52%。EAI代表蛋白质或蛋白质水解物形成和稳定乳状液的能力,而ESI指的是蛋白质或蛋白质水解物对乳状液施加强度以抵抗聚集和聚结的能力。通过乳化活性指数(EAI)和乳化稳定性指数(ESI)能够进一步反应大分子蛋白质和水解后小肽的乳化性质[24]。由表1中可以观察到随着水解时间的不断增加,EAI和ESI都呈现出先升后降的变化形势,并在水解60 min时,EAI和ESI达到最高值,分别为45.30 m2/g和79.12%,而进一步延长水解时间EAI和ESI反而越低。Christiansen等[25]研究表明控制酶水解可以改变蛋白质的结构和部分暴露疏水核心,乳化活性得到改善。低水解度的肽或水解物在油水界面的扩散速率比未水解的蛋白要高。用来稳定新生成的乳状液,能够防止聚集和聚结现象的发生[26]。此外,Yust等[27]研究表明高的乳化性能是通过控制水解形成的,主要是促进亲水和亲脂域之间的适当平衡。已有研究发现对蛋白质过度水解会使蛋白质的疏水性和亲水性残基失衡,并使EAI和ESI降低[20]。这可以解释为蛋白酶的水解使蛋白质的天然结构释放使更多亲水基团向外暴露,表面疏水性降低。初步试验表明,平衡水解能提高乳清蛋白的乳化活性。综上可知,中性蛋白酶水解乳清蛋白1 h具有最好的EAI和ESI。
2.2 乳清蛋白水解物对乳状液乳化性质的影响
2.2.1 乳状液的浊度
用不同浓度的WPH和Tween 20制备的乳状液的浊度如图2。
以WPH和Tween 20同时为乳化剂时,所有乳状液样品的浊度均较高,能够更有效地分散大豆油。这表明WPH和Tween 20作为共乳化剂的乳化活性效果很好。并且,随着WPH浓度的增加,乳状液的浊度呈现先升高后降低的变化趋势,当WPH的浓度为5 mg/mL时,乳状液的浊度达到最大值为1.18。当WPH浓度较大时,乳状液的浊度有所下降,这可以被解释为这较高浓度的蛋白质或水解物与Tween 20之间形成了竞争吸附。蛋白浓度较高时,更多的多肽吸附在了界面上,增加了乳化颗粒间的相互作用,导致了浊度的降低。Cheng等[23]的研究也表明,较高浓度的马铃薯蛋白水解物和Tween 20制备的乳状液的稳定性要低于低浓度条件下的。Dickinson和Golding[28]的研究发现蛋白的最适浓度能够产生油滴饱和表面覆盖率,达到较好的乳状液稳定性。然而,过高的浓度使未被吸附的蛋白产生絮凝。此外,Dickinson等[29]表示含有蛋白和Tween 20的乳状液具有明显的物理稳定性,这主要是由于某种形式的桥联作用。
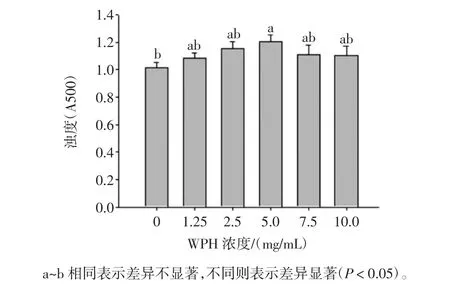
图1 不同浓度WPH制备乳状液的浊度的变化趋势Fig.1 Stability of canola oil-in-water emulsions prepared with different concentrations of WPH and Tween 20
2.2.2 乳状液的ζ-电势
不同浓度的WPH和Tween 20制备的O/W乳状液ζ-电势的变化趋势见表2。

表2 不同浓度的WPH和Tween 20制备的O/W乳状液ζ-电势的变化趋势Table 2 Values of ζ-potential of the oil-in-water emulsions prepared with different concentrations of WPH and Tween 20
ζ-电势是存在于乳状液颗粒的一个关键物理性质,代表在粒子表面附近发生的静电相互作用。高的ζ-电势(绝对值)意味着更大的静电斥力和更大的粒子间距离,这可以提高乳状液体系的稳定性。Nattapol等人[30]也表明,潜在的ζ-电势变化反映出液滴周围界面的组成。从表2中乳状液中WPH的浓度从1.25 mg/mL增加到10 mg/mL,ζ-电势(绝对值)呈现先升高后降低的变化趋势。在所有的样品中,WPH的浓度为5 mg/mL时ζ-电势值显著高于其他处理组(P>0.05),第0天和第10天分别为7.78和6.45。由于较高WPH浓度下,水相中含有大量未被吸收的多肽,可以将它们从界面上去除,从而导致较低的ζ-电势。Cheng等人[23]认为电荷减少可能是由于在界面处吸收的多肽数量较低。另一个可能的解释是,高粘度与高的WPH浓度相关,会对多肽的扩散产生负面影响,从而降低蛋白质在界面上的含量。因此,当WPH与Tween 20同时作为乳化剂时,将会导致乳化液滴表面电势的下降,液滴表面带有较低的净电荷,界面层多肽链间的静电斥力变弱,有助于在液滴表面形成厚实且致密的界面膜。此外,Thaiphanit等人[31]发现适度水解椰子蛋白有助于提高乳状液中液滴的负静电荷。
2.2.3 乳状液的粒径大小
不同浓度的WPH和Tween 20制备的O/W乳状液ζ-电势的变化趋势见表3。
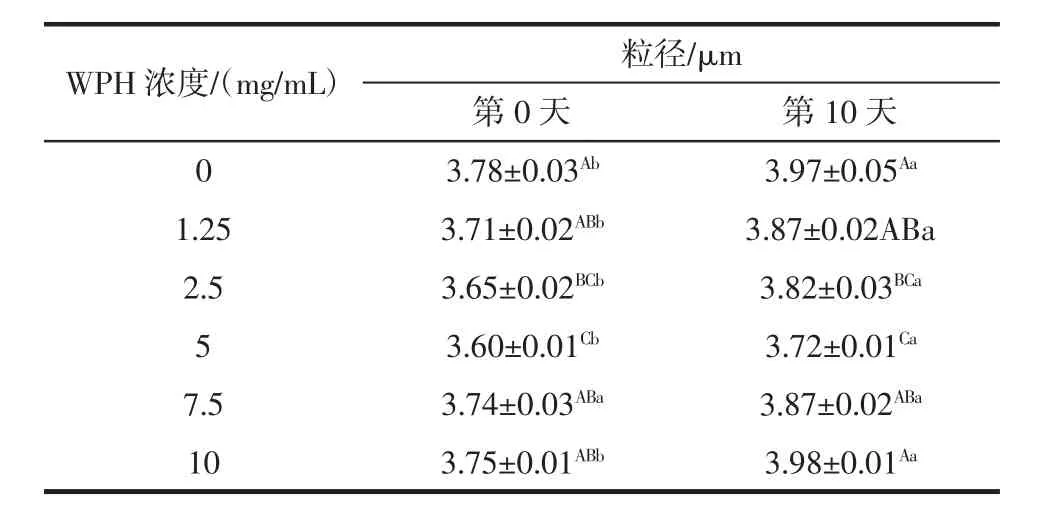
表3 不同浓度的WPH和Tween 20制备的O/W乳状液ζ-电势的变化趋势Table 3 Values of droplet size of the oil-in-water emulsions prepared with different concentrations of WPH and Tween 20
动态光散射(dynamic light scattering,DLS)是评价乳状液在贮存过程中凝结或絮凝变化的一种强有力的技术。从表3可以观察到,在第0天和第10天时,乳状液平均粒径(d4,3)都随着WPH的浓度从1.25 mg/mL增加到10 mg/mL而显著增加(P<0.05)。乳状液在贮藏10天后,含有不同浓度WPH的乳状液粒径都显著增大。这种现象可能与乳状液中液滴的聚集和凝结有关。WPH浓度为5 mg/mL时,乳状液的粒径达到最小值,浓度增加会引起粒径的显著增大。这可以解释为高WPH浓度引起更高的粒径可能是由于在这些液滴分散在连续相的密度差异,其次是相分离。乳状液的稳定性随液滴颗粒减小而增加,因为更多的乳化剂吸附到小颗粒表面。Thaiphanit等[32]还发现椰子蛋白水解物的表面有许多无定形的蛋白质大分子,而大量的这些大分子可能会使乳状液不稳定。Dimitrova等[33]还发现,Tween 20能提高液滴由于高胶束凝聚在油水界面的排斥,增加乳状液体系的稳定性。我们的研究结果发现,添加不同浓度WPH处理组的粒径均低于未添加WPH的空白对照组,这可能与相同的油量下具有较高乳化活性的乳化剂有关。还可以解释为是更多的表面活性物质吸附到液滴表面以及液滴间形成了更大的空间位阻,乳状液的氧化稳定性随液滴颗粒减小而增加,因为更多的乳化剂吸附到小颗粒表面。另外,乳化剂分子疏水部分更容易在小颗粒中抑制油脂分子和自由基的移动。因此,乳化液滴的粒径分布降低有助于产生抗氧化效果。这与Li等的研究是一致的[34],总结了玉米醇溶蛋白水解物能够显著降低肌原纤维蛋白制备的O/W乳状液的平均粒径。Adjonu等[35]表明多肽的空间位阻稳定性差很容易导致多肽的聚集,加速油滴絮凝。非吸附肽的大小、形状和数量对水解液稳定乳状液的絮凝有着至关重要的影响。此外,Dimitrova等[33]研究表明,牛血清白蛋白添加到Tween 20制备的乳状液中能够通过重建蛋白质表面活性剂层或液滴周围的络合物将静电斥力逐渐转化为空间位阻。
3 结论
水解度是影响乳清蛋白乳化特性的主要因素,它通过有限的(60 min)中性蛋白酶水解得到WPH可以与Tween 20一起使用,能够提高通过大豆油稳定的O/W乳状液的稳定性,增加乳状液的ζ-电势(绝对值)并使其具有较小的粒径,增强乳状液的乳化稳定性。然而,较低浓度的WPH(5 mg/mL)与Tween 20共同制备的乳状液最为稳定,这主要是由于WPH的浓度过高时在界面上存在竞争吸附。下一步我们将解决如何从粗水解物中制备具有较好界面性质的高分子量活性肽,为提高水包油型乳状液滴的稳定性奠定基础。

