赤道海域茎柔鱼角质颚形态及生长特征分析
李建华,陈新军,陈 芃,刘必林,申丰源
(1.上海海洋大学海洋科学学院,上海 201306;2.大洋渔业资源可持续开发教育部重点实验室,上海 201306;3.国家远洋渔业工程技术研究中心,上海 201306;4.远洋渔业协同创新中心,上海 201306)
茎柔鱼(Dosidicus gigas)为大洋性经济头足类,资源丰富[1],主要作业渔场有加利福尼亚湾[2]、哥斯达黎加[3]、秘鲁沿岸和外海[4]、智利沿岸和外海以及赤道海域等[5]。它是东太平洋重要的捕捞对象,近年来其年总产量超过80×104t[6]。目前,茎柔鱼渔业在我国远洋鱿钓渔业中也占据着极为重要的地位,作业渔船超过200多艘,年产量超过24×104t,约占我国远洋鱿钓总产量的50%以上。随着茎柔鱼经济和生态地位的不断提高,其基础研究受到各国学者的广泛重视[7-13],在2015年南太平洋区域性渔业组织第三次科学会议上,专门就东太平洋茎柔鱼的渔业及其生物学特征进行了总结与分析[14]。
角质颚是头足类位于口球内的一对几丁质硬组织,信息储存稳定[15]。头足类角质颚结构相对稳定,在种群鉴定过程中要比传统的软体部形态更有效[16-20]。刘必林等[21]认为,在野外工作或者缺少其它分类性状,特别是在对捕食动物胃含物分析时,角质颚形态特征可作为头足类分类的重要依据。诸多学者对智利[21]、秘鲁[22-23]等海域的茎柔鱼角质颚形态进行了相关研究,但关于赤道海域茎柔鱼角质颚的报道尚属空白。为此,本研究根据2017年2-4月调查期间赤道海域采集到的茎柔鱼角质颚样本,分析其角质颚形态特征、茎柔鱼个体生长对角质颚形态的影响,旨在探讨茎柔鱼角质颚形态的差异及生长规律,为赤道海域茎柔鱼生物学研究提供参考。
1 材料与方法
1.1 采集的时间和地点
茎柔鱼样本的采集时间为2017年2-4月,采样地点在东太平洋公海赤道附近海域(0°19′N~1°09′S、109°23′~116°36′W,图 1),样本委托专业鱿钓船采集,样本采集时,从每个站点渔货中随机抽取20尾(不足20尾则全取),累计样本数535尾,所获样本经冷冻保藏运回实验室。

图1 茎柔鱼取样站点分布图Fig.1 Distribution of sampled D.gigas
1.2 角质颚采集
实验室进行解冻后,用剪刀剪下头部,从茎柔鱼头部口器中提取角质颚,对取出的角质颚进行编号并存放于装有75%乙醇溶液的50 mL离心管中。
1.3 研究方法
1.3.1 基础生物学测量
将实验室中冷冻的样品取出并解冻后,对茎柔鱼进行生物学测定,包括胴长(mantel length,ML)、性别和性腺成熟度等。测量胴长用皮尺进行,精确至1 mm。根据 LIPINSKI等的分类方法[24]将性成熟度划分Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ 5期,其中,将Ⅰ、Ⅱ期个体认为是性未成熟的个体,将Ⅲ、Ⅳ期认为是性成熟个体,将Ⅴ期认为是繁殖后(雄性为交配后,雌性为产卵后)的个体。
1.3.2 角质颚形态测量
将角质颚从离心管中取出并将其外部清洗干净后,使用数显游标卡尺进行测量,测定项目为:上头盖长(upper hood length,UHL);上脊突长(upper crest length,UCL);上喙长(upper rostrum length,URL);上喙宽(upper rostrum width,URW);上侧壁长(upper lateral wall length,ULWL);上翼长(upper wing length,UWL);下头盖长(lower hood length,LHL);下脊突长(lower crest length,LCL);下喙长(lower rostrum length,LRL);下喙宽(lower rostrum width,LRW);下侧壁长 (lower lateral wall length,LLWL);下翼长 (lower wing length,LWL)(图2),测量结果精确至 0.01 mm。
1.3.3 数据处理方法
1)按照性别分别计算各角质颚形态参数的平均值和标准差,并利用t检验检验不同性别各角质颚形态参数的差异。
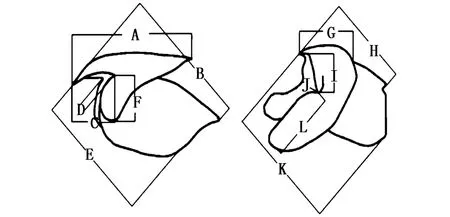
图2 角质颚外部形态测量项目示意图 [25]Fig.2 Scheme of morphometric measurement for beak注:A:上头盖长(UHL);B:上脊突长(UCL);C:上喙长(URL);D:上喙宽(URW);E:上侧壁长(ULWL);F:上翼长(UWL);G:下头盖长(LHL);H:下脊突长(LCL);I:下喙长(LRL);J:下喙宽(LRW);K:下侧壁长(LLWL);L:下翼长(LWL)Note:A:upper hood length(UHL);B:upper crest length(UCL);C:upper rostrum length(URL);D:upper rostrum width(URW);E:upper lateral wall length(ULWL);F:upper wing length(UWL);G:lower hood length(LHL);H:ower crest length(LCL);I:lower rostrum length(LRL);J:lower rostrum width(LRW);K:lower lateral wall length(LLWL);L:lower wing length(LWL)
2)对茎柔鱼角质颚形态参数进行主成分分析,当累计方差贡献率达到70%的主成分,选用载荷最高作为赤道茎柔鱼角质颚各区长度特征的代表,并计算各个样本的各主成分得分,利用线性回归法拟合胴长与各主成分之间的关系式作为利用角质颚估算茎柔鱼个体大小的方程式。
3)将胴长分为251~300 mm、301~350 mm、351~400 mm、401~450 mm和451~500 mm的5个胴长组,利用方差分析(ANOVA)及多重比较(LSD法)对不同胴长组及不同性成熟度间角质颚上脊突长(UCL)的差异进行检验,以分析不同因子对角质颚生长的影响。
上述分析均采用IBM SPSS 23.0。
2 结果与分析
2.1 角质颚性别间形态差异分析
由表1可知,样本中所有角质颚形态学参数的均值雌性比雄性大,其中上喙宽(URW)、下头盖长(LHL)、下喙长(LRL)、下喙宽(LRW)4项指标雌雄差值小于1 mm,而上头盖长(UHL)、上脊突长(UCL)、上喙长(URL)、上侧壁长(ULWL)、上翼长(UWL)、下脊突长(LCL)、下侧壁长(LLWL)和下翼长(LWL)8项指标雌雄差值均大于1 mm,其中上头盖长(UHL)和上脊突长(UCL)差值最大,达3.411 mm和4.179 mm。分雌雄对赤道茎柔鱼角质颚12个形态参数进行Student’s t检验,雌雄个体角质颚的12个形态参数差异显著(P<0.05)。
2.2 茎柔鱼角质颚主成分分析
KMO抽样适应性指数和巴特利特球形检验,赤道茎柔鱼角质颚数据KMO抽样适应性指数值为0.978,Bartlett检验中 Sig.值为0.000,说明赤道茎柔鱼角质颚数据适合进一步用主成分分析。
由Cattell陡坡鉴定法可知,第一主成分的方差累积贡献率为84.492%,第一个主成分足以代表整体指标(表2)。第一主成分与赤道茎柔鱼角质颚12个参数存在显著正相关性,除了上侧壁长(ULWL),载荷系数均在0.91以上,其中上头盖长(UHL)、上脊突长(UCL)、上翼长(UWL)、下翼长(LWL)载荷系数在0.97以上,因此第一主成分可以被认为是赤道茎柔鱼角质颚各区长度特征的代表,其中载荷绝对值最高为上脊突长(UCL),因此选用上脊突长(UCL)代表赤道茎柔鱼角质颚的形态特征。
根据主成分分析的结果,选取第一个主成分,并利用各个角质颚的形态参数计算第一主成分得分,以此拟合茎柔鱼胴长ML和第一主成分得分C1的关系式,结果如下:
ML=7.45×C1+353.2(R2=0.85)
验证结果表明(表3,图3),该方程式可作为利用角质颚估算茎柔鱼个体大小的关系式。
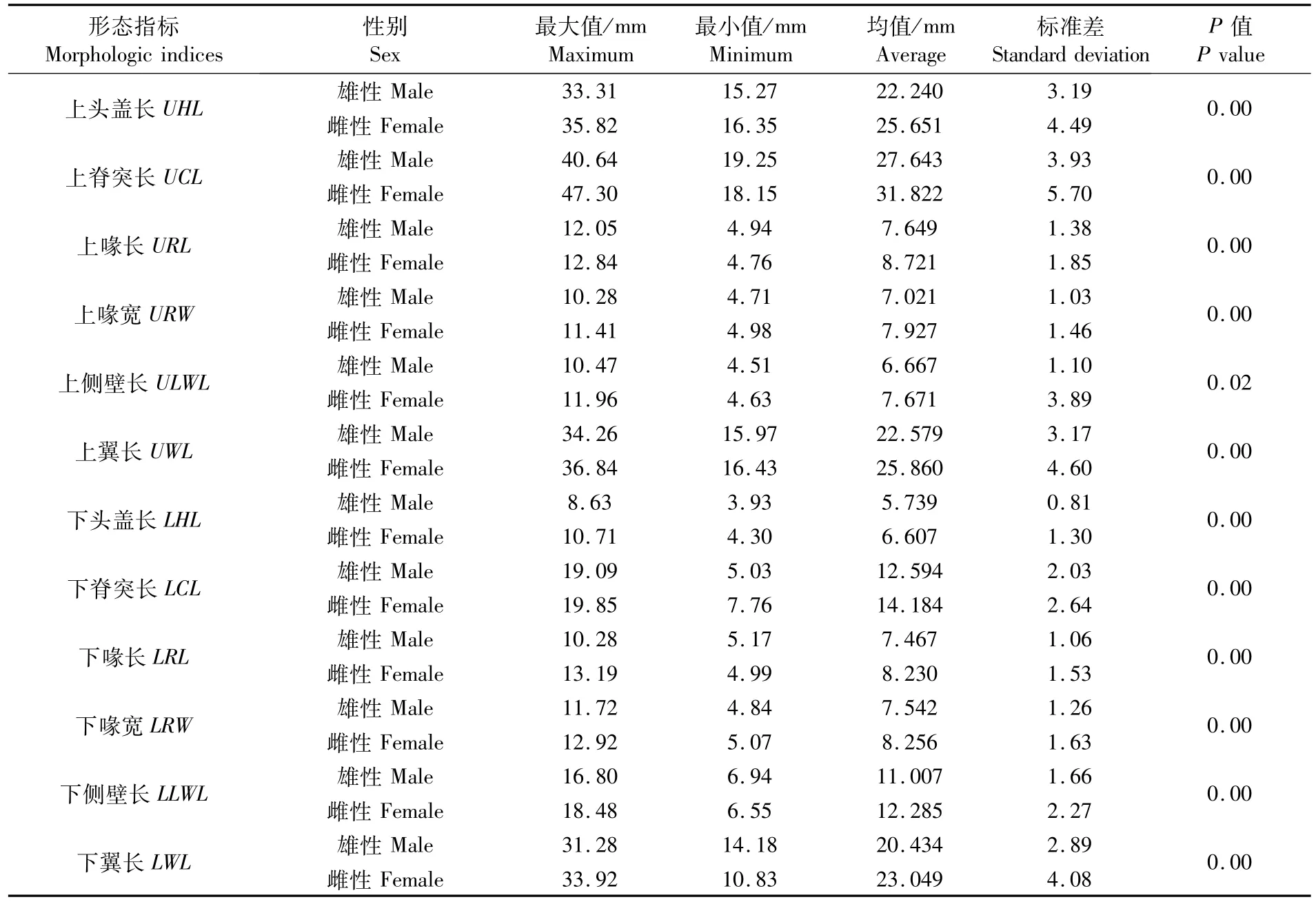
表1 赤道茎柔鱼角质颚形态参数值Tab.1 Morphometric parameters of beaks for Dosidicus gigas
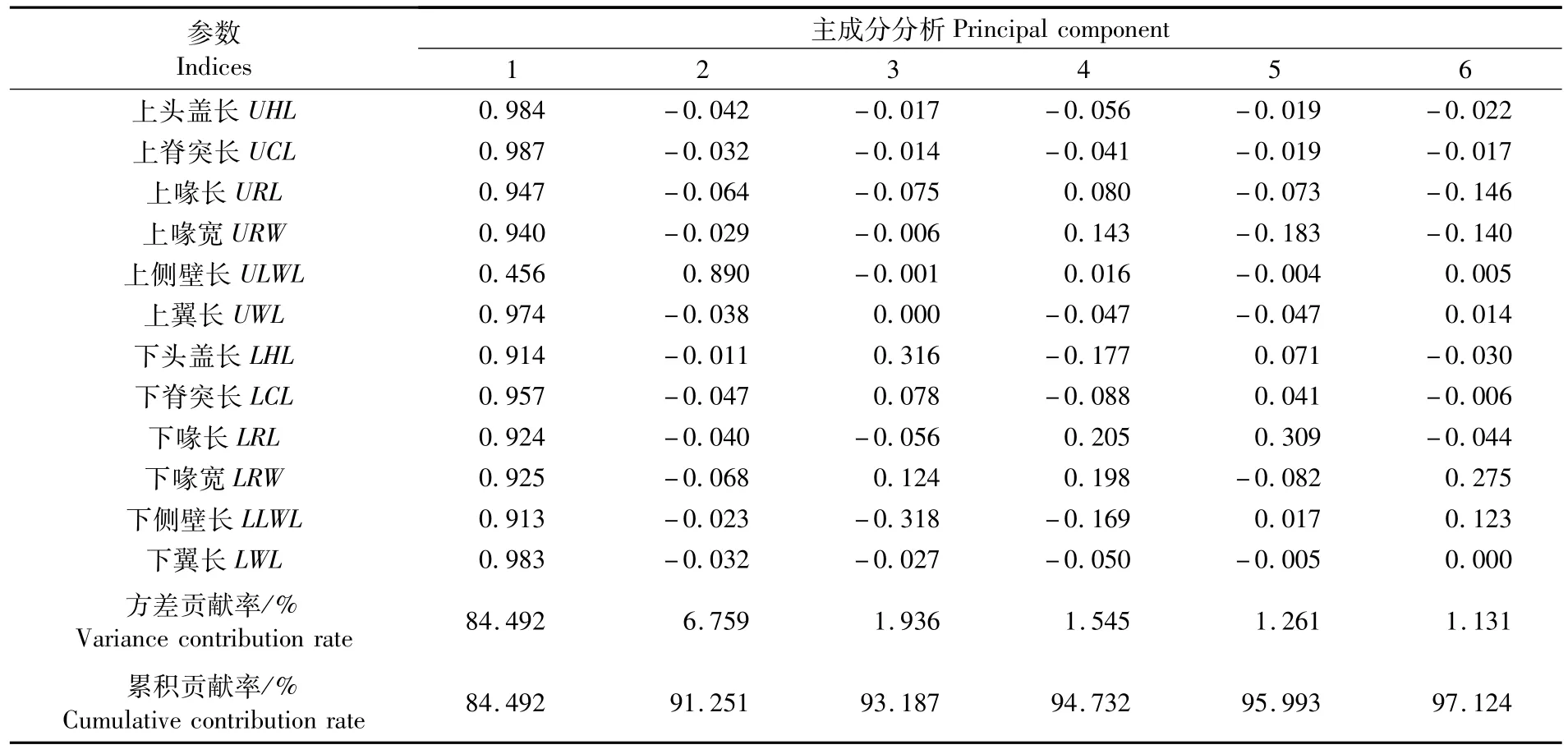
表2 茎柔鱼角质颚形态学参数的主成分分析Tab.2 Principal component analysis for the morphometric parameters of beak for Dosidicus gigas

表3 回归分析及其检验结果Tab.3 Results of regression analysis and its test
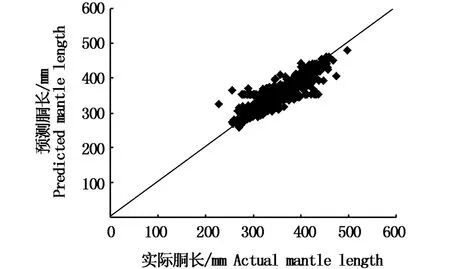
图3 利用角质颚预测茎柔鱼胴长与实际胴长比较Fig.3 Comparison between predictedmantle length based on the beak and actual mantle length for Dosidicus gigas
2.3 胴长和性腺成熟度与角质颚上脊突长(UCL)的关系
样本在251~300 mm、301~350 mm、351~400 mm、401~450 mm和451~500 mm 5个胴长组的比例分别为雄性:16.1%、51.1%、24.1%、7.3%、1.5%;雌性:15.9%、35.2%、24.4%、22.6%、2%。通过ANOVA与LSD分析认为,茎柔鱼雌、雄个体不同胴长组和角质颚上脊突长(UCL)均存在显著差异(P<0.05)。从整体上看,随着胴长的增大,茎柔鱼雌、雄个体角质颚上脊突长(UCL)也逐渐增加,角质颚逐渐增大(图4)。
赤道茎柔鱼雌性样本的性腺成熟度在Ⅰ~Ⅳ之间,其所占比重分别为46.5%、50.8%、0.8%、2%。雄性的性成熟度在Ⅰ~Ⅳ之间,其所占比重分别为13.9%、15.3%、51.1%、19.7%。ANOVA分析认为,茎柔鱼雌雄个体角质颚上脊突长(UCL)在不同性腺成熟度期均存在显著性差异(P<0.05)。LSD分析表明,性成熟度Ⅱ期与Ⅲ期之间雌雄个体角质颚上脊突长(UCL)差异性均不显著(P>0.05),同时雌性个体在Ⅱ期与Ⅳ期,Ⅲ期与Ⅳ期之间上脊突长(UCL)差异性亦不显著(P>0.05)。雌雄性个体角质颚上脊突长(UCL)Ⅰ期与Ⅱ、Ⅲ、Ⅳ期之间均有显著性差异(P<0.05),并且雌性个体在Ⅱ期与Ⅳ期,Ⅲ期与Ⅳ期之间上脊突长(UCL)有显著性差异(P<0.05)。从整体上看,随着性腺的逐渐成熟,茎柔鱼雌雄个体角质颚上脊突长(UCL)也逐渐增加,角质颚逐渐增大(图5)。

图4 茎柔鱼角质颚上脊突长与胴长组间的关系Fig.4 Relationship between UCL of beaks and mantle length for Dosidicus gigas

图5 茎柔鱼角质颚上脊突长与性腺成熟度的关系Fig.5 Relationship between UCL of beaks and sex maturity stage for Dosidicus gigas
3 讨论
3.1 不同性别角质颚的形态差异
头足类的性别二态性常常反应在各种第二性状上,例如个体大小和形态的不同。根据之前研究结果,茎柔鱼雌、雄个体年龄结构、性成熟胴长、生长率等差异明显[5,22]。头足类硬组织的(耳石、角质颚和内壳等)性别二态性明显[26-28]。MERCER等[29]研究认为,角质颚的形态可用作鱿鱼的性别鉴定。本研究发现,角质颚形态学参数的均值雌性比雄性大,其中上头盖长(UHL)和上脊突长(UCL)差值最大,达3.411 mm和4.179 mm,雌、雄个体角质颚12个形态参数中只有上侧壁长(ULWL)差异不显著(P>0.05),其它形态参数均差异显著(P<0.05);胡贯宇等[22]研究认为,秘鲁茎柔鱼角质颚各形态参数在雌、雄个体间的差异性极显著,且雌性个体的角质颚大于雄性个体,本文的研究结果与这一结果相似;类似的角质颚性别二态性在其它柔鱼科鱿鱼如柔鱼和阿根廷滑柔鱼(Illex argentinus)中也同样存在[30]。雌性个体角质颚各形态参数均大于雄性个体,这可能由于同一种群雌性个体生长快于雄性,对食物的需求大,因而造成角质颚形态参数的差异。
3.2 茎柔鱼角质颚主成分分析
主成分分析中第一个主成分足以代表整体指标,方差累积贡献率为84.492%,因此第一主成分可以被认为是赤道茎柔鱼角质颚各区长度特征的代表,其中载荷绝对值最高为上脊突长(UCL),因此选用上脊突长(UCL)代表赤道茎柔鱼角质颚的形态特征,这与其他学者对柔鱼(Ommastrephes bartrami)[25,31]、阿根廷滑柔鱼[32]的研究结果不尽相同。究其原因,可能是由于种类不同、物种摄食情况不同和栖息环境不同,这有待于今后进一步分析。
根据主成分分析的结果,拟合出茎柔鱼胴长ML和第一主成分得分 C1的关系式为:ML=7.45×C1+353.2(R2=0.85),验证结果表明(表3,图3),该方程式可作为利用角质颚估算茎柔鱼个体大小的关系式。
3.3 胴长和性腺成熟度与角质颚的关系
通过ANOVA与LSD分析认为,茎柔鱼雌雄个体不同胴长组和角质颚上脊突长(UCL)均存在显著差异(P<0.05)。从整体上看,随着胴长的增大,茎柔鱼雌雄个体角质颚上脊突长(UCL)也逐渐增加,角质颚逐渐增大(图4)。头足类角质颚的生长与胴长关系显著,但不同种类间角质颚的生长有差异[33-36]。JACKSON[33]研究显示,新西兰海域强壮桑椹乌贼(Moroteuthis ingens)上、下颚喙长与胴长呈线性关系。JACKSON等[34]研究发现,新西兰南部海域的新西兰双柔鱼(Nototodarus sloanii)取对数值后的上、下颚喙长与胴长关系显著。郑小东等[35]利用角质颚研究了曼氏无针乌贼(Sepiella maindroni)的生长,研究认为上颚头盖长、脊突长、吻长、翼长随胴长呈线性增长。刘必林等[36]分析了印度洋西北海域鸢乌贼(Sthenoeuthis oualaniensis)角质颚显示,角质颚长度与胴长呈极显著的线性相关。可见,根据角质颚上脊突长(UCL)的长度能有效判定茎柔鱼的胴长及生长情况。
本次所采集的样本中,没有发现性成熟等级为Ⅴ期的个体,雌、雄样本的性腺成熟度在Ⅰ~Ⅳ之间,并且Ⅳ期个体较少,这可能由于茎柔鱼产完卵即死亡;从整体上看,随着性腺的逐渐成熟,茎柔鱼雌、雄个体角质颚上脊突长(UCL)也逐渐增加,角质颚逐渐增大(图5),但是在Ⅰ~Ⅲ期生长较快,Ⅲ期以后生长较为缓慢,这一结果与胡贯宇等[22]对秘鲁茎柔鱼角质颚的研究结果一致。有学者研究柔鱼[25]、阿根廷滑柔鱼[32]时发现角质颚各形态参数在不同性腺成熟度间的差异性均显著。究其原因,可能是幼稚鱼期的茎柔鱼主要是以甲壳类和灯笼鱼科[37]为食,随着性腺的发育,对能量的需求越来越大[38],开始捕食较大的海洋生物,这就要求角质颚有强大的咬合力才能捕获并且撕碎食物,因此角质颚需要迅速生长,尤其是上脊突的快速生长可以给角质颚活动提供一个强大的支点,保证柔鱼在咬合时的力量支撑,从而提高捕食的效率。

