13-甲基十四烷酸对大鼠脑皮层星形胶质细胞氧反常的影响
何宏星,翁绳美,胡潇,林艳婷,余涓*
(1. 福建医科大学实验动物中心,福州 350108; 2. 福建医科大学药学院,福州 350108; 3. 福建医科大学基础医学院生理学与病理生理学系,福州 350108)
13-甲基十四烷酸也称为13-甲基肉豆蔻酸,是一种末端支链的中长链饱和脂肪酸,化学结构C15H30O2, 分子质量为242.4,天然存在于某些细菌和真菌的细胞膜上,可利用这些细菌和真菌在大豆发酵中分离出来[1-3]。本实验室以往研究发现,13-MTD对大鼠脑缺血再灌注损伤(cerebral ischemia-reperfusion injury,CIRI)有保护作用, 13-MTD对OGD/R和H2O2诱导的SH-SY5Y神经细胞损伤亦有明确的保护作用[4],不同剂量的13-MTD可保护体外OGD/R(氧反常模型)诱导的大鼠脑皮质神经元和SD乳鼠脑微血管内皮细胞(brain microvascular endothelial cells, BMEC)损伤[5],并呈量效依赖关系。星形胶质细胞是脊椎动物大脑中的一种呈星状的胶质细胞,具有调节细胞外离子和化学环境、支持血脑屏障、为神经组织提供营养物质,并在大脑的瘢痕修复中起到重要的作用[6]。星形胶质细胞作为中枢神经系统的主要支持部分,在遭受缺血缺氧后的反应对于脑损伤的结局起着关键作用。因此研究细胞水平星形胶质细胞的反应可为脑水肿的治疗和神经元保护提供依据。
本实验通过分离SD大鼠大脑皮层星形胶质细胞 (astrocytes, AST),建立离体星形胶质细胞OGD/R损伤模型,进一步探讨OGD/R 对体外培养星形胶质细胞的损伤作用以及13-MTD的保护效应。
1 材料与方法
1.1 材料
1.1.1 实验动物
新生1 ~ 3 d清洁级Sprague-Dawley(SD)大鼠,体重约10 g左右,福建医科大学实验动物中心提供【SCXK(闽)2012-0001】。
1.1.2 实验试剂
13-MTD由福建医科大学药学院合成;一抗GFAP及AQP4,Santa Cruz公司;SABC-羊抗兔IgG及SABC-AP -兔抗羊IgG试剂盒,武汉博士德生物工程有限公司; Triton-X,Sino-American Biotec公司;四甲基偶氮唑盐(MTT),Sigma公司。
1.1.3 实验仪器设备
超净工作台(上海力申科学仪器有限公司);CO2培养箱(美国Forma Scientific 公司);倒置相差显微镜(日本Olympus公司);酶标仪(美国Bio-Rad公司)。
1.2 方法
1.2.1 星形胶质细胞的原代培养
选择出生1 ~ 3 d的SD乳鼠,经过处理后获取大脑皮层组织,放入预冷的PBS液中漂洗4 ~ 5次,用眼科剪尽量剪成糜状,转移至离心管中加入适量0.25%胰蛋白酶消化30 min,每隔10 min轻轻吹打使其成为细胞悬液,再以含有10%FBS高糖DMEM培养基终止消化,离心800 r/min 5 min弃上清,加入新鲜培养基吹打后静置10 min,再离心800 r/min 5 min弃上清,加入新鲜培养基吹打制成初细胞悬液,经100目、200目筛网过滤,接种到玻璃培养皿中进行差速粘附处理,于CO2培养箱中培养30 ~ 60 min,吸出初细胞悬液,离心800 r/min 5 min弃上清,加入新鲜培养基吹打成次细胞悬液,将过滤液以培养基稀释后接种于左旋多聚赖氨酸包被的细胞培养瓶中,以后每隔2 ~ 3 d用含有10%FBS DMEM培养基换液一次,连续培养9~14 d,换液时稍加震荡并用倒置显微镜观察细胞生长情况,细胞汇合度80% ~ 90%进行传代。
1.2.2 星形胶质细胞的传代纯化
待细胞长满瓶底后弃去旧的培养液,消化细胞,将细胞悬液转入离心管中,离心(1000 r/min)5 min,弃去上清液后加入培养基制成细胞悬液,重复差速粘附处理,将细胞悬液接种于预先置有盖玻片的培养板中,进行细胞爬片,放入37℃、5% CO2培养箱中培养5 ~ 7 d。传代培养3次后进行星形胶质细胞的鉴定。
1.2.3 GFAP免疫化学方法鉴定星形胶质细胞
星形胶质细胞的鉴定:细胞爬片于包被有左旋多聚赖氨酸的盖玻片上,培养至长满盖玻片后吸弃培养液,再PBS冲洗2次;4%多聚甲醛室温固定30 min,PBS冲洗3次;0.5% TritonX-100破膜处理30 min,PBS冲洗3次;3% H2O2孵育30 min,PBS冲洗3次;滴加1:10正常山羊血清室温封闭30 min,倾去勿洗;滴加GFAP一抗(l:100),阴性对照片滴加PBS代替一抗,湿盒内20~37℃ 1 h,PBS冲洗3次;滴加羊抗兔IgG二抗(1∶100),20~37℃孵育20 min,PBS冲洗3次;滴加SABC液(1∶100),20 ~ 37℃孵育20 min,PBS冲洗4次; DAB显色,镜下控制反应时间,自来水冲洗终止反应;苏木素轻度复染,自来水冲洗,酒精脱水,二甲苯透明,中性树胶封片。普通显微镜下观察拍照。
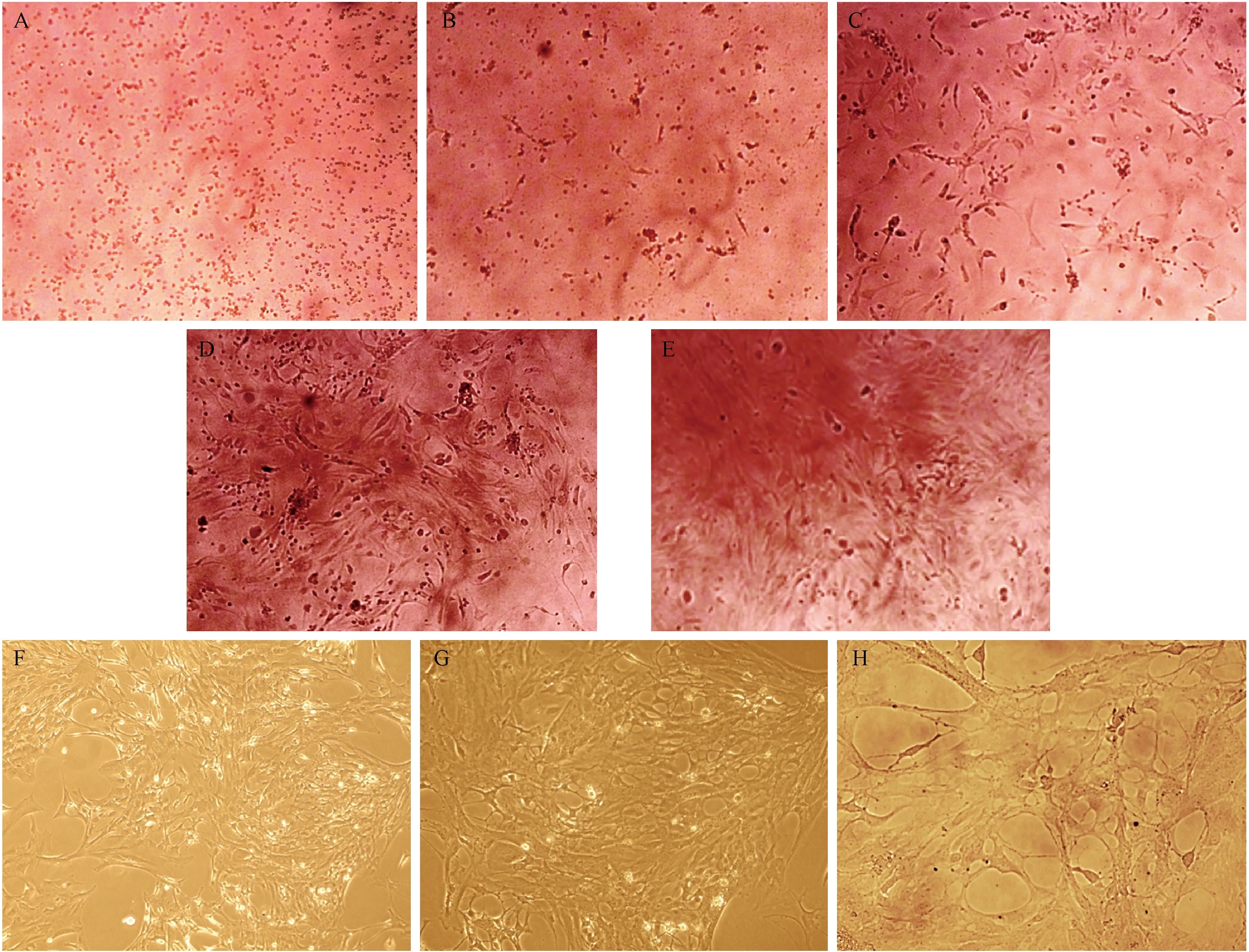
注: A~E:分别为1、2、4、6、10 d(×200); F~H:星形胶质细胞(分别为×100、×200、×400)。图1 原代培养的新生大鼠大脑皮层星形胶质细胞形态Note. A-E,1,2,4,6,10 d(×200). F-H, Astrocytes (×100,×200,×400).Figure 1 Morphology of the primary cultured neonatal rat cerebral cortical astrocytes
1.2.4 细胞实验分组
按实验需要将细胞分组:对照组(Control),模型组(Model),Model + 13-MTD 20,40,80 μg/mL组(M20,M40,M80),每组设6个复孔。
1.2.5 OGD/R模型制备及药物干预
将传代纯化的细胞接种于96孔板或6孔板,待细胞生长融合至90%左右时,复制OGD 10 h/R 24 h模型。即将正常培养基换无糖的DMEM培养基置37℃恒温密闭的缺氧盒内,持续通入95% N2+ 5% CO2培养10 h,结束后换正常高糖DMEM培养基置CO2培养箱内培养24 h;给药组在再复氧糖同时分别给予不同剂量的13-MTD;正常组细胞正常培养34 h。
1.2.6 MTT法测定星形胶质细胞线粒体活性
用96孔板接种的细胞复制OGD 10 h/R 24 h模型后,加MTT 50 μL/孔(终浓度5 mg/mL),37℃孵育4 h;小心吸弃MTT,加DMSO 150 μL/孔,震荡溶解;用酶标仪检测各样本OD值。
1.2.7 细胞免疫化学法检测星形胶质细胞内AQP4蛋白表达
实验方法参考1.2.3 进行,并采用Image Pro-Plus 6.0图像分析处理系统,统计其IOD值[9]。
1.3 统计学方法
2 结果
2.1 原代及传代星形胶质细胞形态观察
倒置显微镜下观察到原代培养的星形胶质细胞的生长情况与文献报道一致[7]。分离的星形胶质细胞在接种后的3 ~ 5 h内就能贴壁生长,呈椭圆形、梭形等,1 d后所有细胞均已贴壁生长,培养2 ~ 4 d观察可见细胞长出细小的胞突,5 ~ 6 d时细胞数量逐渐增多。培养至9 ~ 14 d时星形胶质细胞已完全融合,观察可见大量的星形胶质细胞铺满培养瓶的底部且融合成单层,对其进行传代培养。传代培养的星形胶质细胞具有较强的分裂能力,在传代后的4 ~ 5 d可融合,传代的星形胶质细胞胞体较大形状不规则,最后细胞突起相连成星形胶质细胞典型的网络状结构,连续传代3 ~ 4次可得到纯度较高的星形胶质细胞。(图1)
2.2 细胞鉴定
GFAP为成熟星形胶质细胞的特异性标记物,是骨架蛋白。GFAP鉴定结果显示:阳性产物呈棕黄色,主要分布于胞质中,胞核未着色。随机选择6个视野,分别计数200个细胞,阳性细胞数95%以上,证明采用上述方法获得的为星形胶质细胞,纯度较高可用于后续试验。如图2所示,A-C为星形胶质细胞的GFAP鉴定结果,D与E为RSC96细胞的GFAP鉴定结果,F与G为RSC96添加PBS的鉴定结果。

注:A~C:星形胶质细胞(×100、×200、×400);D~G:大鼠雪旺细胞(×200、×400、×200、×400)。图2 免疫组织化学鉴定GFAP染色的传代星形胶质细胞Note. A-C, Astrocytes (×100,×200,×400). D-G, RSC96 cells (×200,×400,×200,×400).Figure 2 Subcultured astrocytes identified by immunohistochemistry GFAP staining
2.3 13-MTD对OGD/R模型处理后星形胶质细胞形态影响
对照组星形胶质细胞经传代培养4 ~ 5 d后,细胞突起相连成星形胶质细胞典型的网络状结构;模型组星形胶质细胞胞体肿胀、缩小,折光性下降,突起收缩,甚至脱落、崩解,存活率明显下降;13-MTD处理组细胞的损伤程度明显减轻,细胞形态基本完整,星形胶质细胞胞突出现轻度收缩,细胞存活率提高。(图3)
2.4 13-MTD对星形胶质细胞线粒体活性影响
MTT结果显示:与对照组相比,模型组星形胶质细胞的 MTT代谢率明显降低(P< 0.01),表明线粒体活性降低;与模型组相比,13-MTD 20,40,80 μg/mL均可显著增加星形胶质细胞的MTT代谢率(P< 0.01),表明细胞线粒体活性增高,并存在剂量依赖性(P< 0.01),以M80组的MTT代谢率最高,线粒体活性最高(P< 0.01)。(图4)

注:A:对照组;B:模型组;C:M80组。图3 OGD/R处理后,不同培养组新生大鼠大脑皮层星形胶质细胞形态比较(×200)Note. A, Control group. B, Model group. C, M80 group.Figure 3 Comparison of the morphology of subcultured neonatal rat cerebral cortical astrocytes in different groups after treatment with OGD/R (×200)

注:各分组相比较,**P< 0.01。图4 比较不同OGD/R损伤后新生大鼠大脑皮质星形胶质细胞线粒体还原性的OD值Note. Compared with each groups,**P<0.01.Figure 4 Comparison of the OD values of the mitochondrial reducibility of subcultured neonatal rat cerebral cortical astrocytes injured by n=6)
2.5 13-MTD对AQP4蛋白表达影响
AQP4蛋白表达呈阳性的细胞呈黑色,主要分布在细胞膜上,胞质未着色。对照组未见阳性细胞;模型组AQP4蛋白阳性细胞IOD值显著增强(P< 0.001); 与模型组比较,M40,M80组均可使AQP4蛋白阳性细胞IOD值降低(P< 0.001),提示AQP4蛋白表达减少,以M80改善效果为好,存在显著剂量依赖性(P< 0.001)。(图 5,6)
3 讨论
本课题组前期实验已证明13-MTD对于ICRI有保护作用[4-5,8],而星形胶质细胞作为神经血管单元的重要组成部分,维持着整个中枢神经系统正常运转。在缺血性脑损伤时,对维持脑组织正常功能十分重要。AQP4是脑内分布最广的水通道蛋白[9],对于脑内水的代谢和调节起着重要作用,主要在星形胶质细胞终足和室管膜区高度表达而在神经元上未见,血管内皮生长因子可诱导星形胶质细胞分布在受损部位的中心和周围,提示星形胶质细胞在受损部位调节水分子出入[10],减少星形胶质细胞上AQP4蛋白的表达可能会有效的减轻因缺血缺氧引起的细胞水肿。Nicchia等[11]应用RNA干扰技术抑制培养的星形胶质细胞上AQP4的表达,发现可以延迟星形胶质细胞的水中毒时间,并且RNA干扰AQP4的表达时间与缺血相关基因葡萄糖转运体1 (glucose transporter 1, GLUT1)和己糖激酶相关,说明AQP4可能参与缺血诱导的脑水肿。目前对缺血缺氧损伤后AQP4与脑水肿发生的关系研究大多都集中在体内,由于体内环境较复杂并受到多种因素的影响,个体差异性较大,难以观察单因素对AQP4表达与脑水肿关系的准确结果。

注:各分组相比较,***P<0.001。图6 OGD/R损伤后,比较培养新生大鼠大脑皮质星形胶质细胞缺血再灌注后AQP4蛋白的IOD变化Note. Compared with each groups,***P<0.001.Figure 6 Comparison of the IOD values of AQP4 proteins in the subcultured neonatal rat cerebral cortical astrocytes injured by n=6)
本实验反复摸索星形胶质细胞的培养条件,通过对星形胶质细胞标志蛋白GFAP进行鉴定,成功分离并培养出了新生SD大鼠脑皮层星形胶质细胞,并建立体外培养的星形胶质细胞的OGD 10 h/R 24 h 模型,通过观察星形胶质细胞氧反常损伤后的形态、线粒体活性改变,以及星形胶质细胞胞膜上AQP4蛋白的表达变化,探讨13-MTD的保护作用。复制OGD 10 h/R 24 h模型后,采用MTT法测定13-MTD对各实验组星形胶质细胞的线粒体活性的影响,结果显示,与对照组相比,模型组星形胶质细胞的 MTT代谢率明显降低(P< 0.01),表明线粒体活性降低;与模型组相比,13-MTD20,40,80 μg/mL均可显著增加星形胶质细胞的MTT代谢率(P< 0.01),表明细胞线粒体活性增高,并存在剂量依赖性(P< 0.01),以M80组的MTT代谢率最高,线粒体活性最高(P< 0.01)。细胞免疫组化结果显示,对照组未见AQP4表达阳性的细胞,模型组可见细胞膜上AQP4大量表达的阳性细胞, 给予13-MTD 20,40,80 μg/mL干预后,AQP4表达阳性细胞IOD值降低,以上结果提示我们,13-MTD对星形胶质细胞的氧反常损伤均有保护作用,各剂量间存在明显差异性,以80 μg/mL效果最好。可见不同剂量的13-MTD可有效维持体外培养的星形胶质细胞正常形态、下调星形胶质细胞胞膜上AQP4表达。
上述结果提示我们,13-MTD可通过降低OGD/R后AQP4蛋白的表达减轻星形胶质细胞水肿,提高线粒体活性,维持星形胶质细胞正常形态,并呈剂量依赖性。

