狭叶荨麻醇提物的体外抗氧化及抗炎活性
贺子倩,彭青,蔡道琳,王萍
(东北林业大学林学院,黑龙江哈尔滨 150040)
狭叶荨麻(Urtica Angustifolia)是一种药食两用的传统山野菜,黑龙江省分布较广。国外对荨麻属植物的研究相对较早,尤其是对狭叶荨麻的同属植物,如欧荨麻、麻叶荨麻、异株荨麻的开发,并对异株荨麻不同部位的化学成分进行了详细研究,发现其活性成分主要有甾醇、黄酮类、有机酸类、酚类、苯丙素类、植物蛋白质、多糖及其他类化合物[1~3]。国内关于狭叶荨麻的研究较少,据报道,狭叶荨麻根中含有黄酮、甾醇、苷类、酚类化合物及糖类、蛋白质等成分;茎中含有多糖类、甾体及萜类、有机酸等成分;叶中含有色素、黄酮、甾醇、苷类、糖类、蛋白质和油脂等成分[4]。
王静等采用了亚临界萃取技术对新疆野生狭叶荨麻中的黄酮类化合物进行提取[5]。杜宏涛等通过响应面法优化了超声波提取狭叶荨麻中黄酮和木脂素的工艺[6]。张海悦、李茜采用了超声波辅助提取狭叶荨麻生物碱[7]。张海悦和郭新力以狭叶荨麻叶为原料,采用乙醇提取得到了一种甾体皂苷[8]。国内外对狭叶荨麻的作用研究较少,多利用小鼠建立模型、采用体内试验研究其提取物的活性。崔殿波和李薇等研究发现了狭叶荨麻乙酸乙酯提取物能显著抑制二甲苯所致小鼠耳肿胀、蛋清所致大鼠足肿胀,并对醋酸所致小鼠扭体反应以及对热板小鼠表现出显著的镇痛作用[9]。秦元满和魏恩科研究发现了狭叶荨麻甲醇提取液能明显延长小鼠的凝血时间和出血时间[10]。
本研究利用乙醇溶液提取狭叶荨麻中活性物质,在单因素试验的基础上利用响应面法得到最佳提取条件,对其提取物进行活性物质含量的测定,同时进行体外抗氧化及抗炎活性评价,为推动国内狭叶荨麻的资源利用,为开发新型功能食品提供实验依据。
1 材料与方法
1.1 材料与试剂
狭叶荨麻采自小兴安岭地区,经晒干粉碎,过40目筛后于室温下密封保藏。
药品试剂:没食子酸标准品、芦丁标准品、儿茶素标准品、薯蓣皂苷元标准品、澳洲茄胺标准品,均购自上海源叶生物科技有限公司;其他药品试剂均为国产分析纯。
1.2 仪器与设备
PHS-3C型精密pH计,上海精密仪器有限公司;TU-1810型PC722s分光光度计,上海精密仪器有限公司;DK-S12电热恒温水浴锅,上海森信试验仪器有限公司。
1.3 试验设计
1.3.1 单因素试验设计
取狭叶荨麻粉末5.00 g,使用不同浓度的乙醇溶液浸提,旋蒸、定容至相同体积。考察的单因素及水平设计为提取时间:60、90、120、150、180 min;提取温度:室温、35、45、55、65 ℃;提取料液比:1:10、1:15、1:20、1:25、1:30;乙醇浓度:40%、60%、70%、80%、100%。
1.3.2 响应面法优化试验
在单因素试验基础上,选取料液比、乙醇浓度、浸提时间作为3因素,并以总还原能力和透明质酸酶抑制率作为响应值,采用Box-Behnken中心组合试验来确定最优提取条件。
1.4 活性物质含量测定方法
总酚含量的测定:福林酚-肖卡法[11],以没食子酸为标品;总黄酮含量的测定:亚硝酸钠-亚硝酸铝法[12],以芦丁为标品;原花青素含量的测定:香草醛-浓硫酸法[13],以儿茶素为标品;皂苷含量的测定:香草醛-冰醋酸法[14],以薯蓣皂苷元为标品;生物碱含量的测定:酸性染料法[15],以澳洲茄胺为标品。
计算公式为X=(C×N×V)/M
注:C为活性物质浓度,mg/mL;N为稀释倍数;V为狭叶荨麻提取样液体积,mL;M为狭叶荨麻醇提物质量,g。
1.5 狭叶荨麻醇提物抗氧化及抗炎活性评价方法
1.5.1 体外抗氧化活性评价方法
清除DPPH·能力:参考文献[16]的方法,略有改动;清除·OH 能力:硫代巴比妥酸法[17],用 2-脱氧-D-核糖作底物;总还原能力:FRAP法[18]。
1.5.2 体外抗炎活性评价方法
抑制透明质酸酶能力:参考文献[19]方法,略改动;抑制白蛋白变性能力:参考文献[20,21]方法,略改动。
1.6 数据处理
所有试验数据±sd表示,采用SPSS 21.0进行数据处理,Design-Expert 8.0.6进行试验设计及分析,Origin 85进行作图,以p<0.05为统计学差异。
2 结果与讨论
2.1 单因素试验结果
2.1.1 提取时间的影响
其他因素不变情况下,提取时间对狭叶荨麻醇提物抗氧化以及抗炎活性影响如图1所示,从图1可以看出,狭叶荨麻醇提物总还原能力在120 min出现最大值,透明质酸酶抑制率在120 min出现最大值。随着时间的延长,活性物质的溶出量增多。因此提取时间120 min为较优水平。
2.1.2 提取温度的影响
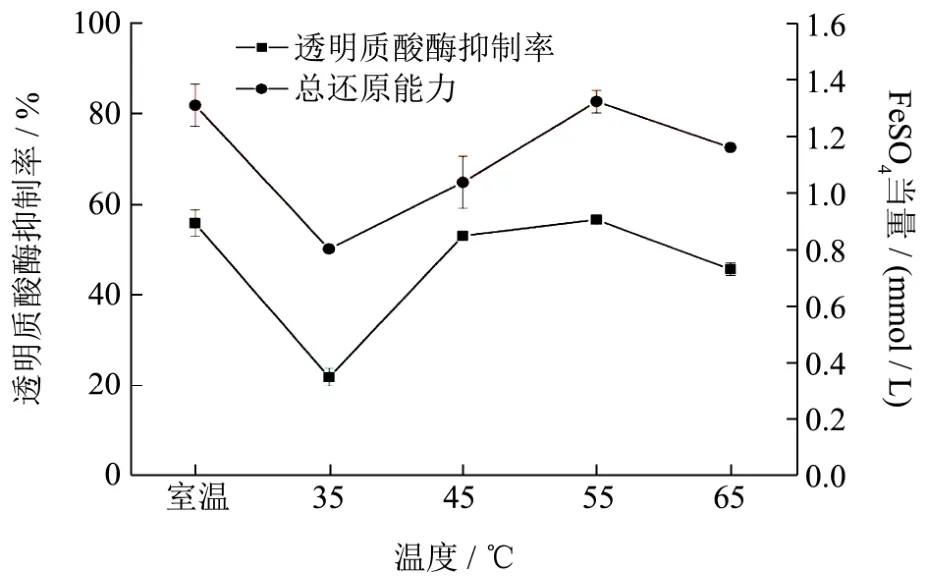
图2 提取温度对抗氧化及抗炎活性的影响Fig.2 The effect of extraction temperature on antioxidation and anti-inflammatory
其他因素不变情况下,提取温度对狭叶荨麻醇提物抗氧化以及抗炎活性影响如图2所示。从图2可以看出,狭叶荨麻醇提物总还原能力在室温出现最大值,透明质酸酶抑制率在室温出现最大值。
随着温度的缓慢上升,狭叶荨麻醇提物抗氧化能力及抗炎活性逐渐增强,说明温度对狭叶荨麻活性物质的提取有一定促进作用,而温度过高则影响提取物活性,抗氧化及抗炎活性会减弱。综合考虑能源的消耗,因此提取温度选为室温进行下一步 Box-Behnken中心组合试验。
2.1.3 提取料液比的影响

图3 提取液料比对抗氧化及抗炎活性的影响Fig.3 The effect of extraction solid-liquid on antioxidation and anti-inflammatory
其他因素不变情况下,提取料液比对狭叶荨麻醇提物抗氧化以及抗炎活性影响如图3所示。从图3可以看出,狭叶荨麻醇提物总还原能力在料液比为1:20出现最大值,透明质酸酶抑制率在料液比为1:20出现最大值。狭叶荨麻醇提物抗氧化及抗炎活性在料液比为1:20左右达到较高值。说明了料液比过小导致活性物质得不到充分提取,而料液比过大也影响提取率。因此料液比1:20为较优水平。
2.1.4 乙醇浓度的影响

图4 乙醇浓度对抗氧化及抗炎活性的影响Fig.4 The effect of ethanol concentration on antioxidation and anti-inflammatory
其他因素不变情况下,乙醇浓度对狭叶荨麻醇提物抗氧化以及抗炎活性影响如图4所示。从图4可以看出,狭叶荨麻醇提物总还原能力在乙醇浓度为60%出现最大值,透明质酸酶抑制率在乙醇浓度为60%出现最大值,同时综合在单因素试验时的其他指标(另文),选取乙醇浓度70%为较优水平。
根据单因素试验结果,Box-Behnken中心组合试验水平设置及编码见表1。

表1 Box-Behnken中心组合试验设计因素水平Table 1 Factors and Levels in the Box-Benhnken Design
2.2 Box-Behnken中心组合试验结果
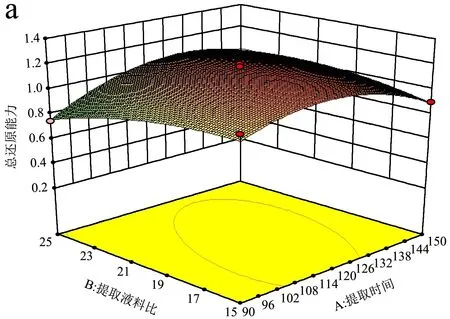
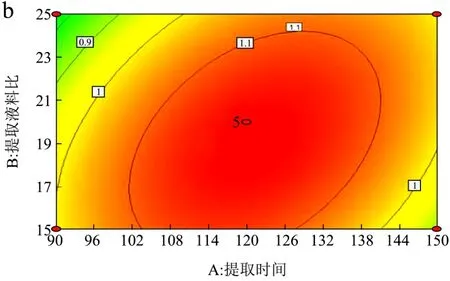
图5 提取时间与液料比的交互作用响应面Fig.5 The response surface methodology of extraction time and solid-liquid interactions

图6 提取时间与乙醇浓度的交互作用响应面Fig.6 The response surface methodology of extraction time and ethanol concentration interactions
在单因素试验的基础上,通过Box-Behnken中心组合试验进一步优化提取条件。Box-Behnken中心组合试验设计结果见表2,试验方差分析见表3。
将表3的试验数据进行拟合,分别得到总还原能力(mmol/L FeSO4)和透明质酸酶抑制率(%)的模拟方程:
Y1=1.16+0.033A-0.033B-0.31C+0.086AB+7.399E-003AC-0.022BC-0.18A2-0.070B2-0.33C2
Y2=73.92+2.64A-3.22B-13.46C+4.54AB+10.31AC+3.08BC-10.34A2+1.03B2-23.45C2
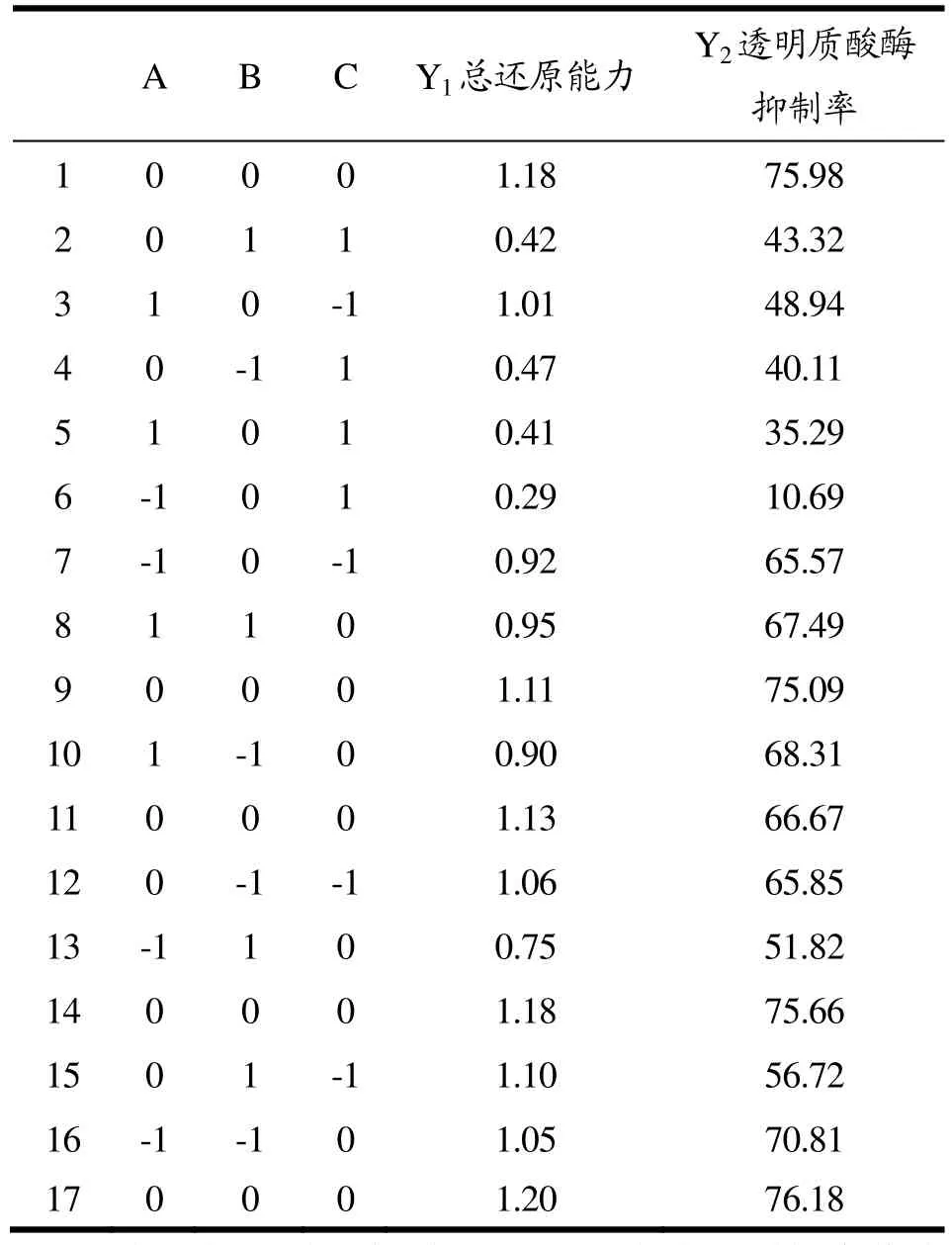
表2 Box-Behnken中心组合试验设计结果Table 2 Results of the Box-Benhnken Design
由表3的方差分析结果可知,将总还原能力作为响应值,该模型p<0.0001,说明该模型极显著;失拟误差p>0.05,说明没有产生失拟现象。R2为0.9890,说明拟合度良好,方程的显著性及可靠性极高。方程一次项系数C、二次项系数A2、C2和AB交互作用具有极显著性,方程二次项系数B2具有显著性。各因素对总还原能力的影响的顺序为:乙醇浓度>提取时间>提取液料比。
提取时间与液料比交互作用对总还原能力具有极显著的影响。图5为提取时间与液料比的交互作用对总还原能力的影响。
将透明质酸酶抑制率作为响应值,该模型p为0.0004,说明该模型极显著;失拟误差p>0.05,说明没有产生失拟现象。R2为0.9613,说明拟合度良好,方程的显著性及可靠性极高。方程一次项系数C、二次项系数A2、C2和AC交互作用具有极显著性。各因素对透明质酸酶抑制率的影响的顺序为:乙醇浓度>提取液料比>提取时间。提取时间与乙醇浓度交互作用对透明质酸酶抑制率具有极显著的影响。图6为提取时间与乙醇浓度的交互作用对透明质酸酶抑制率的影响。

表3 Box-Behnken中心组合试验方差分析Table 3 Box-Behnken and analysis of variance
通过Box-Behnken中心组合试验得到的最佳提取工艺条件为:提取时间为114 min、提取料液比为1:15、乙醇浓度为64%。在此条件下对狭叶荨麻进行提取得到的醇提物,得率为(10.00±0.26)%,总还原能力为(1.20±0.007)mmol/L FeSO4,透明质酸酶抑制率为(81.42±0.62)%,与模型预测误差值分别为0.84%和0.30%,说明预测较可靠。因此,BoX-Behnken中心组合试验对狭叶荨麻提取条件的参数优化是可行的,得到的工艺条件具有实际应用价值。
2.3 狭叶荨麻醇提物中活性物质的含量
在响应面优化后的提取条件下提取,测定其醇提物中的活性物质含量。总酚(160.77±0.01)mg/g、总黄酮(366.85±0.05)mg/g、原花青素(7.81±0.01)mg/g、皂苷(516.76±0.04)mg/g、生物碱(2.01±0.02)mg/g。
2.4 狭叶荨麻醇提物的体外抗氧化活性评价结果
在响应面优化后的提取条件下提取,采用抗坏血酸(Vc)作抗氧化阳性对照,对所得狭叶荨麻醇提物进行清除DPPH·、清除·OH、总还原力活性评价。
2.4.1 清除DPPH·能力
狭叶荨麻醇提物对 DPPH·的清除作用如图 7所示。从图7可以看出,狭叶荨麻醇提物对DPPH·具有显著的清除作用(p<0.001),量效关系明显(y=-33265x2+3226.9x+3.0615,R²=0.9936),在 0.05 mg/mL时达到(81.02±0.03)%。以Vc做阳性对照,在0.05 mg/mL时达到(71.63±0.33)%。狭叶荨麻醇提物和Vc的IC50分别为0.02 mg/mL和0.03 mg/mL。Vc具有递电子和递质子能力,对 DPPH·的清除作用是通过抗氧化剂把电子和质子传递给DPPH·,从而生成稳定的分子态的DPPH2[22]。抗氧化剂对DPPH·的清除是通过抗氧化剂递氢及递电子进行的,由于狭叶荨麻醇提物中酚酸、黄酮、原花青素[23]等抗氧化剂的协同作用,使得对 DPPH·的清除能力超过了阳性对照Vc(p<0.001)。
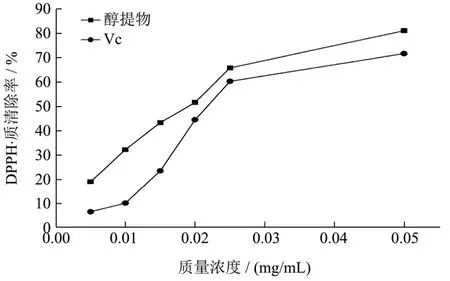
图7 狭叶荨麻醇提物对DPPH·清除作用Fig.7 The ethanol extractions of Urtic Angustifolia on DPPH· scavenging capacities
2.4.2 清除·OH能力
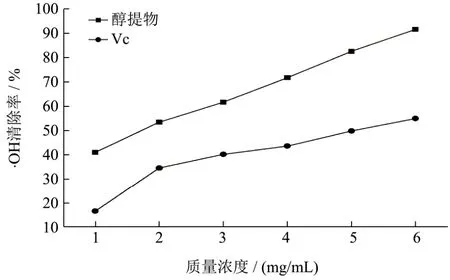
图8 狭叶荨麻醇提物对·OH清除作用Fig.8 The ethanol extractions of Urtic Angustifolia on ·OH scavenging capacities
狭叶荨麻醇提物对·OH的清除作用如图8所示。从图8可以看出,狭叶荨麻醇提物对·OH具有显著的清除作用(p<0.001),·OH清除与狭叶荨麻醇提物质量浓度之间呈现显著的正相关性,量效关系呈良好的线性关系(y=9.9858x+31.764,R²=0.9979)。以Vc做阳性对照,在6.0 mg/mL时分别达到(91.27±0.43)%和(54.69±0.34)%。狭叶荨麻醇提物和Vc的IC50分别为1.87 mg/mL和4.98 mg/mL。虽然Vc的还原性很强,还能阻断Fenton反应,但是狭叶荨麻中总黄酮、总酚、原花青素类的物质含量高,对·OH的敏感程度高出Vc,清除·OH能力远高于Vc(p<0.001)。
2.4.3 总还原能力
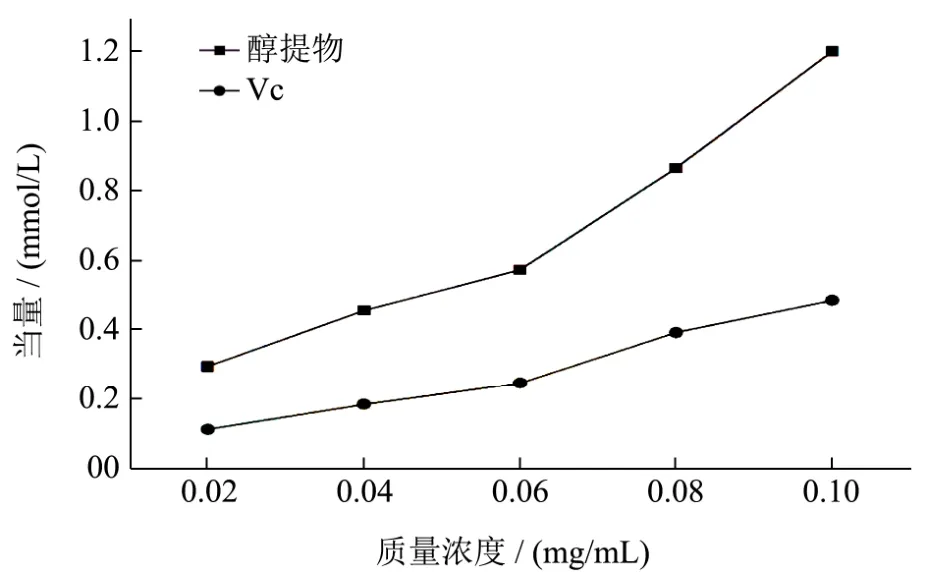
图9 狭叶荨麻醇提物的总还原能力Fig.9 The reducing power of ethanol extractions from Urtica Angustifolia
经测定,回归方程为 y=0.5765x+0.2207,R²为0.9992,在0.0~1.5 mmol/mL线性关系良好。狭叶荨麻醇提物的总还原能力如图 9所示。从图 9中可以看出,狭叶荨麻醇提物的总还原能力较强,且随着浓度的不断提高影响也越显著(p<0.001),在0.1 mg/mL时达到(1.20±0.01)mmol/L FeSO4。醇提物和Vc的EC50分别是0.04 mg/mL、0.10 mg/mL(以吸光值A=0.5,即0.48 mmol/L FeSO4计算EC50)。狭叶荨麻醇提物中除多酚类外,尚有皂苷、生物碱等抗氧化活性物质,使得总还原力强于 Vc。因此,狭叶荨麻醇提物的总还原能力高于阳性对照Vc。
2.5 狭叶荨麻醇提物的体外抗炎活性评价
在响应面优化后的提取条件下提取,采用双氯芬酸钠作为抗炎阳性对照,对所得狭叶荨麻醇提物进行抑制透明质酸酶、抑制白蛋白变性活性评价。
2.5.1 透明质酸酶活性的抑制
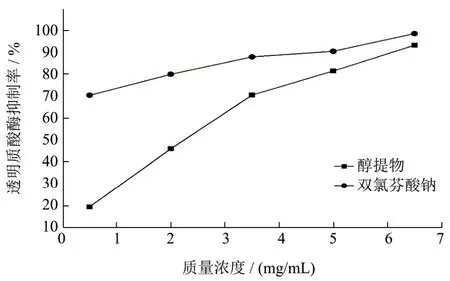
图10 狭叶荨麻醇提物对透明质酸酶的抑制作用Fig.10 The ethanol extractions of Urtica Angustifolia on inhibiting hyaluronidase activities
狭叶荨麻醇提物对透明质酸酶的抑制作用如图10所示。从图10可以看出,狭叶荨麻醇提物在高浓度 6.5 mg/mL时对透明质酸酶有较高的抑制率,为(93.14±0.08)%,与阳性对照双氯芬酸钠(98.44±0.23)%相近。狭叶荨麻醇提物的IC50为2.44 mg/mL。狭叶荨麻醇提物中的皂苷、生物碱均具有抗炎活性[24],在一定浓度时能对透明质酸酶产生抑制作用。黄酮类被证实能够抑制透明质酸酶活性,但作用机制尚不明确[25],这说明其是有效的透明质酸酶抑制剂。双氯芬酸钠在较低浓度时也对透明质酸酶有较高的抑制率且高于狭叶荨麻醇提物。
2.5.2 白蛋白变性的抑制
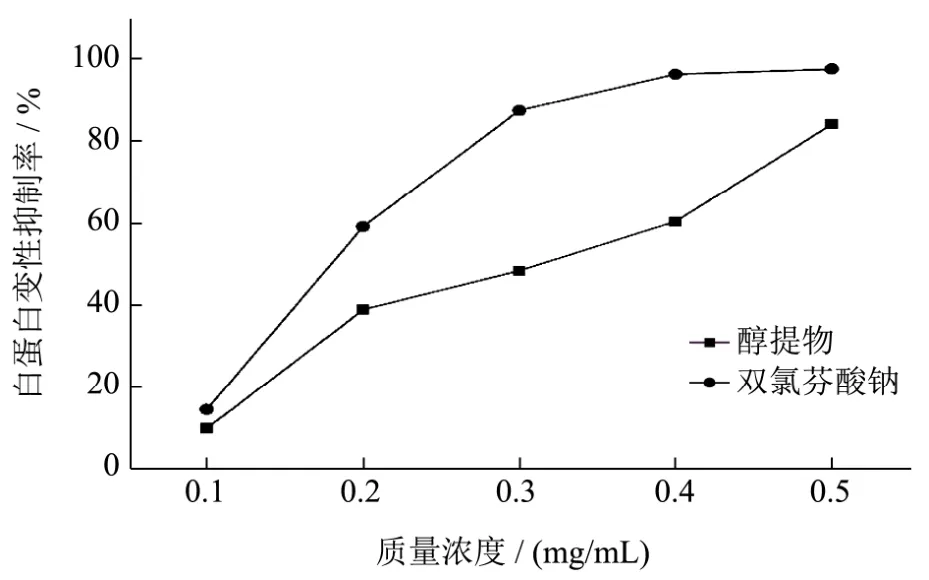
图11 狭叶荨麻醇提物对白蛋白变性的抑制作用Fig.11 The ethanol extractions of Urtica Angustifolia on inhibiting albumin denaturation activities
狭叶荨麻醇提物对白蛋白变性的抑制作用如图11所示。从图 11可以看出,狭叶荨麻醇提物在 0.5 mg/mL时对白蛋白变性的抑制率为(84.14±0.57)%,与阳性对照双氯芬酸钠(97.58±0.34)%相近。狭叶荨麻醇提物与阳性对照双氯芬酸钠的IC50值分别为0.31 mg/mL和0.19 mg/mL。内源性蛋白的变化是一种诱发慢性炎症疾病的病因[26],狭叶荨麻醇提物中皂苷、生物碱通过抑制炎症因子[24],起到抗炎作用。
3 结论
本研究在单因素试验的基础上,采用Box-Behnken组合试验,选取提取时间、提取料液比、乙醇浓度为因素确定三水平,以总还原能力和抑制透明质酸酶能力为响应值来确定最优提取条件。进行试验后,得到优化后的提取条件:提取时间 114 min,料液比1:15,提取溶剂乙醇浓度为64%。在此条件下得到的狭叶荨麻醇提物具有良好的抗氧化活性和抗炎活性。狭叶荨麻醇提物对DPPH·、·OH清除效果显著,IC50分别是0.02 mg/mL、1.87 mg/mL,较阳性对照Vc高;具有较高的总还原能力,在 0.1 mg/mL时达到(1.20±0.01)mmol/L FeSO4,EC50为0.04 mg/mL。狭叶荨麻醇提物在较高浓度时对透明质酸酶的抑制率较高,在6.50 mg/mL时达到(93.14±0.08)%,IC50值为2.44 mg/mL;对白蛋白变性的抑制作用与阳性对照双氯芬酸钠相近,IC50分别为 0.31 mg/mL和 0.19 mg/mL。狭叶荨麻醇提物中的活性物质含量为:皂苷>黄酮>总酚>原花青素>生物碱。研究[27~29]表明,多酚类、黄酮类、原花青素类物质具有抗氧化活性,皂苷类、原花青素类、生物碱类物质具有抗炎镇痛的作用。由此可以看出,狭叶荨麻醇提物所具有的抗氧化及抗炎活性为多种活性物质共同作用的结果。

