富氢盐水抑制大鼠压疮深部骨骼肌NLRP3炎性小体活化
陈晓伟,张红英,刘 静
压疮(pressure ulcer)是长期卧床患者常见并发症。局部组织长时间挤压导致供血障碍,挤压解除后供血恢复导致形成再灌注病理改变,反复的缺血再灌注损伤导致皮肤及骨骼肌细胞凋亡、组织坏死。研究表明,压疮发生起始于深层骨骼肌,继而发展至表层皮肤,骨骼肌缺血再灌注损伤程度决定了压疮的病理进程[1]。骨骼肌成为治疗压疮的关键靶器官。炎性反应是骨骼肌缺血再灌注损伤的重要病理机制之一[2]。NLRP3炎性小体(NLRP3 inflammasome)在免疫应答和炎性反应中发挥重要作用,由NOD样受体、凋亡相关斑点样蛋白(ASC)及天冬氨酸特异性半胱氨酸蛋白酶-1(caspase-1)共同组成。Stojadinovic等[3]证明,压疮深部骨骼肌NLRP3炎性小体各组件蛋白表达明显升高。提示NLRP3炎性小体参与了压疮的病理改变。
氧化应激是NLRP3炎性小体的重要活化机制[4]。氢分子具有很强的还原活性,可选择性抑制亚硝酸阴离子、羟自由基等活性氧(reactive oxygen species, ROS)成员的活性。研究表明,富氢盐水可有效抑制心、肺、肝、肾、脑等脏器缺血再灌注损伤[5]。Huang等[6]利用止血带制备骨骼肌缺血再灌注模型,发现再灌注前腹腔注射富氢盐水显著抑制骨骼肌细胞凋亡。本研究拟观察富氢盐水对压疮深部骨骼肌NLRP3炎性小体的干预效果,以探讨富氢盐水用于压疮治疗的可能性。
1 材料与方法
1.1 材料 健康雄性SD大鼠30只,购于军事医学科学院动物中心,体重(209.2±18.6) g。适应性饲养阶段,动物自由进食水,相对湿度45%~65%,温度(22±1)℃,12 h光照。大鼠饲养和干预均符合实验动物伦理学要求。
1.2 动物分组与造模 采用随机数字表法,大鼠分为3组:对照组(Control group, C)、压疮+生理盐水组(Pressure ulcer + saline group,PU+S)和压疮+富氢盐水组(Pressure ulcer + hydrogen-rich saline group,PU +HS),每组10只。PU+S和PU+HS组大鼠参照文献[7]方法制备双侧股薄肌压疮模型。压疮模型建立成功后,PU+HS组大鼠每日腹腔注射饱和富氢盐水(氢气浓度0.6 mmol /L,10 ml/kg体重)一次,连续5 d。PU+HS组大鼠每日腹腔注射生理盐水(10 ml/kg体重),连续5 d。对照组正常进食水,不予任何处理。各组大鼠均于末次腹腔注射后24 h断头处死,分离双侧股薄肌用于指标检测。
1.3 指标检测 (1)参照试剂盒(南京建成生物工程研究所)说明书操作,采用硫代巴比妥酸比色法,于紫外分光光度计测定反应体系吸光度值,计算骨骼肌组织丙二醛(MDA)含量(nmol/mg pro)。(2)参照大鼠骨骼肌组织IL-1β定量酶联检测试剂盒(上海碧云天生物技术有限公司)说明书操作,采用ELISA法,于荧光酶标仪测定各组骨骼肌组织IL-1β含量(pg/mg pro)。(3)参照试剂盒(南京建成生物工程研究所)说明书操作,采用荧光光分光光度法,于荧光酶标仪测定反应体系荧光强度。C组骨骼肌组织Caspase-1活性定义为1,PU+S和PU+HS组Caspase-1活性为与C组比较的相对活性。
1.4 骨骼肌组织NLRP3和ASC蛋白表达 Western blot法检测,以β-actin为内参。包含10 μg骨骼肌的组织匀浆与SDS上样缓冲液混合加热处理5 min,上样后经SDS-PAGE电泳分离,湿转法转移至PVDF膜,对应一抗振荡孵育12 h,PBS洗净后用辣根过氧化物酶标记二抗静置孵育1 h,PBS洗净后用显色试剂盒显影,X-ray胶片曝光记录。扫描条带灰度值,C组条带灰度值定义为100%,PU+S和PU+HS组为与C组比较的相对表达量。
2 结 果
2.1 对压疮深部骨骼肌MDA 、IL-1β含量和Caspase-1活性的影响 与C组比较,PU+S组MDA 、IL-1β含量和Caspase-1活性均显著升高(P<0.01),PU+HS组IL-1β含量显著升高(P<0.05)。PU+HS组与PU+S组比较,Caspase-1活性、MDA和IL-1β含量显著降低(P<0.01,表1)。
表1实验鼠各组骨骼肌MDA、IL-1β含量和Caspase-1活性的变化
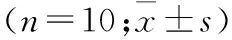

组别MDA(nmol/mg pro)Caspase-1 activity (Fold Change)IL-1β levels(pg/mL)C组13.15±1.931.00±0.230.47±0.07PU+S组27.40±4.42②1.42±0.35②1.05±0.19②PU+HS组14.92±3.11④1.13±0.25③0.69±0.18①④
注:C代表对照组,PU+S代表压疮+生理盐水组,PU+HS代表压疮+富氢盐水组。与C组比较,①P<0.05, ②P<0.01;与PU+S组比较,③P<0.05, ④P<0.01
2.2 对压疮深部骨骼肌NLRP3和ASC蛋白表达的影响 与C组比较,PU+S组NLRP3蛋白表达显著升高(178.49±18.62vs100.00±10.07,P<0.01),PU+HS组NLRP3蛋白表达升高(122.29±19.96vs100.00±10.07,P<0.05)。PU+HS组NLRP3蛋白表达低于PU+S组(P<0.01)(图1A)。与C组比较,PU+S组ASC蛋白表达显著升高(129.47±18.62vs100.00±12.92,P<0.01),PU+HS组ASC蛋白表达无统计学差异(105.33±16.67vs100.00±12.92,P<0.05)。PU+HS组ASC蛋白表达低于PU+S组(P<0.01)(图1B)。
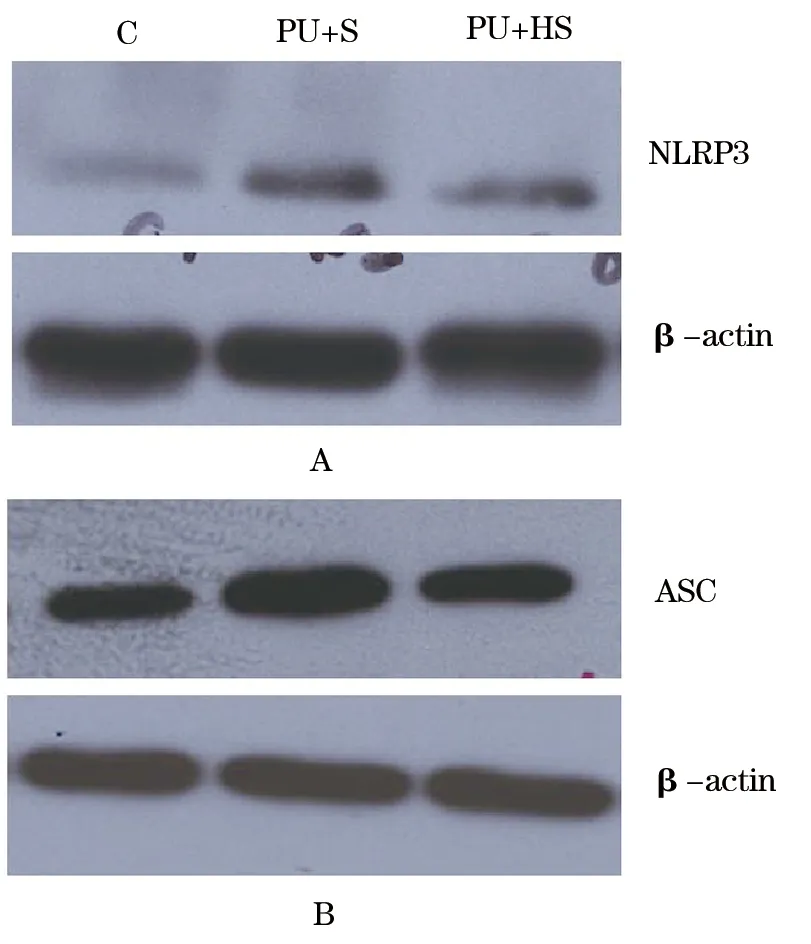
图1 实验大鼠各组骨骼肌蛋白表达的变化
3 讨 论
氧化应激与诸多疾病发生密切相关,富氢盐水因其抗氧化特质受到研究者的关注。研究表明,大鼠腹腔注射富氢盐水1 h后,血浆氢分子浓度可达到μM水平,MDA含量显著下降,是一种有效的氢分子抗氧化给药模式[8]。本研究中,连续腹腔注射富氢盐水5 d可显著降低压疮深层股薄肌MDA含量。氧化应激水平受到ROS产生和抗氧化酶活性的共同影响,MDA是生物膜脂类过氧化最主要的产物,可反映机体氧化应激水平。研究表明,氢可选择性与强氧化性ROS直接发生还原反应[5]。此外,Meng等[9]研究证明,富氢盐水可激活转录因子Nrf2,后者可促进SOD、HO-1等一系列内源性抗氧化酶表达。以上提示,富氢盐水可有效抑制压疮导致的骨骼肌氧化应激。
IL-1β是炎性反应中重要的促炎细胞因子之一,以无活性前体形式合成并存在,在IL-1β转化酶催化水解反应后转化为具有促炎效应的成熟IL-1β。免疫组化结果显示,压疮表层皮肤及深层肌肉组织IL-1β高表达[1]。研究表明,IL-1β可通过刺激巨噬细胞过度释放细胞因子参与缺血对骨骼肌的损伤[10]。此外,IL-1β可激活泛素-蛋白酶体通路导致缺血状态下骨骼肌蛋白降解[11]。本研究表明,富氢盐水显著降低压疮深层股薄肌IL-1β含量。Okamoto等[12]在肠梗阻大鼠模型中也发现,连续腹腔注射富氢盐水10 d显著降低肠壁肌层IL-1β表达水平。以上提示,富氢盐水可有效抑制压疮深部组织炎性反应。
氧化应激与IL-1β产生密切相关,目前被证明的有两条通路:一是ROS激活转录因子NFκB,后者结合IL-1β启动子,促进其表达;二是ROS激活NLRP3炎性反应小体中识别蛋白NOD样受体,使之聚集形成NLRP3寡聚体,通过衔接蛋白ASC募集并激活效应蛋白caspase-1,后者活化后切割白介素1-β(IL-1β),使之形成成熟炎性反应因子[13]。本研究表明,富氢盐水显著抑制了压疮深部骨骼肌NLRP3炎性小体活化,表现为NLRP3和ASC蛋白表达降低,同时caspase-1活性下降。研究表明,NLRP3炎性小体抑制剂INF4E明显抑制缺血再灌注导致的心肌线粒体损伤,部分恢复心脏收缩功能[14]。Ystgaard等[15]报道,与野生型鼠比较,NLRP3敲除鼠海马组织对缺血的抵抗力更强。以上提示,抑制NLRP3炎性反应小体活性是富氢盐水改善压疮的靶向之一。
总之,富氢盐水可能通过抑制氧化应激下调NLRP3炎性反应小体活化水平,进而抑制压疮诱导深部骨骼肌的炎性反应,是一种潜在的改善压疮的治疗方式。

