Reversine对肝星状细胞凋亡及相关蛋白表达的影响
黄 迪 黄 宇 翁杰锋 黄子圣 麦振豪 张 强 张汉意 张 帅 古维立
肝纤维化的发生发展是一种多途径、多因素参与的过程,主要病理改变是细胞外基质(Extracellular matrix,ECM)的过度合成与异常沉积。肝星状细胞(Hepatic Stellate Cells,HSCs)是参与肝纤维化形成最重要的细胞,HSCs的活化、增殖被认为是肝纤维化发生发展的中心环节[1],而抑制HSCs增殖、诱导其凋亡成为抗肝纤维化的重要策略。逆转素(Reversine)作为一种人工合成的小分子嘌呤衍生物,已被证实具有诱导成熟细胞去分化的作用,它能够让高度分化的细胞回复到祖细胞状态,而这些回复到祖细胞的状态的细胞具有分化为不同类型细胞的潜力[2-3]。Reversine的这种促使细胞返老还童的特性的发现为抗肝纤维化药物的研发提供了一个新的思路。已证实在大鼠肝纤维化模型中,Reversine可以通过降低肝纤维化中升高的α-SMA的表达而起到抑制肝纤维化程度的效果[4]。明确Reversine对HSCs的具体影响以及相关机制对于防治肝纤维化有重要意义。因此,本实验通过流式细胞术、细胞免疫荧光相结合的方法,在体外细胞水平探讨Reversine对HSCs细胞增殖、凋亡作用以及与肝纤维化相关蛋白质表达的差异,为进一步揭示肝纤维化的发展机制及Reversine抗肝纤维化提供理论依据。
1 材料与方法
1.1 试剂和仪器
肝星状细胞(中山大学动物实验中心细胞库); Reversine(Sigma公司);cck-8试剂盒(东仁化学科技有限公司);DMEM培养基干粉、胎牛血清、DMSO(Sigma公司);anti-TGF-β1(SAB4502954)、ANTI-SHC1(AB-427)(SAB4300557)、ANTI-RGN(HPA029103)(Sigma公司);caspase-3 antibody(#9662, Cell Signaling公司);mAb anti-Aurora B antibody(NB110-55480,Novusbio公司);ANTI-CDKN2A/p16INK4a[2D9A12](ab54210,Abcam公司);SMAD2/3 Antibody(BA1395,博士德生物工程有限公司);FITC标记羊抗鼠IgG(H+L)、FITC标记羊抗兔IgG(H+L)(Abbkine公司);FACS Calibur流式细胞仪(BD公司);Annexin-V-FITC/PI 凋亡试剂盒(凯基生物科技发展有限公司);生物安全柜、二氧化碳培养箱CCL-170A8(ESCO艺思高公司);多功能酶标仪(香港基因有限公司);IX51倒置相差显微镜(Olympus)。
1.2 实验方法
1.2.1 细胞培养 HSCs用体积分数为10%胎牛血清加1%双抗的高糖DMEM培养基,于二氧化碳培养箱(37 ℃,5%CO2)中培养,细胞换液时间为1~2 d,传代时间为3~5 d,传代前用2.5 g/L的胰酶消化。
1.2.2 实验分组 以加入DMSO的HSCs作为正常对照组;加药组:加Reversine干预,终浓度分别为5、10、20、40 μg/mL,每组药物干预时间为24 h。
1.2.3 CCK-8法检测HSCs增殖情况 取对数期生长的细胞,胰酶消化后,调整细胞密度为1×105个/毫升,接种于96孔板中,每孔100 μL,弃周围一圈改加1×PBS 100 μL保持湿度,不做测量,每组做5个复孔。待细胞长至80%满后,弃掉原培养基,以1×PBS轻轻冲洗一遍,按照分组情况加入药物干预,同时设立空白对照组(加培养基100 μL)作为调零用途,24 h后加入CCK-8试剂,与培养基按1 ∶10的比例加入,于培养箱中培养1 h后,多功能酶标仪检测波长为450 nm处的吸光度OD值。实验重复7次。细胞抑制率计算方法:R抑制=1-(A加药-A空白)/(A对照-A空白)×100%。
1.2.4 FACS Calibur流式细胞仪检测HSC的凋亡 取对数期生长的细胞,胰酶消化后制成细胞悬液,接种于3.5 cm培养板中,待细胞长至80%满后,弃掉原培养基,以1×PBS轻轻冲洗一遍,按照分组情况加入药物干预,24 h后胰酶消化收集细胞,1×PBS洗涤细胞两次,制成细胞悬液,用300目滤网过滤,收集滤液,计数取1×105个细胞,离心后用500 μL的 Binding Buffer重悬细胞,加入5 μL Annexin V-FITC以及5 μL PI,混匀,室温避光反应15 min, 1 h内完成检测。每组实验重复7次。
1.2.5 细胞免疫荧光法检测TGF-β1、caspase-3、Aurora B、collagen-I、SMAD2/3、Desmin、p16INK4a、SMP-30、p66SHC等蛋白的表达情况 按分组情况制成细胞爬片后,新鲜配制的4%多聚甲醛固定20 min, 0.5%Triton X-100对细胞透化处理10 min,5%BSA封闭1 h后加入一抗(用1%BSA 1∶100稀释),4 ℃孵育过夜,次日加入荧光标记的二抗(用1%BSA 1∶100稀释),室温避光孵育1 h,加入0.5 μg/mL DAPI染核10 min,每做一项处理后都用1×PBS洗涤3次,封片后在荧光显微镜下观察。
1.3 统计学处理
运用SPSS 13.0软件,多组间均数差异性比较采用单因素方差分析(One-way ANOVA)、LSD-t检验,数据均以mean±SD 表示,P<0.05为有统计学意义。
2 结果
2.1 不同浓度Reversine对HSCs增殖的影响
在未加入药物处理的情况下,HSCs增殖明显,当分别加入不同浓度(5、10、20、40 μg/mL)Reversine后,HSCs增殖受到抑制,其抑制率分别为38.03±9.05、44.97±5.85、55.33±2.40、64.19±3.66,F=27.356,P=0.000,两两比较p<0.05,可见Reversine对HSC增殖抑制呈现剂量对应关系,见图1。利用SPSS 13.0软件测得Reversine在24 h对HSC的IC50值为13.45 μg/mL。
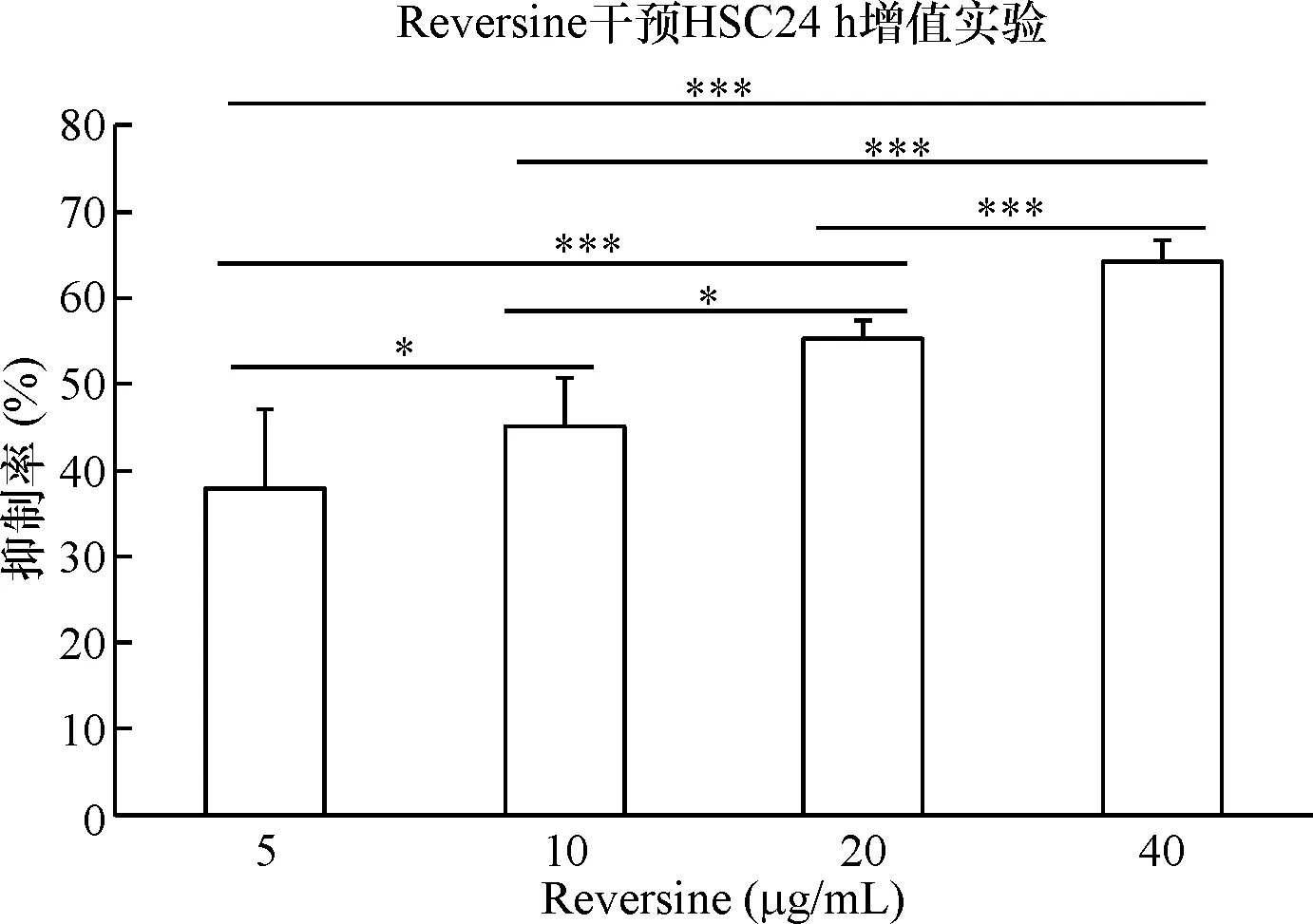
注:*表示P<0.05,***表示P=0.000图1 不同浓度Reversine处理24 h对HSC增殖的影响
2.2 不同浓度Reversine引起HSCs凋亡
经Calibur流式细胞仪检测显示,对照组仅有少量细胞发生凋亡,总凋亡率为(2.36±0.61)%;而不同浓度Reversine干预HSCs 24 h后存在不同程度的凋亡(见图2)。其中,Reversine浓度为5 μg/mL的总凋亡率(13.14±1.87)%与对照组比有统计学意义(P<0.01);当浓度上升到40 μg/mL时,总凋亡率为(21.24±1.07)%,凋亡效果更佳明显,说明Reversine可以诱导HSC凋亡,且呈现剂量效应关系,见表1。同时我们将早晚期凋亡情况分开分析发现,同一浓度Reversine作用HSCs,晚期凋亡细胞要多于早期凋亡细胞。但无论是早期还是晚期凋亡,随着Reversine浓度的增加,HSCs凋亡也随之增加(见图3)。值得注意的是,Reversine的剂量从20 μg/mL增加到40 μg/mL时,其凋亡率并没有随之显著增加,两组相比P=0.295,没有统计学差异,其原因可能为在达到一定浓度后,Reversine使得HSCs的周期停滞在某个时期,而并不是直接引起HSCs的凋亡。
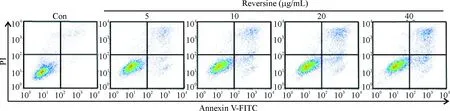
图2 不同浓度Reversine处理24 h对HSCs凋亡的影响
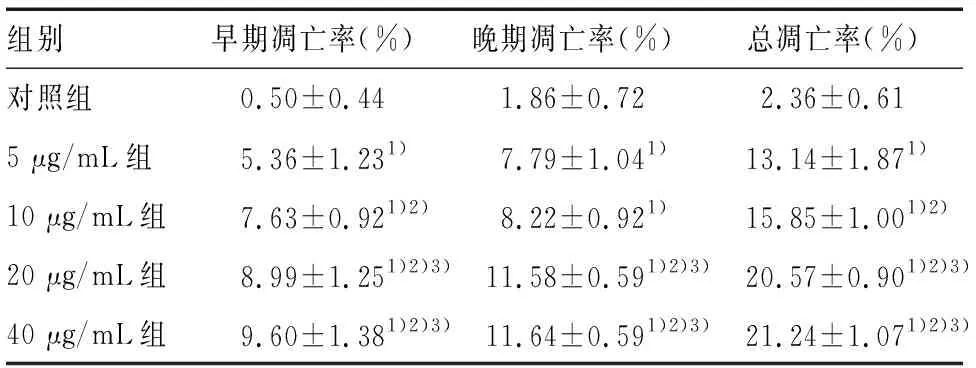
组别早期凋亡率(%)晚期凋亡率(%)总凋亡率(%)对照组0.50±0.441.86±0.722.36±0.615 μg/mL组5.36±1.231)7.79±1.041)13.14±1.871)10 μg/mL组7.63±0.921)2)8.22±0.921)15.85±1.001)2)20 μg/mL组8.99±1.251)2)3)11.58±0.591)2)3)20.57±0.901)2)3)40 μg/mL组9.60±1.381)2)3)11.64±0.591)2)3)21.24±1.071)2)3)
注:1)表示与对照组比较,P<0.01,2)表示与5 μg/mL组比较,P<0.01,3)表示与10 μg/mL组比较,P<0.01,n=7
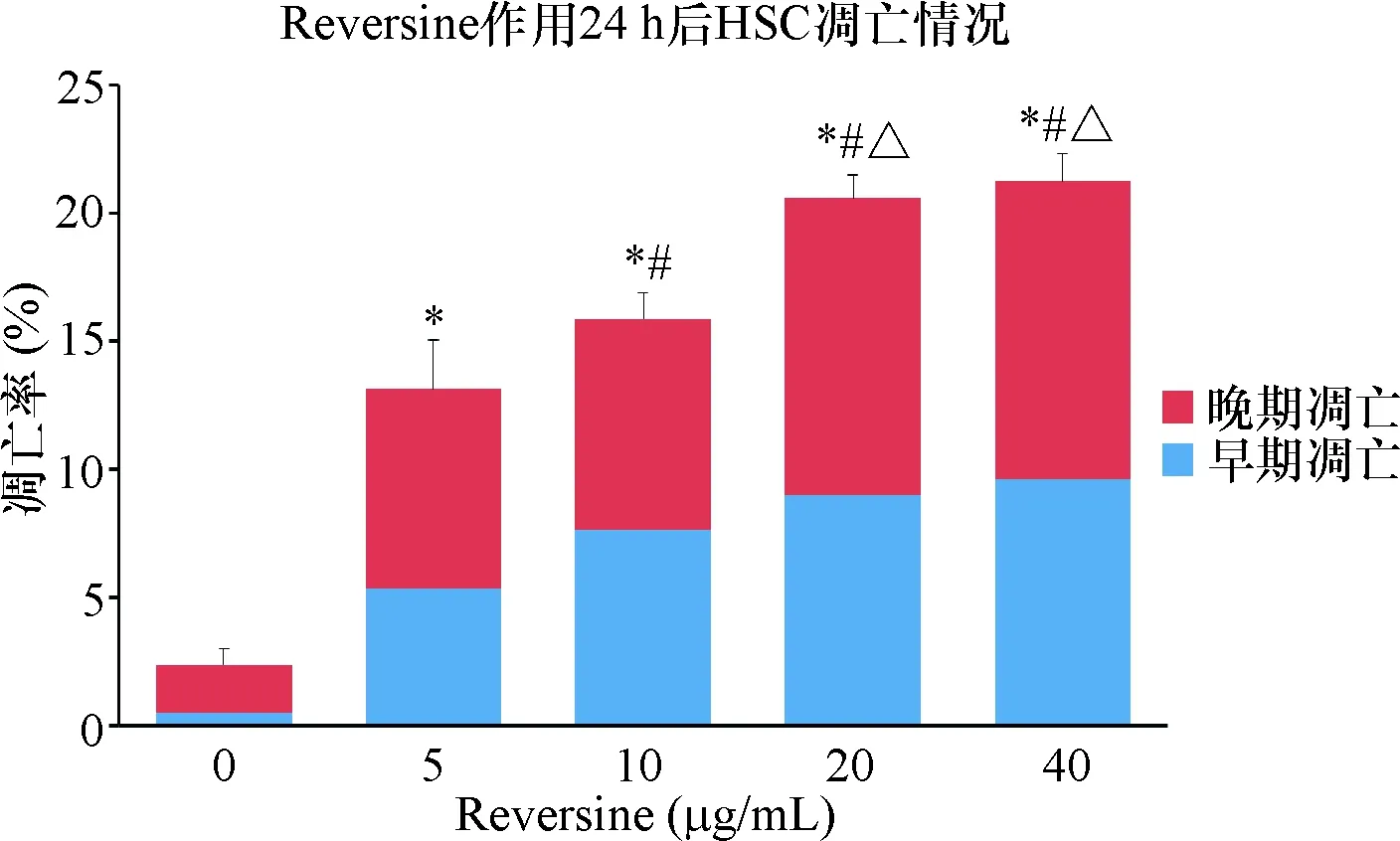
注:*表示与对照组比较P<0.01,#表示与5 μg/mL组比较,P<0.01,Δ表示与10 μg/mL组比较,P<0.01,n=7
图3不同浓度Reversine处理24 h对HSCs凋亡的影响
2.3 Reversine干预HSCs后相关蛋白的表达
在荧光显微镜下可观察到正常对照组HSCs的细胞核染色及大小较均一;当用Reversine处理HSCs后,HSCs凋亡细胞逐渐增多,表现为细胞核大小不均、核浓缩、裂解、凋亡小体及多倍体的形成。于是,我们利用细胞免疫荧光法定性检测了在20 μg/mL的Reversine干预HSCs后对TGF-β1、caspase-3、Aurora B、SMAD2/3、Desmin、p16INK4a、SMP-30、p66SHC等蛋白的表达的影响,见图4,发现Reversine干预HSCs后,可以检测到caspase-3、TGF-β1、SMAD2/3、Aurora B蛋白的荧光表达,而Desmin、p16INK4a、SMP-30、p66SHC等蛋白未见相关荧光表达。
3 讨论
肝星状细胞(Hepatic Stellate Cells,HSCs)在肝纤维化的发生发展中起重要作用。正常情况下肝星状细胞处于静止状态,当致肝病因子造成肝细胞损伤时,激活的Kupffer细胞、窦内皮细胞及损伤的肝细胞等分泌多种细胞因子和化学介质共同作用于HSCs,使HSCs激活并转化为肌成纤维细胞,激活的HSCs通过自分泌和旁分泌,促进HSCs增殖,合成大量ECM并在肝内沉积,导致肝纤维化[5]。因此,HSCs的活化是肝纤维化形成的关键,是肝纤维化发生发展的中心环节,那么阻断HSCs活化并促进活化HSCs的凋亡对逆转肝纤维化具有实用价值。
我们前期的研究发现在大鼠肝纤维化模型中,Reversine可以通过降低肝纤维化中升高的α-SMA的表达而起到抑制肝纤维化程度的效果[4]。但是,我们仍不清楚Reversine抑制肝纤维化的具体机制。鉴于HSCs对于肝纤维化的重要性,我们通过不同浓度的Reversine处理体外培养的HSCs,探究Reversine对HSC细胞的影响。通过CCK-8法增殖试验发现,在体外5 μg/mL的Reversine即可明显抑制HSC细胞的活性,其24 h抑制率达(38.03±9.05)%,当剂量增至40 μg/mL时,抑制率增加至(64.19±3.66)%,呈现一种剂量效应关系。通过计算,我们得出Reversine在24 h的半数抑制浓度(IC50)约为13.45 μg/mL。流式细胞术作为检测细胞早期凋亡的首选方法,是目前最为理想的凋亡定量检测方法[6]。我们通过流式细胞术检测了Reversine对HSCs早期凋亡和晚期凋亡情况的影响,结果发现一定浓度下Reversine作用HSCs后,晚期凋亡细胞要多于早期凋亡细胞,但无论是早期还是晚期凋亡,随着Reverssine浓度的增加,HSCs凋亡也随之增加,且呈现剂量对应关系。但是值得注意的是,本实验Reveersine的剂量从20 μg/mL增加到40 μg/mL时,其凋亡率并没有随之显著增加,而是达到相对稳定的状态,究其原因可能是在达到一定浓度后,Reversine使得HSCs的细胞周期停滞在某个时期,而并不是直接引起HSCs的凋亡。
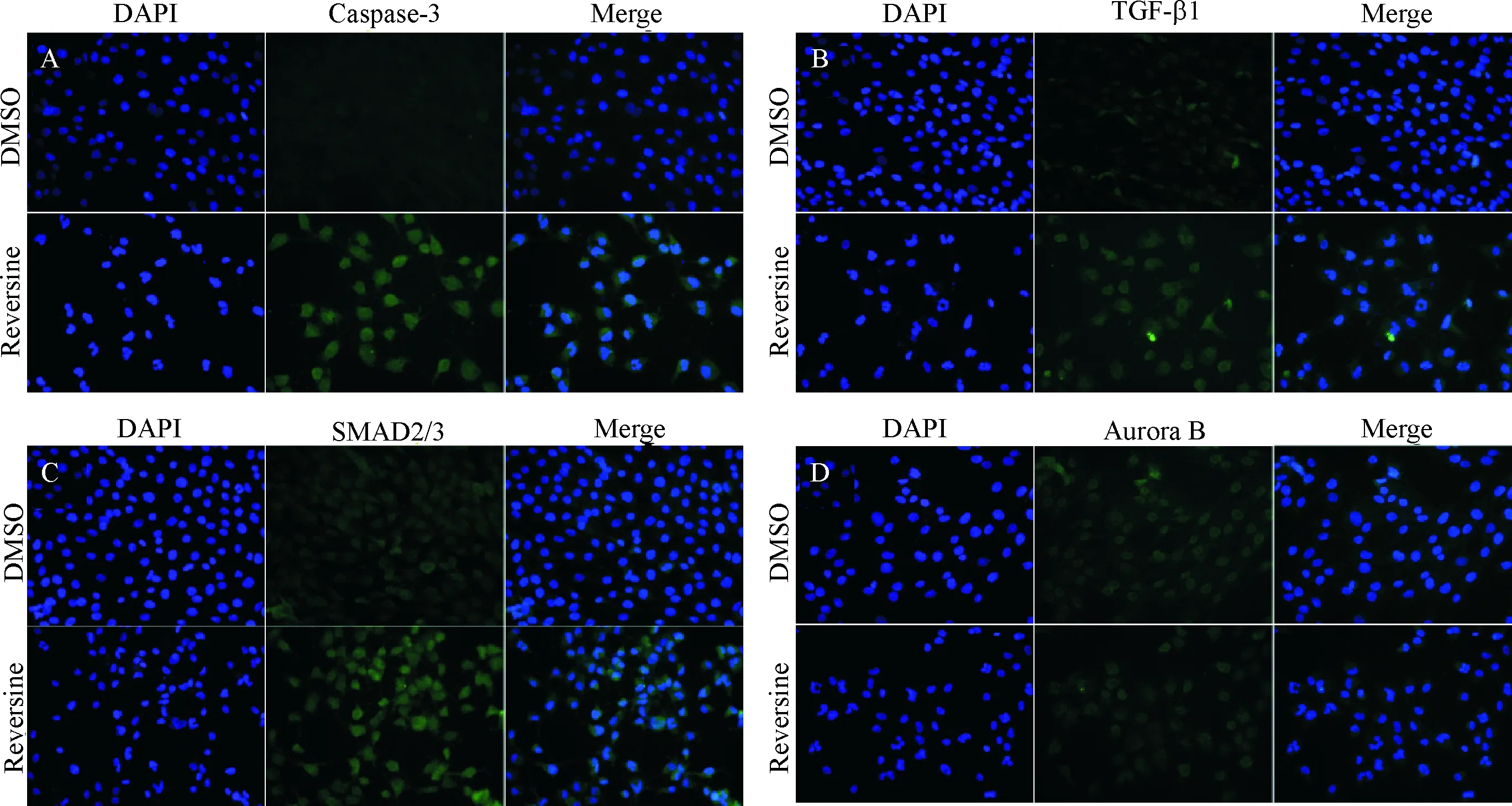
注:A表示Caspase-3;B表示TGF-β1;C表示SMAD2/3;D表示Aurora B
引起HSCs激活和凋亡的分子机制十分复杂,包括TGF-β1/Smad 介导的信号转导途径、MAPK介导的信号转导途径、PDGF 介导的信号转导途径、PPAR信号途径、NF-κB 信号通路、Wnt 信号转导通路等。本实验利用细胞免疫荧光法定性检测了在5 μg/mL的Reversine干预HSCs后对相关蛋白影响,结果发现Reversine干预HSCs后,可以检测到TGF-β1、caspase-3、Aurora B、SMAD2/3蛋白的荧光表达,而Desmin、p16INK4a、SMP-30、p66SHC等蛋白未见相关荧光表达。肝纤维化反应的是细胞外基质的合成与降解的失衡,表现为细胞外基质合成大于降解。在肝纤维化的过程中,细胞外基质的主要成分包含各种胶原蛋白,其降解过程受到金属蛋白酶及其抑制剂(MMPs/TIMPs)的调控相关。TGF-β1既是HSC启动阶段分子调控最强的促进因子,同时也是持续激活阶段的细胞因子。TGF-β1是肝脏中呈高表达的亚型,通过与Smads结合而发挥生物学活性,能直接和间接刺激HSC的活化和增殖。TGF-β1的表达水平与肝纤维化的严重程度呈显著正相关。由此我们推测Reversine引起HSCs凋亡可能和TGF-β1/Smad介导的信号转导途径、caspase-3蛋白途径有关,其中具体相关蛋白的定量表达情况,本研究组将在下一步实验中进一步研究。
综上所述,本实验通过Reversine体外干预HSCs细胞,证实了Reversine能抑制肝星状细胞的增殖,诱导其凋亡,并且影响肝星状细胞TGF-β1、caspase-3、Aurora B、SMAD2/3等蛋白质的表达,其相关机制可能与TGF-β1/Smad 介导的信号转导途径、caspase-3蛋白途径有关。

