HPLC测定胸腺素α1-胸腺五肽融合肽的含量
王彦厚,王凤山
(1. 山东大学药学院,山东 济南 250012;2. 淄博市食品药品检验研究院,山东 淄博 255086)
胸腺五肽(thymopentin,TP5)是位于胸腺生成素Ⅱ的第32~36位氨基酸残基片段,也是胸腺生成素Ⅱ的活性中心,能双向调节失衡的免疫系统,是一种重要的免疫调节剂[1-2]。胸腺素α1(thymosin α1,Tα1)是一种天然存在于多种生物组织的多肽物质,由28个氨基酸残基组成[3],作为免疫增强剂用于临床[4-6]。TP5和Tα1具有相似的免疫调节活性,但TP5的体内半衰期(t1/2)很短(约30 s),需要频繁给药才能维持疗效;Tα1的体内t1/2较长(约100 min)。
为提高TP5的活性,延长其体内t1/2,本课题组前期借助基因工程方法,将具有相似生物活性与临床用途的TP5 和Tα1连接在一起,采用大肠杆菌表达系统对Tα1-TP5进行融合表达,通过优化发酵工艺,成功进行了中试规模的生产,获得了Tα1-TP5融合肽。为更好地控制Tα1-TP5融合肽的质量,建立了高效液相色谱法(HPLC)测定胸腺素α1-胸腺五肽融合肽的含量,以保证该产品 的质量和疗效[7]。
1 仪器与试药
1.1 仪器
LC-2010C型高效液相色谱仪[岛津(中国)];UV2401PC型紫外可见分光光度计[岛津(中国)];AB104型电子分析天平(梅特勒-托利多);PHS-3C型精密pH计(上海仪电)。
1.2 试药
乙腈(色谱纯,Honeywell International Inc.);磷酸(色谱纯,上海阿拉丁);无水磷酸氢二钠(分析纯,国药集团);Tα1-TP5融合肽(山东金城生物药业,批号:TT-20170601,TT-20170602,TT-20170603)。
2 方法与结果
2.1 检测波长的选择
精密称取Tα1-TP5融合肽(批号:TT-20170601)10.36 mg,置于50 ml量瓶中,加水使溶解并定容至刻度,得溶液A;量取溶液A 5 ml,置于50 ml容量瓶中,加水稀释并定容至刻度,过滤,得样品溶液。照中国药典2015年版四部 通则0401紫外-可见分光光度法[7],在190~400 nm波长范围内扫描,确定最大吸收波长。本品的紫外吸收谱图见图1。结果显示:本品在208 nm波长处有最大吸收,故选择208 nm作为检测波长。
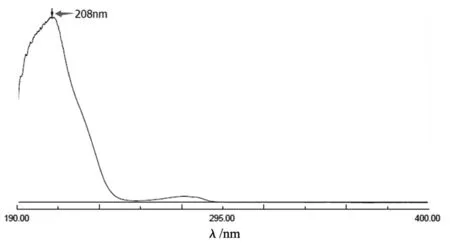
图1 Tα1-TP5融合肽的紫外吸收谱图
2.2 供试品溶液的制备
精密称取Tα1-TP5融合肽(批号:TT-20170601)10.0 mg,置于10 ml量瓶中,加入流动相摇匀使溶解,稀释至刻度,作为供试品溶液。
2.3 色谱条件与系统适用性
色谱柱为Agilent ZORBAX 80A Extend-C18柱(250 mm×4.6 mm,5 μm);流动相为0.05 mol/L磷酸氢二钠溶液(用磷酸调pH至7.5)-乙腈(9:1,v/v);流速为0.6 ml/min;检测波长为208 nm;进样量为20 μl。
2.4 方法学考察

图2 空白溶剂液相色谱图

图3 供试品溶液HPLC色谱图
2.4.1 专属性试验 分别精密量取蒸馏水(空白溶液)、供试品溶液各20 μl,注入高效液相色谱仪,记录色谱图。结果见图2和图3。结果表明:供试品溶液中,7.42 min为主成分峰,检出3个杂质峰,出峰时间分别为4.10,5.62,10.08 min。表明本方法专属性良好,溶剂不干扰样品的检测,能满足含量测定的要求。
2.4.2 线性关系试验 精密称取Tα1-TP5融合肽(批号:TT-20170601)19.1 mg,置于10 ml量瓶中,加入流动相溶解并稀释至刻度,摇匀,作为贮备溶液;分别精密量取贮备溶液1 ml,加适量流动相,制成浓度分别为0.479,0.766,0.957,1.126,1.367 mg/ml的溶液,备用。按2.3项色谱条件,精密量取以上各浓度溶液各20 μl,分别注入液相色谱仪,以浓度为横坐标(C),峰面积为纵坐标(A),进行线性回归,并求出线性方程,结果表明:Tα1-TP5融合肽在0.479~1.367 mg/ml浓度范围内,浓度(C)与峰面积(A)线性关系良好(r=0.9998)。
2.5 精密度试验
精密量取供试品溶液,重复进样6次,进样量20 μl,记录色谱图,Tα1-TP5融合肽主成分峰面积的RSD(n=6)为0.44 %。表明本法精密度良好。
2.6 重复性试验
精密称取6份Tα1-TP5融合肽(批号:TT-20170601)10.0 mg,分别置于10 ml量瓶中,加入流动相溶解并稀释至刻度,摇匀,即得。精密量取上述供试品溶液各20 μl,分别注入液相色谱仪,记录色谱图。结果表明:6份供试品溶液中,杂质1、杂质2、主成分、杂质3、总杂质的平均峰面积归一化法计算含量分别为0.314 %,0.049 %,98.831 %,0.807 %,1.170 %,RSD分别为3.78 %,8.97 %,0.04 %,3.73 %,3.10 %,均小于10 %。表明采用本法测定Tα1-TP5融合肽的含量,重复性良好。
2.7 检出限和定量限
量取2.4.2 项下浓度为0.479 mg/ml的溶液适量,配制成不同浓度的系列稀释溶液,分别量取各稀释溶液20 μl,分别注入液相色谱仪,记录色谱图。当Tα1- TP5融合肽的浓度为0.957 μg/ml,进样量为20 μl时,S/N=10.73,表明采用本法测定Tα1-TP5融合肽含量的定量限为19.14 ng/ml;当Tα1-TP5融合肽的浓度为0.319 μg/ml,进样量为20 μl时,S/N=3.76,表明采用本法测定Tα1-TP5融合肽含量的检出限为6.38 ng/ml。
2.8 溶液稳定性
将供试品溶液置于约30 ℃条件下放置,分别于第0,3,6,12 h取样,分别注入液相色谱仪,记录色谱图。杂质1、杂质2、主成分、杂质3含量RSD分别为8.94 %,21.48 %,0.09 %,5.91 %,结果表明室温下放置12 h内,供试品溶液中杂质1和杂质2含量有增加趋势,含量间RSD分别为8.94 %,21.48 %,显示供试品溶液在室温条件下不稳定,溶液须现配现用。
2.9 样品测定
分别取3批Tα1-TP5融合肽(批号:TT-20170601,TT-20170602,TT- 20170603),按2.2项方法配制供试品溶液,按2.3项色谱条件,以归一化法计算样品的含量分别为98.76 %,98.34 %,98.90 %。
3 讨论
本文对流动相进行了考察。采用磷酸盐缓冲液(pH 7.0)-甲醇(90:10)为流动相,在记录时间内未检测出有效峰;采用磷酸盐缓冲液(pH 7.0)-甲醇(70:30)为流动相,检测出有效峰,但基线噪音较大;分别以水-甲醇(70:30)、水-甲醇(90:10)为流动相,检测出有效峰,但出峰时间较靠前,与溶剂峰重合;以磷酸盐缓冲液(pH 7.5)-乙腈(90:10)为流动相,检测出有效峰,且主峰和相邻杂质分离度较好,杂质也可有效检出,故选择此条件进行试验。
实验中考察了Agilent ZORBAX 80A Extend-C18柱(250 mm × 4.6 mm,5 μm)和超宽pH耐受范围(pH 1.0~12.5)的Welch Xtimate-C18柱(150 mm×4.6 mm,3 μm),不同流速(0.5,0.6,0.7 ml/min),不同流动相pH值(7.0,7.5,8.0)条件下的分离效果。结果显示各条件下均能取得良好的分离效果,采用峰面积归一化法计算含量结果基本一致。此方法色谱峰分离度好,峰形良好,保留时间适中,适用于Tα1-TP5融合肽含量测定。

