山东北虫草不同极性部位调节免疫能力研究
李 洁,刘敬民,李万芳
(1. 山东中医药大学 中医学院,山东 济南 250355;2. 山东省农药科学研究院,山东 济南 250033;3. 山东协和学院,山东 济南 250109)
北虫草(Cordyceps militaris)在我国作为食药 用真菌而广泛应用[1],其研究与开发在近 30 年取得了迅猛发展,其药用价值和保健功能已被人们广泛接受,市场需求正不断扩大[2]。
现代科学研究表明,北虫草含有虫草多糖、核苷类、虫草酸和超氧化物歧化酶(SOD)等多种生物活性物质[3],具有增强细胞免疫、改善肾脏功能、抗肿瘤、延缓衰老等作用[4]。多项研究表明,这些作用均与免疫有关,通过影响机体免疫系统的多个环节,增强机体的免疫功能。目前鲜有关于北虫草免疫活性部位筛选的文献报道,尚不完全清楚山东北虫草对机体免疫器官和巨噬细胞吞噬功能及抗体产生是否有影响。为筛选北虫草子实体的免疫活性极性部位,本实验采用系统溶剂法,分别用石油醚、乙酸乙酯、正丁醇和蒸馏水依次提取。采用小鼠腹腔巨噬细胞功能测定法、免疫器官重量法及淋巴细胞转换率测定法,研究山东北虫草对小鼠免疫器官、巨噬细胞吞噬功能及抗体产生的影响,全面了解其作用机制,以期为科学开发和利用北虫草资源提供一定的实验依据。
1 仪器与材料
1.1 仪器
超声清洗仪(昆山市超声仪器公司);真空干燥箱(南京瑞奥);电热恒温水温箱(金坛杰瑞尔电器);台式水平离心机(北京医用离心机厂);电子天平;解剖盘;手术剪;手术镊;显微镜;计数器。
1.2 试剂
石油醚(60~90 ℃,天津广成,批号:20160618);乙酸乙酯(分析纯,天津天大,批号:20150920);正丁醇(天津广成,批号:20151028);植物血凝素(PHA,上海疾控生物科技,批号:20165802);鸡红细胞(CRBC,自制);羧甲基纤维素钠(CMC-Na,武汉全康);凡士林;盐酸(国药集团化学试剂公司,批号:20161127);Giemsa-Wright 染色液(上海远慕);肝素(国药集团化学试剂公司);蒸馏水(自制)。
1.3 材料
北虫草子实体石油醚提取物、乙酸乙酯提取物、正丁醇提取物、水提取物(自制)。
1.4 实验动物
1.4.1 实验动物选择 SPF级昆明种雌性小鼠160只,体重20±2 g,由山东中医药大学实验动物研究中心提供。
1.4.2 实验动物饲养管理 所有小鼠同室分笼饲养,温度(20±1)℃,湿度 40 %~50 %,光-暗周期12 h,颗粒饲料喂养,自由饮水,实验前饲养一周以适应环境。
2 方法
2.1 北虫草子实体供试样品制备
精密称取上述各极性部位提取物适量,石油醚、乙酸乙酯提取物用0.5 % CMC-Na溶解;正丁醇、水提取物用蒸馏水溶解。
2.2 实验动物处理
2.2.1 动物分组 将试验动物按体重分为:石油醚组、乙酸乙酯组、正丁醇组、水提取物组。每组按体重随机分为:空白对照组,高、中、低剂量组,每组10只动物,每日1次连续灌胃30 d,空白对照组给予等体积蒸馏水。苦味酸标记。
2.2.2 免疫处理 试验结束前3 d,各组腹腔注射生理盐水稀释过的PHA,剂量为0.3 ml/只。实验当天,每只小鼠腹腔注射1 % RBC生理盐水溶液进行免疫,剂量为1 ml/只。
2.3 不同极性提取物对小鼠免疫功能的影响实验
2.3.2 免疫器官指数测定 小鼠饲喂4周后,称重,颈椎脱臼处死,解剖动物,迅速取其免疫器官胸腺和脾脏,用滤纸吸去血渍,去除周围组织和脂肪等,称其湿重,计算免疫器官的指数。
2.3.3 小鼠腹腔巨噬细胞吞噬鸡红细胞实验 每只小鼠腹腔注射1 % CRBC 1 ml,颈椎脱臼处死,固定于手术台上,消毒腹部皮肤,吸出腹腔洗液l ml,平均分滴于2片玻片上,37 ℃温育30 min,用生理盐水漂洗,以除去未贴片细胞,晾干,以1:1丙酮甲醇溶液固定,4 %(v/v)Giemsa-磷酸缓冲液染色3 min,再用蒸馏水漂洗晾干,油镜下记数巨噬细胞,每张片记数100个,按下式计算吞噬百分率和吞噬指数。

2.3.4 小鼠淋巴细胞转化实验 实验前3 d,每只小鼠腹腔注射PHA 0.3 mg。3天后,小鼠断尾取血至玻片一端,另取一载玻片推片,自然干燥后,Giemsa-Wright 染液染色,再用生理盐水冲洗,用滤纸将标本吸水干燥后,镜检。
淋巴细胞转化率=转化淋巴细胞/(转化淋巴细胞+未转化淋巴细胞)×100%
2.4 统计学分析
使用SPSS19.0软件对实验所得的数据进行统计处理。试验数据以±s表示,采用组间t检验进行处理,以P<0.05为差异有统计学意义。
3 结果
3.1 体重测定
实验开始和结束时,分别将小鼠称重。记录样品各组小鼠的体重与对照组比较。结果见表1。
表1 北虫草不同极性部位对小鼠体重的影响/g( ±s,n=10)
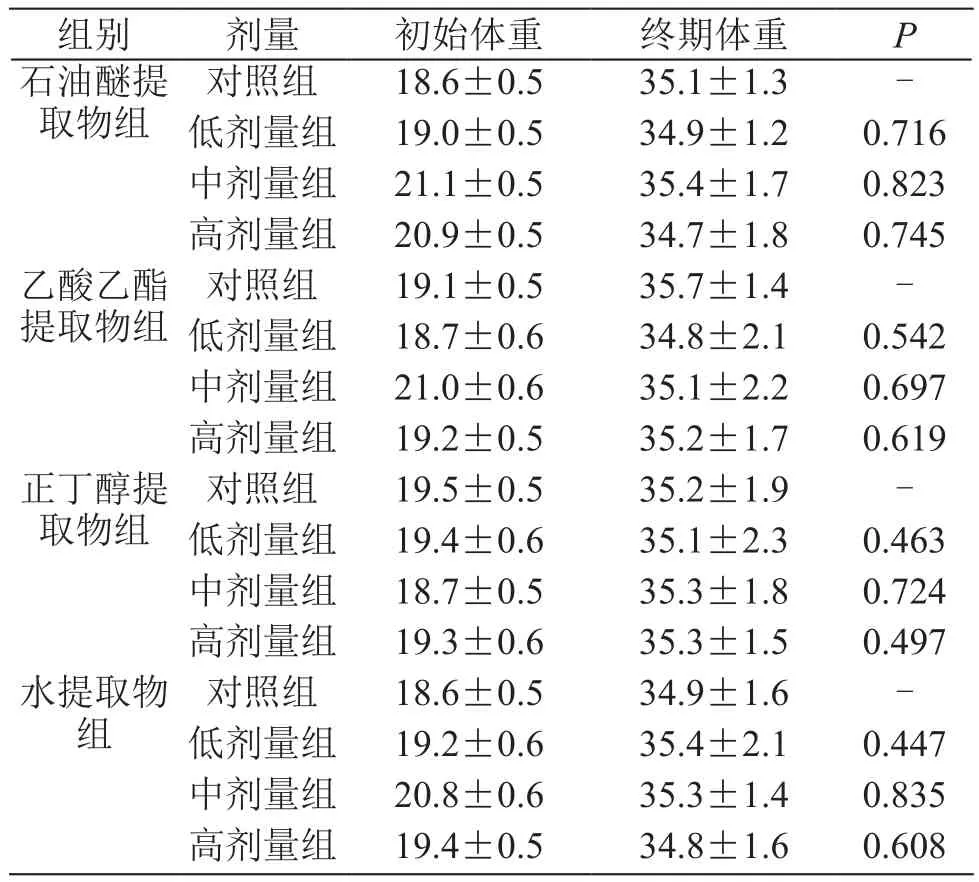
表1 北虫草不同极性部位对小鼠体重的影响/g( ±s,n=10)
组别 剂量 初始体重 终期体重 P石油醚提取物组对照组 18.6±0.5 35.1±1.3 -低剂量组 19.0±0.5 34.9±1.2 0.716中剂量组 21.1±0.5 35.4±1.7 0.823高剂量组 20.9±0.5 34.7±1.8 0.745乙酸乙酯提取物组对照组 19.1±0.5 35.7±1.4 -低剂量组 18.7±0.6 34.8±2.1 0.542中剂量组 21.0±0.6 35.1±2.2 0.697高剂量组 19.2±0.5 35.2±1.7 0.619正丁醇提取物组对照组 19.5±0.5 35.2±1.9 -低剂量组 19.4±0.6 35.1±2.3 0.463中剂量组 18.7±0.5 35.3±1.8 0.724高剂量组 19.3±0.6 35.3±1.5 0.497水提取物组对照组 18.6±0.5 34.9±1.6 -低剂量组 19.2±0.6 35.4±2.1 0.447中剂量组 20.8±0.6 35.3±1.4 0.835高剂量组 19.4±0.5 34.8±1.6 0.608
由表1可见,各样品低、中、高剂量组小鼠终期体重与对照组相比,差异均无统计学意义。
3.2 免疫器官指数测定
各组小鼠称重后处死,取出胸腺、脾脏,称其湿重,计算胸腺指数和脾脏指数。结果见表2。
表2 胸腺指数、脾脏指数的测定结果(±s,n=10)
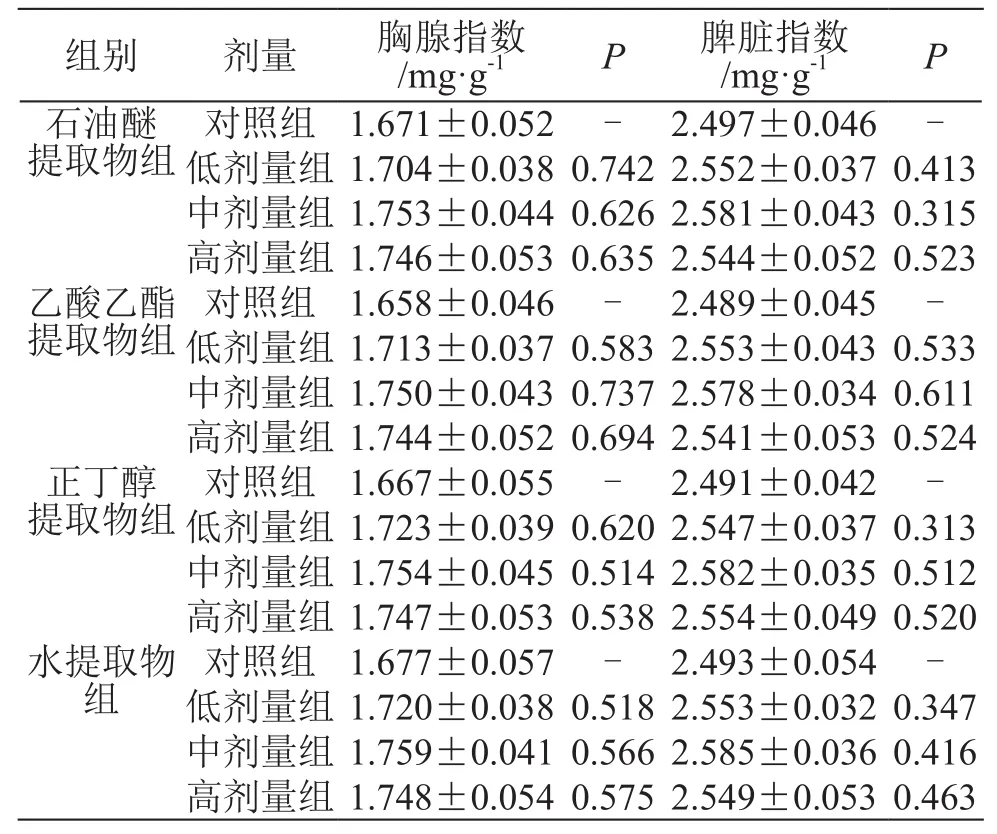
表2 胸腺指数、脾脏指数的测定结果(±s,n=10)
提取物组 对照组 1.671±0.052 - 2.497±0.046 -低剂量组 1.704±0.038 0.742 2.552±0.037 0.413石油醚中剂量组 1.753±0.044 0.626 2.581±0.043 0.315高剂量组 1.746±0.053 0.635 2.544±0.052 0.523乙酸乙酯提取物组 对照组 1.658±0.046 - 2.489±0.045 -低剂量组 1.713±0.037 0.583 2.553±0.043 0.533提取物组 对照组 1.667±0.055 - 2.491±0.042 -低剂量组 1.723±0.039 0.620 2.547±0.037 0.313中剂量组 1.750±0.043 0.737 2.578±0.034 0.611高剂量组 1.744±0.052 0.694 2.541±0.053 0.524正丁醇中剂量组 1.754±0.045 0.514 2.582±0.035 0.512高剂量组 1.747±0.053 0.538 2.554±0.049 0.520水提取物组对照组1.677±0.057-2.493±0.054-低剂量组1.720±0.038 0.518 2.553±0.032 0.347中剂量组 1.759±0.041 0.566 2.585±0.036 0.416高剂量组 1.748±0.054 0.575 2.549±0.053 0.463组别 剂量 胸腺指数/mg·g-1P脾脏指数/mg·g-1P
由表2可见,各样品低、中、高剂量组胸腺指数和脾脏指数与对照组相比,差异均无统计学意义。
3.3 北虫草不同极性部位对小鼠腹腔巨噬细胞吞噬鸡红细胞的影响
用不同剂量的北虫草不同极性部位提取物灌胃小鼠30 d,油镜下记录各组小鼠腹腔巨噬细胞吞噬鸡红细胞的能力,结果见表3。
表3 北虫草不同极性部位对小鼠腹腔巨噬细胞吞噬功能的影响( ±s,n=10)
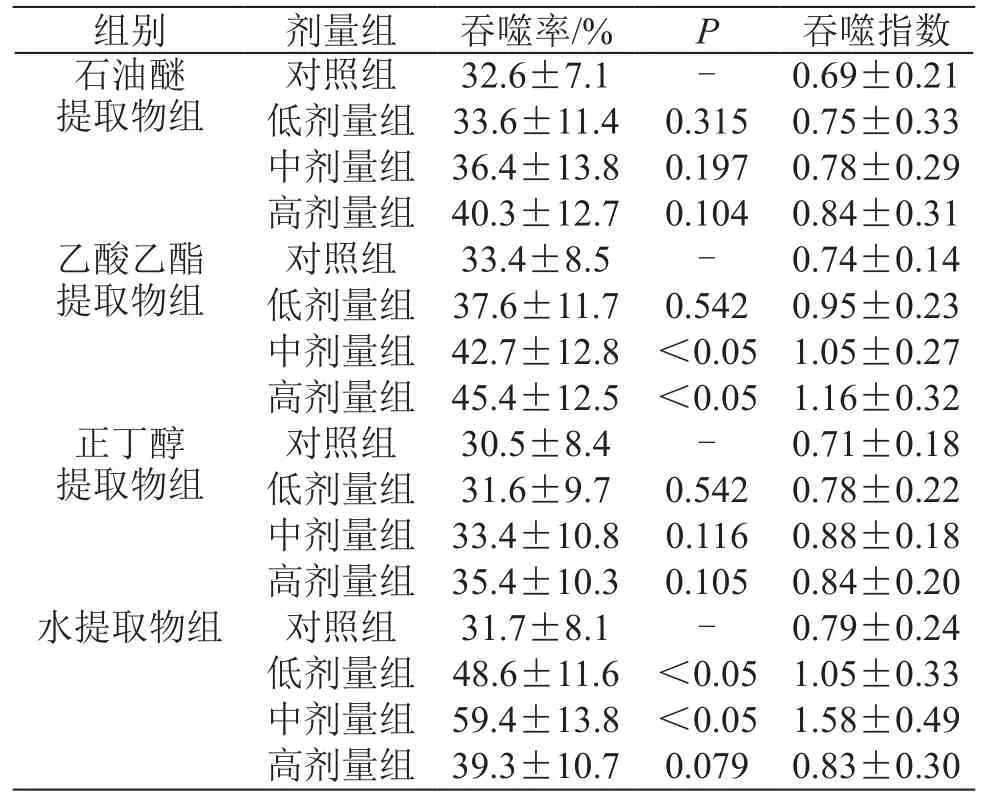
表3 北虫草不同极性部位对小鼠腹腔巨噬细胞吞噬功能的影响( ±s,n=10)
组别 剂量组 吞噬率/% P 吞噬指数石油醚提取物组对照组 32.6±7.1 - 0.69±0.21低剂量组 33.6±11.4 0.315 0.75±0.33中剂量组 36.4±13.8 0.197 0.78±0.29高剂量组 40.3±12.7 0.104 0.84±0.31乙酸乙酯提取物组对照组 30.5±8.4 - 0.71±0.18低剂量组 31.6±9.7 0.542 0.78±0.22中剂量组 33.4±10.8 0.116 0.88±0.18高剂量组 35.4±10.3 0.105 0.84±0.20水提取物组 对照组 31.7±8.1 - 0.79±0.24低剂量组 48.6±11.6 <0.05 1.05±0.33中剂量组 59.4±13.8 <0.05 1.58±0.49高剂量组 39.3±10.7 0.079 0.83±0.30对照组 33.4±8.5 - 0.74±0.14低剂量组 37.6±11.7 0.542 0.95±0.23中剂量组 42.7±12.8 <0.05 1.05±0.27高剂量组 45.4±12.5 <0.05 1.16±0.32正丁醇提取物组
由表3可见,与对照组相比,北虫草乙酸乙酯部位中剂量和高剂量对小鼠腹腔巨噬细胞吞噬鸡红细胞的吞噬率有增加作用(P<0.05);北虫草水提取部位低剂量和中剂量对小鼠腹腔巨噬细胞吞噬鸡红细胞的吞噬率和对照组相比有显著性差异(P<0.05),也有增强小鼠腹腔巨噬细胞吞噬功能的作用。
3.4 北虫草不同极性部位对小鼠淋巴细胞转化率的影响
用不同剂量的北虫草不同极性部位提取物灌胃小鼠30 d,油镜下记录各组小鼠淋巴细胞转化率,结果见表4。
表4 北虫草不同极性部位对淋巴细胞转化率的影响(±s,n=10)
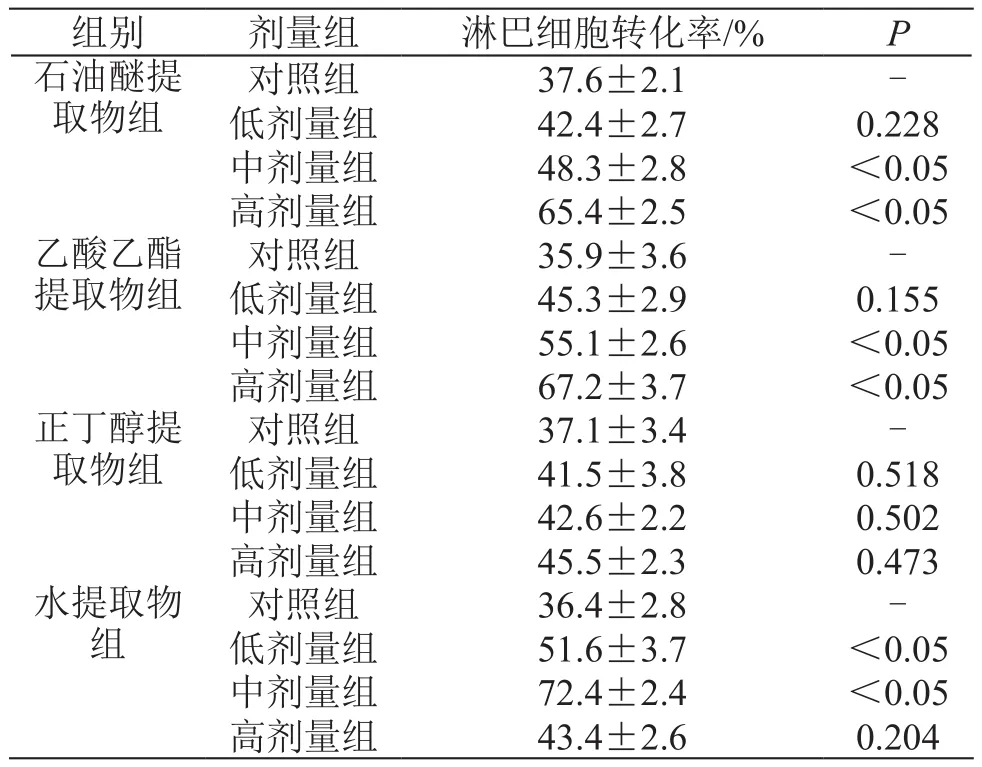
表4 北虫草不同极性部位对淋巴细胞转化率的影响(±s,n=10)
组别 剂量组 淋巴细胞转化率/% P石油醚提取物组对照组 37.6±2.1 -低剂量组 42.4±2.7 0.228中剂量组 48.3±2.8 <0.05高剂量组 65.4±2.5 <0.05乙酸乙酯提取物组对照组 35.9±3.6 -低剂量组 45.3±2.9 0.155中剂量组 55.1±2.6 <0.05高剂量组 67.2±3.7 <0.05正丁醇提取物组对照组 37.1±3.4 -低剂量组 41.5±3.8 0.518中剂量组 42.6±2.2 0.502高剂量组 45.5±2.3 0.473水提取物组对照组 36.4±2.8 -低剂量组 51.6±3.7 <0.05中剂量组 72.4±2.4 <0.05高剂量组 43.4±2.6 0.204
由表4可见,与对照组相比,北虫草石油醚部位和乙酸乙酯部位中剂量和高剂量对小鼠淋巴细胞转化率有增加作用(P<0.05);北虫草水提取部位低剂量和中剂量对小鼠淋巴细胞转化率和对照组相比有显著性差异(P<0.05)也有增加小鼠淋巴细胞转化率的作用。
4 讨论
免疫是指机体通过免疫应答排除抗原性异物,或被诱导呈免疫耐受状态以维持机体内环境的平衡和稳定[5]。免疫系统具有免疫防御、免疫自稳和免疫监视功能,可清除入侵病原生物及病毒感染细胞,杀伤肿瘤细胞并进行免疫调节。故此,若药材提取成分可作用于免疫系统的不同环节和相应组织、细胞及分子,即可有效提高机体免疫力,对抗感染及肿瘤等。
本研究表明,北虫草乙酸乙酯部位和水提取部位具有增强小鼠腹腔巨噬细胞吞噬鸡红细胞功能的作用,也有增加小鼠淋巴细胞转化率的作用,从而说明对小鼠的适应性免疫有促进作用。这两个部位活性成分研究最多的是虫草多糖和虫草素。虫草多糖被认为是当前世界上最好的免疫促进剂之一[6]。虫草素是一种核苷类抗菌素,在抗癌抑瘤、调节免疫系统、抗菌抗炎、降血糖、降血脂等方面的研究取得了突破性进展[7]。亦有研究证实虫草乙酸乙脂提取物的抗过敏机制与抑制磷酸化Syk,ERK,p38和JNK等蛋白表达相关[8],而虫草水提物能通过激活巨噬细胞NF-κB,增强NO的生成和促炎性细胞因子IL-1β,IL-6,TNF-α和PGE2的表达,是一个良好的免疫增强剂[9]。这与本实验的研究结果相吻合。
对山东北虫草石油醚提取部位进行GC-MS分析[10]:北虫草石油醚提取部位中含有长链不饱和脂肪酸类,其中亚油酸相对含量高达63.28 %。文献报道,许多不饱和脂肪酸除了能杀伤肿瘤细胞外,还能参与体内的免疫调节[11],本实验证实了这一点,为进一步研发北虫草的临床药品、保健食品以及相关领域的应用提供了科学数据。
相比价格昂贵、资源贫乏的天然冬虫夏草来说,北虫草价廉易得、资源丰富,但是其生物活性物质基础是什么,活性成分的化学结构以及作用机制值得进一步研究。本试验结果将对科学开发和利用北虫草资源提供一定的实验依据。

