体外受精-胚胎移植对胎盘滋养层细胞MAPK信号通路的影响研究
赵亮,张蕾,孙丽芳,王颖,于丽,郑秀丽,刘静芳,郑蓉
(1.北京积水潭医院,北京 100035;2.北京清华长庚医院,北京 102218;3.北京大学第三医院,北京 100191;4.北京大学北大医院,北京 100034)
辅助生殖技术(ART)安全性一直广受关注,流行病学调查显示,即使经过混杂因素的调整,辅助生殖围产期合并症发病率高于普通人群,其病理生理机制与胎盘发育不良有关,表现为胎盘滋养层细胞侵袭能力下降,对子宫螺旋动脉重塑不足[1]。类似地,在几种动物模型中,IVF-ET比自然受孕存在高发病率的胎盘滋养层细胞功能异常[2]。丝裂素活化蛋白激酶(MAPK)是细胞内信号转导的重要通路,在细胞核内基因转录调控方面具有重要作用,参与细胞分化、发育、分裂等多种生理功能,对胎盘滋养层细胞的黏附、侵袭功能起关键作用[3]。本研究排除不孕因素后,以自然妊娠为对照,对IVF-ET来源的早期胎盘绒毛组织进行基因芯片研究,探讨IVF-ET技术对早期胎盘滋养层细胞MAPK信号通路的功能影响,以寻找表达差异的基因和调控机制,从胎盘早期发育视角初步探讨辅助生殖安全性以及可能的病理生理机制。
资料与方法
一、研究对象
选取2014~2017年在北京大学第三医院生殖中心接受IVF-ET治疗并行双胚胎移植的28例孕妇作为研究组(IVF-ET组),同期在医院计划生育手术室行双胎妊娠人工流产的8例孕妇作为对照组。研究组入选标准为:年龄30~35岁,因输卵管因素接受IVF-ET治疗后双胚胎移植,双绒毛膜双胎,妊娠7~8周超声引导下减为单胎(因高血压、子宫畸形等客观因素或患者要求进行减胎),剩余胚胎妊娠经过正常,无妊娠并发症及出生缺陷。临床资料通过北京大学第三医院生殖中心数据库收集。对照组收集同期年龄相当、孕龄相当,流产前经B超确认绒毛膜性的自然妊娠双绒毛膜双胎,人工流产采用物理方法扩张宫颈管,不使用前列腺素药物。本研究方案和标本获取均经北京大学第三医院伦理委员会审核通过,两组孕妇均签署知情同意书。
二、实验方法
1.胎盘绒毛收集:IVF-ET组标本获取:患者排空膀胱,采用膀胱截石体位,常规消毒铺巾,采用穿刺针导架的无菌探头套阴道探头,检查孕囊数量、位置,使用16G双腔穿刺针,超声引导下穿刺阴道及子宫壁,刺入目标胚胎,用20 ml注射器抽吸胚胎,吸出胚胎组织或目标胚胎胎心搏动消失,在穿刺针退出的时候,在胚胎和子宫内膜交界处吸取胎盘绒毛组织。立即置于热台倒置显微镜下纯化胎盘绒毛,送少量绒毛组织到细胞遗传实验室进行核型检测,绒毛染色体正常的组织进行后续研究。对照组收集的人工流产绒毛组织进行同样的纯化及核型检测。
2.胎盘绒毛RNA提取:由北京博奥生物有限公司完成绒毛组织匀浆,使用Macherey Nagel NucleoSpin RNAⅡkit试剂盒(迪伦,德国)完成RNA提取及后续基因芯片检测。对总RNA进行质量检验,核糖体28S和18S RNA比值为1.0~1.5∶1之间,符合研究质量标准。
3.基因芯片分析:采用等量胎盘绒毛总RNA(2 μg)合成双链cDNA,MessageAmpⅡaRNA Amplification Kit(Ambion,美国)生物素标记获得cRNA。按照Affymetrix基因芯片方法指南将cRNA片段化,生成35~200 bp的cRNA。采用美国Affymetrix公司U133 plus 2.0芯片,芯片杂交炉640在45℃下旋转杂交16 h,基因芯片射流站450对芯片进行洗涤、染色(链霉亲和藻红蛋白),扫描仪3000和GCOS1.4分析基因芯片结果(上述仪器均购自美国Affymetrix公司)。采用二分类、非配对方法,Significance Analysis of Microarrays SAM version 3.02软件进行结果统计和分析,筛选差异表达基因。采用无监督聚类软件Cluster 3.0 & TreeView对差异表达基因制图分析。
4.实时定量反转录聚合酶链反应(qRT-PCR)检测:qRT-PCR方法验证基因芯片结果。选择MAPK信号通路中8个差异基因进行验证。RNA来自基因芯片检测及组内所有标本(IVF-ET组28例,对照组8例)。第一链互补合成反应采用PrimeScript反转录试剂盒(宝生物,大连)。qRT-PCR仪PRISM7300(ABI,美国)进行扩增反应,GAPDH内参,qRT-PCR检测引物详见表1。每个qRT-PCR反应设3个复孔,重复3次,结果分析采用DDCt方法。
三、统计学分析
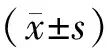

表1 qRT-PCR引物序列和扩增长度
结 果
一、胎盘滋养层细胞基因表达谱芯片结果
IVF-ET组与对照组的病例资料特点见表2(每组各4例,均满足统计学要求)。SAM软件分析发现,在妊娠7周胎盘绒毛组织中,IVF-ET组与对照组在MAPK信号通路中共有32个差异基因表达(差异表达倍数≥2倍),13个基因表达上调,19个基因表达下调,详见热图(图1)和散点图(图2)。利用无监督聚类软件对胎盘绒毛组织差异表达基因进行分析,结果以TreeView显示,8例样本被聚为两大类,可见与IVF-ET组胎盘绒毛组织和对照组的区分完全一致,差异明显,见图3。

表2 基因芯片病例资料
二、差异基因名称以及Ontology功能分析
IVF-ET组与对照组共有32个差异基因表达(差异表达倍数≥2倍),其中13个基因上调,19个基因下调,这些差异基因的名称、生物功能和染色体定位等分析见表3。

IVF-ET组与对照组胎盘绒毛组织中MAPK信号通路基因成员的差异表达情况,红色代表基因表达上调,绿色代表基因表达下调图1 热图

IVF-ET组与对照组胎盘绒毛组织中MAPK信号通路基因成员的差异表达情况,Up(红色)代表基因表达上调,Down(绿色)代表基因表达下调,X和Y轴分别以荧光信号强度为坐标轴,每一个点代表一个基因荧光信号强度图2 散点图

无监督聚类分析显示IVF-ET组与对照组胎盘绒毛组织中MAPK信号通路基因成员的差异表达,粉色代表IVF-ET组,绿色代表对照组图3 无监督聚类分析

基因基因编码基因名称基因生物过程基因细胞组份染色体定位表达倍数q值PLA2G12B231009_at磷脂酶A2,组XIIB脂质分解代谢过程细胞外区域chr10q22.112.280JUN201466_s_atJun原癌基因血管生成激活核染色体chr1p32-p319.690RPS6KA3226335_at核糖体蛋白S6激酶,90 kDa,多肽3骨架系统开发核chrXp22.2-p22.18.230ACVR1B213198_at活化素A受体,IB型有丝分裂细胞周期的G1/S转换质膜chr12q138.080FGF18231382_at成纤维细胞生长因子18骨化,血管生成细胞外区域chr5q346.860.01PRKACB202741_at蛋白激酶,cAMP依赖性,催化性β碳水化合物代谢过程,葡萄糖代谢过程核chr1p31.15.130RASGRP3205801_s_atRAS脒释放蛋白3(钙和DAG调节)MAPK级联细胞内,细胞质chr2p25.1-p24.14.500PLA2G4A210145_at磷脂酶A2,IVA组(胞质,钙依赖性)卵巢卵泡排卵,黄体分解膜分数chr1q254.080.01FGFR4204579_at成纤维细胞生长因子受体4器官诱导细胞外区域chr5q35.1-qter3.820.01PDGFRA203131_at血小板衍生的生长因子受体,α多肽黄体化核chr4q123.700.01CACNB2213714_at钙通道,电压依赖性,beta 2亚基运输质膜chr10p123.600RPS6KA2212912_at核糖体蛋白S6激酶,90 kDa,多肽2有丝分裂中期核chr6q273.570SOS1227426_at鸟苷酸交换因子1(果蝇)凋亡过程细胞内chr2p213.550STK41569791_at丝氨酸/苏氨酸激酶4细胞形态发生核chr20q11.2-q13.20.440.01GNG12212294_at鸟嘌呤核苷酸结合蛋白(G蛋白)γ12能量储备代谢过程异三聚体G蛋白复合物chr1p31.30.480MAPK9210570_x_at丝裂原活化蛋白激酶9MAPK级联核chr5q350.340DUSP16224832_at双特异性磷酸酶16MAPK活性的失活核chr12p130.440.01IL1R2211372_s_at白细胞介素1受体Ⅱ型免疫反应细胞外区域chr2q120.290MAP3K8235421_at丝裂原活化蛋白激酶激酶8MAPK级联细胞质chr10p11.230.290BRAF236402_atv-raf鼠肉瘤病毒致癌基因同系物B1MAPK级联膜分数chr7q340.390STK3211078_s_at丝氨酸/苏氨酸激酶3神经管形成核chr8q22.20.230HSPA2211538_s_at热休克70 kDa蛋白2对压力的回应细胞表面chr14q24.10.230HSPB1201841_s_at热休克27 kDa蛋白1血管生成蛋白酶体复合物chr7q11.230.210DUSP4204015_s_at双特异性磷酸酶4MAPK级联可溶性部分chr8p12-p110.170EGFR224999_at表皮生长因子受体MAPK级联高尔基膜chr7p120.240.01IL1R1215561_s_at白细胞介素1受体I型免疫反应细胞外区域chr2q120.310.01TGFB1203085_s_at转化生长因子β1蛋白质进入细胞核,易位细胞外区域chr19q13.10.140RASA1202677_atRAS p21蛋白激活剂(GTPase激活蛋白)1胞质分裂细胞内chr5q13.30.120RPS6KA5204635_at核糖体蛋白S6激酶,90 kDa多肽5细胞因子产生的负调控核chr14q31-q32.10.110GADD45G204121_at生长停滞和DNA损伤诱导的γ激活MAPKKK活性核chr9q22.1-q22.20.090PLA2G2A203649_s_at磷脂酶A2,IIA族(血小板,滑液)磷脂代谢过程细胞外区域chr1p350.070DUSP5209457_at双特异性磷酸酶5MAPK活性的失活核chr10q250.060
注:基因信息注释来源:http:∥www.ncbi.nlm.nih.gov/Genebank/;http:∥www.geneontology.org/;红色代表表达上调基因,绿色代表表达下调的基因
三、qRT-PCR验证胎盘MAPK信号通路部分基因成员mRNA的差异表达情况
采用qRT-PCR验证基因芯片检测结果,见图4。结果分别以GAPDH为对照,与对照组相比,来源于 IVF-ET组的胎盘绒毛组织中,JUN、PLA2G4A、PDGFRA和SOS1基因表达显著上调(P均<0.05),MAPK9、EGFR、TGFB1和GADD45G基因表达显著下调(P均<0.05),qRT-PCR结果和基因芯片的检测结果相一致,说明基因芯片的结果具有很高的可信度。

qRT-PCR验证表达基因芯片MAPK信号通路的8个基因 JUN、PLA2G4A、PDGFRA、SOS1、MAPK9、EGFR、TGFB1和GADD45G的表达。红色柱子显示上调基因 mRNA的表达,绿色柱子显示下调基因mRNA的表达,蓝色柱子显示对照组的基因mRNA的表达,相互比较,*P<0.05,**P<0.01图4 qRT-PCR比较IVF-ET组和对照组胎盘MAPK信号通路基因成员mRNA差异表达情况
四、IVF-ET技术影响胎盘滋养层细胞MAPK信号通路成员基因的表达
IVF-ET技术对胎盘滋养层细胞MAPK信号通路成员基因表达的影响。图5显示差异表达基因的名称以及在MAPK信号通路中的位置和相互调节关系。可见IVF-ET技术影响MAPK信号通路上游基因的表达,胎盘滋养层细胞通过基因差异表达的代偿作用,以基本保证MAPK信号通路行驶基本功能。

IVF-ET技术对胎盘滋养层细胞MAPK信号通路成员基因表达的影响,显示MAPK信号通路中基因表达的变化及所处的位置和相互调节关系,红色代表基因表达上调,绿色代表基因表达下调图5 辅助生殖技术对MAPK信号通路基因表达影响
讨 论
胎盘滋养细胞是妊娠过程中最活跃的细胞之一,其发育和侵袭过程受到时间和空间的严格精细调控[4],对其调节失控会导致各种疾病[5]。MAPK是人滋养层细胞内存在的一族丝氨酸/苏氨酸蛋白激酶[6]。各种MAPK通路完成不同的功能,传递细胞内复杂信号,最后表现为细胞的行为发生改变[7]。
本研究发现,IVF-ET胎盘滋养层细胞MAPK信号通路血小板衍生生长因子受体α多肽(PDGFRA)基因高表达。PDGFRA主要参与MAPK的蛋白激酶(ERK)信号通路,在表皮生长因子(EGF)和血小板生长因子(PDGF)的刺激下,调节滋养层细胞对生长因子、应激刺激、细菌产物和炎症介质的细胞反应[8],这表明IVF-ET技术本身存在应激、细菌感染和炎症介质等可能,相比较自然妊娠,IVF-ET一定程度激活MAPK的ERK信号通路。本研究中,IVF-ET胎盘滋养层细胞MAPK信号通路原癌基因(JUN)表达上调,见表3和图4,JUN主要参与MAPK的JNK信号通路,该信号通路主要被生长因子、脂多糖(LPS)、肿瘤坏死因子α(TNF-α)、白细胞介素1(IL-1)、紫外线、射线、热休克、细胞外高渗及DNA变性剂等激活[9]。IVF-ET来源的JUN高表达,显示MAPK的JNK信号通路激活,转而磷酸化转录因子C-JUN的氨基末端特定位点,C-JUN是序列特异性转录激活因子激活蛋白1(AP-1)的成分之一,磷酸化的C-JUN通过诱导同源或异源二聚体形成,与AP-1位点的顺式作用元件结合而启动某些效应基因的转录[10]。
本研究发现,IVF-ET胎盘滋养层细胞MAPK信号通路热休克蛋白1(HSPB1)和热休克蛋白2(HSPA2)低表达,见图1和表3。HSPB1和HSPA2主要参与MAPK的p38信号通路,热休克、紫外线照射、细菌成分、IL-3和促红细胞生成素(EPO)均能激活这条通路[11],p38主要散在分布滋养层细胞的胞浆,受到热休克等刺激后,p38被激活并转移到细胞核,能激活滋养层细胞内的转录因子激活转录因子2(ATF2)、C/EBP同源蛋白10(CHOP10)、肌细胞增强因子2C(MEF2C),通过转录因子磷酸化来调节滋养层细胞目的基因的转录表达是MAPK信号通路的重要功能[12]。p38还能激活滋养层细胞内的一些蛋白激酶,包括MAPK激活蛋白激酶2和3(MAPKAPK2和3)和p38调节/激活蛋白激酶2和3(PRAK)[13],这些丝氨酸/苏氨酸家族成员被磷酸化激活后,进一步激活低分子量热休克蛋白(HSP27),介导滋养层细胞骨架的重构,进而参与滋养层细胞的应激反应[14],p38亚族不同激酶可以转移到细胞内特定部位而发挥不同的调节功能。
IVF-ET胎盘滋养层细胞MAPK信号通路Hspb1和Hspa2表达下调,显示一种滋养层细胞保护性代偿,代偿过度表达MAPK信号通路刺激因子。本研究中也发现,IVF-ET胎盘滋养层细胞MAPK信号通路生长阻滞和DNA损伤基因(GADD45a)表达下调,见图1、图4和表3。GADD45a不仅在滋养层细胞DNA损伤修复及细胞信号转导中起到级联桥梁作用,也是参与p38 MAPK和线粒体介导的重要凋亡诱导基因[15]。同时GADD45a通过p38 MAPK信号通路促进胎盘产生的活性分子溶性血管内皮生长因子受体-1(sFlt-1)和可溶性内皮(sEng)进入母血循环,导致母体血管内皮功能障碍和滋养层细胞功能异常[16]。先兆子痫患者胎盘滋养层细胞GADD45a高表达和孕妇血清sFlt-1、sEng水平具有相关性。IVF-ET胎盘滋养层细胞MAPK信号通路GADD45a表达下调显示一种保护性代偿机制,减少MAPK信号通路过度活化,如果胎盘滋养层细胞缺血、缺氧和损伤超过胎盘滋养层细胞自身代偿限度,则GADD45a表达上调,加重胎盘缺血缺氧从而产生更多sFlt-1、sEng,形成恶性循环导致先兆子痫发生[17]。
本研究发现,表皮生长因子受体(EGFR)基因表达下调,表皮生长因子(EGF)作为细胞外刺激信号通过MAPK信号通路调节金属蛋白酶(MMPs)和组织抑制剂(TIMPs)基因和蛋白表达,从而影响滋养层细胞的侵袭和血管重铸[18]。
ART相关的潜在表观遗传风险越来越受到关注。本文探讨IVF-ET来源早期胎盘滋养层细胞MAPK信号通路基因的表达,研究结果与ART相关不良妊娠结局与异常滋养细胞侵袭相关的假说相一致[19]。IVF-ET技术可能影响胎盘滋养层细胞发育和功能,大多数情况,胎盘滋养层细胞通过代偿作用来增加侵袭能力以及对炎症、细菌和损伤的修复能力以及调整细胞骨架适应渗透压和氧化应激,最终成功维持妊娠和正常胎儿发育[20]。同时,如果外界损伤过强,或者胎盘滋养层细胞代偿作用不堪重负,则导致不同程度的不良妊娠结局,包括流产、胎儿宫内发育迟缓和妊娠期高血压等[21]。我们对胎盘这种代偿机制和风险还不十分了解,胚胎可能留存妊娠期间表观遗传适应机制的痕迹,加剧成年期的代谢性疾病风险[22]。ART改变胎盘和胎儿生长的动力学可能与各种生物学途径中的修饰有关,目前调整胎盘代偿系统和完整网络仍然模糊[23]。本研究提供IVF-ET技术早期胎盘滋养层细胞MAPK信号通路基因表达变化、在通路中定位以及相互的调节关系,见图5,这有助于ART技术改善和安全性提高,以确保整个ART过程更加接近自然妊娠经过和结局。

