荧光寿命显微成像技术及应用的最新研究进展∗
刘雄波 林丹樱 吴茜茜 严伟 罗腾 杨志刚 屈军乐
(深圳大学光电工程学院,光电子器件与系统教育部/广东省重点实验室,深圳 518060)(2018年2月10日收到;2018年6月4日收到修改稿)
1 引 言
荧光显微成像技术可借助荧光标记来实现对样品的特异性成像,被广泛应用于生物医学研究等领域[1,2].荧光具有多个特征参量,包括光谱、强度、寿命、偏振等,都可用于产生图像对比度,其中通过测量荧光寿命形成图像的技术称为荧光寿命显微成像( fluorescence lifetime imaging microscopy,FLIM).FLIM技术不受激发光强度、探针浓度、光漂白等因素的影响[3,4],且能区分荧光光谱非常接近的不同荧光团[5−7],因此具有非常好的特异性和很高的灵敏度.此外,由于荧光分子的荧光寿命能十分灵敏地反映激发态分子与周围微环境的相互作用及能量转移,FLIM技术常被用来实现对微环境中许多生化参量的定量测量,如细胞中折射率、黏度、温度、pH值的分布和动力学变化等[4,6,7],这在生物医学研究中具有非常重要的意义.近年来,随着激光技术、探测器技术、超分辨成像等相关技术的快速发展[3,7],同时结合算法和荧光探针合成技术的进步,FLIM不仅在技术上得到了快速发展,而且被广泛地应用于生物医学和纳米材料等研究领域.本文介绍基于不同荧光寿命探测方法的FLIM成像技术的基本原理及特点,并在此基础上概述该技术及其应用的最新研究进展,最后对其发展前景进行展望.
2 FLIM的分类及其特点
如图1(a)所示,荧光分子受到激发光激发后,其电子吸收激发光光子能量由基态跃迁至激发态,随后经短暂的振动弛豫及内转换过程后回到基态并发出荧光光子.激发光撤销后,由于每个荧光分子处于激发态的时间长短不一,荧光物质作为一个整体,其荧光强度I呈指数衰减,当荧光强度衰减为初始强度I0的1/e时所用的时间称为荧光寿命τ(同时存在多个寿命组分时用τi表示,如图1(a)公式所示,其中ai表示各组分的占比),用于表征荧光分子在激发态的平均停留时间,与其由激发态返回基态的退激速率成反比,是荧光分子固有的一个特征参数,和绝对发光强度无关.由于荧光分子的退激过程很容易受到周围微环境变化的影响,因此通过测量荧光寿命能十分灵敏地对周围的微环境变化进行监测.FLIM技术根据寿命获取方式的不同分为频域法和时域法两类:频域法利用经过调制的连续光激发样品,通过检测荧光信号的振幅和相位变化来计算寿命;时域法采用高重复频率的超短脉冲激光激发样品,通过分析脉冲过后的荧光衰减曲线得到寿命信息.在时域法中,由于目前探测器的响应尚不能直接记录荧光衰减曲线,因此需要采取一些巧妙的间接探测方式,常用的有门控法、条纹相机法、时间相关单光子计数(time-correlated single photon counting,TCSPC)法等[8,9],如图1(b)—(e)所示.
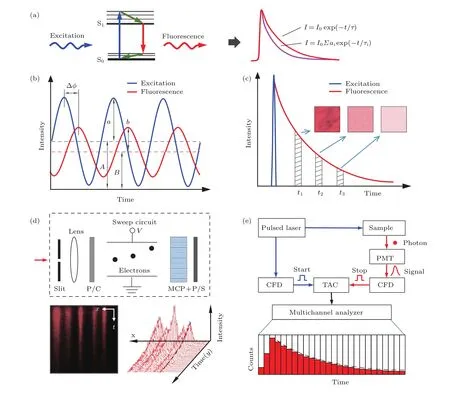
图1 荧光寿命基本原理及其测量方法示意图[8,9] (a)荧光发射及荧光强度衰减曲线示意图(单组分、多组分);(b)频域法;(c)门控法(单组分);(d)条纹相机法;(e)TCSPC法Fig.1.Basic principle of fluorescence lifetime and schematic diagrams of lifetime measurement methods[8,9]:(a)Schematic diagrams of fluorescence emission and fluorescence intensity decay curves(single component and multicomponent);(b)frequency domain method;(c)gated image method(single component);(d)streak camera method;(e)TCSPC method.
2.1 频域法
频域法测量荧光寿命最早是由日本大阪大学提出的[10],其基本原理是采用强度按正弦调制的激发光激发样品,产生的荧光信号频率与激发光相同,但幅值下降、相位滞后,如图1(b)所示,可通过两者的振幅比(M=(b/B)/(a/A))和相位差(Δϕ)计算样品的荧光寿命(τΔϕ=(1/ω)tanΔϕ,τM=(1/ω)[1/(M2−1)]1/2,ω为调制频率)[4].对于单组分,有τΔϕ=τM[6,7].频域法的优点是原理简单,对设备要求不高,相比时域法成本低.但由于荧光寿命一般与调制频率成反比,测量不同荧光寿命的样品需要选择不同的调制频率,因此通常需要采用调制频率连续可调的激光源.另一方面,频域法理论上可以分辨多组分样品的荧光寿命,但实际操作时通常需要预先采用荧光寿命已知的样品对系统进行标定,才能确保测量的准确性,同时还要预估样品中荧光组分的数量,再对各组分逐一进行测量,因此测量过程较为复杂繁琐,成像速度受到限制.相比采用扫描成像方式的频域FLIM,宽场频域FLIM成像速度相对较快,但离焦背景荧光和散射光的影响使得图像对比度较差,成像深度受限[11].
2.2 门控法
时域法采用脉冲激光激发样品,相比频域法的高强度连续激光照射,对样品的光损伤更小.当样品的荧光强度呈单指数衰减时,可采用门控法测量其荧光寿命.如图1(c)所示,门控法的基本原理是采用具有时间分辨能力的探测器记录不同“时间门”处的光强来计算或拟合寿命.常用的探测器为像增强型电荷耦合器件(intensi fied charge-coupled device).由于门控法采用宽场成像方式,且对于单组分荧光寿命的测量理论上仅需探测两个不同时刻的荧光强度[12],因而门控法FLIM在各种方法中成像速度是最快的.但门控法对系统同步及探测器的灵敏度要求非常高,且通常在单次时间门内光子利用率较低,采集的荧光信号较弱,同时宽场成像方式由于成像对比度较差,得到的荧光寿命值精度不高[8].此外,在获取多组分荧光寿命时,门控法需要多个时间门,且分析较为复杂,因此应用相对较少.
2.3 条纹相机法
如图1(d)所示,条纹相机法的基本原理是利用条纹相机(streak camera,也称扫描相机)中扫描电场的加速使不同时间到达的光电子在空间上分开,从而将时间分布转化为空间分布以获取荧光衰减信息[13].由于相机的一个空间维度被用于显示时间分布,因此激发样品时一般需要利用柱透镜或振镜的一维扫描对样品进行线照明,再通过垂直方向的扫描实现二维成像.这种方法的时间分辨率较高,但动态范围通常较窄,且由于成像时需要至少一维扫描,又受到条纹相机积分时间及读出速度等参数的限制,因而成像速度较慢[5,9].
2.4 TCSPC法
TCSPC法是目前测量荧光寿命时间分辨率最高、应用最广泛的技术.如图1(e)所示,TCSPC法的基本原理是记录激发脉冲过后首个荧光光子到达探测器的时间并进行计数,多次重复建立一个正比于荧光衰减曲线的光子数-时间分布直方图,用于拟合荧光寿命.由于需要探测单光子信号,TCSPC-FLIM一般采用高灵敏度光电倍增管(photomultiplier tube,PMT)或雪崩光电二极管(avalanche photodiode,APD)作为探测器,因此通常建立在激光扫描共聚焦显微镜(laser scanning confocal microscope,LSCM)或双光子激发荧光显微镜(two-photon excitation fluorescence microscope,TPEFM)上,通过逐点扫描来成像.基于统计分析的TCSPC法避免了荧光强度的直接测量,因而信噪比高,探测效率近乎理想.但为了获取准确的计数,每个激发周期内产生荧光光子的概率要很低(一般为1%左右),而每个像素点拟合出一条信噪比较好的衰减曲线至少需要上千光子数,这就导致成像速度通常较慢.此外,由于TCSPC技术测量荧光寿命的精度很高,因此对硬件设备要求也较高,如需要能输出超短脉冲的飞秒激光器,高探测效率、响应性能非常好的探测器等.
3 FLIM成像性能的提升
近年来随着激光器、探测器等相关技术的快速发展,FLIM技术在成像性能方面的大幅度提升成为该领域的研究热点.针对前面提到的不同荧光寿命探测方法的优缺点,成像性能的提升主要体现在FLIM成像速度、荧光寿命测量精度、以及成像质量和空间分辨率三个方面的提升,以下分别进行阐述.
3.1 FLIM成像速度的提升
成像速度的提升可以说是各种荧光显微成像技术应用于活细胞成像时的共同追求.如前所述,除门控法外,其他FLIM技术基本上都存在成像速度较慢的问题.例如,目前应用最广泛的TCSPCFLIM由于需要扫描,而且通常需要多次重复扫描来为每个像素采集足够多的光子用于拟合荧光寿命,因此成像速度较慢,一定程度上限制了其在活细胞内分子间相互作用、信号传导等瞬态过程研究中的应用.通过改善硬件性能可一定程度上提升TCSPC-FLIM的成像速度,如Orthaus-Mueller等[14]采用超短死区时间的TCSPC模块和混合型PMT的组合提高了单个激发周期的探测效率,实现了成像速度的提升,从而在对水溶液中扩散的荧光珠进行成像时获得了3帧/s的成像速度(图像大小为128 pixel×128 pixel,如图2(a)所示).
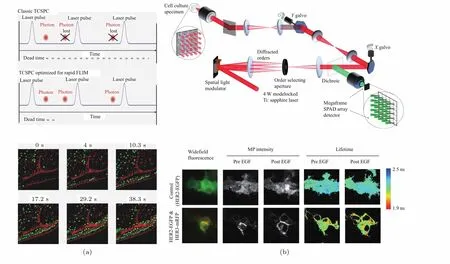
图2 FLIM成像速度的提升 (a)采用超短死时间TCSPC硬件实现水溶液中扩散荧光珠的动态FLIM成像(128 pixel×128 pixel,3帧/s)[14];(b)采用多焦点多光子激发SPAD阵列技术获取活细胞内蛋白质相互作用的FLIM图像(256 pixel×256 pixel,15 s/帧)[21]Fig.2.Improvement in FLIM imaging speed:(a)Dynamic FLIM imaging of diffuse fluorescent beads in aqueous solution(128 pixel×128 pixel,3 fps)with ultra-short dead time TCSPC hardware[14];(b)FLIM images of live intracellular protein interactions using multi-focus multiphoton excitation SPAD array technology(256 pixel×256 pixel,15 s/frame)[21].
相比扫描方式,宽场成像可显著提升成像速度,而近几年快速发展起来的单光子雪崩二极管(single photon avalanche diode,SPAD)阵列与TCSPC的结合为实现宽场TCSPC-FLIM提供了可能[15,16].SPAD增益高、响应速度快,具有单光子探测能力,且可基于标准互补金属氧化物半导体工艺生产,既能实现阵列集成,又能方便地将TCSPC电路整合到每个像元中,从而实现宽场TCSPC-FLIM成像.哥伦比亚大学Shepard等[17]集成了64×64个SPAD及时间-数字转换器(time-to-digital converter,TDC)模块,理论分析与模拟表明采用该探测器可使FLIM成像速度达到100帧/s.不过目前由于SPAD阵列传感器的像元尺寸过大,填充率偏低[18,19],用于宽场TCSPCFLIM时还存在分辨率不高等问题,因此尚处于初始发展阶段.而且随着SPAD阵列传感器像素数目的增加,宽场TCSPC-FLIM需要读取的数据量会急剧增大,这对计算机运行速度也提出了挑战.针对这一问题,天津大学Xu等[20]提出基于事件驱动读出的SPAD传感器技术,通过仅读出有效的时间与位置信息减小数据量来提升成像速度.Poland等[21]则结合SPAD阵列和多焦点多光子激发TCSPC-FLIM技术,既获得了与LSCM-FLIM相当的空间分辨率,又进一步提升了成像速度,实现了对活细胞中蛋白质相互作用过程的FLIM成像(如图2(b)所示).
除了将扫描变成宽场成像,对扫描方式加以改进也是提升成像速度的一种有效途径.传统的扫描一般采用振镜,扫描方式为栅扫描.深圳大学屈军乐课题组搭建的基于条纹相机的双光子激发FLIM系统中采用高速振镜扫描实现了二维FLIM成像,获得了50 ps左右的时间分辨率,并使图像获取时间显著缩短[22].而对于大多数生物样品而言,视场中往往只有部分感兴趣区域.假如扫描时可跳过感兴趣区域以外的像素,直接针对视野中的若干感兴趣区域扫描,则可节省大量时间,提升成像速度.该课题组根据这一思路发展了一种基于声光偏转器(acousto-optic de flector,AOD)寻址扫描的AOD-FLIM技术[23],通过减少有效扫描面积缩短采集时间,从而达到大幅提升成像速度的目的.结合单粒子定位和反馈控制,他们还进一步发展了可用于运动粒子FLIM成像和追踪的单粒子定位FLIM技术[24],在活细胞内运动目标的荧光寿命探测方面具有一定的应用前景.
通过拟合算法的改进来降低荧光衰减曲线拟合对光子数的要求也是提升时域FLIM成像速度的一种思路.传统的荧光衰减曲线拟合通常采用最小二乘法(least-squares,LS),该算法原理简单,但要求获取足够多的光子数用于曲线拟合,延长采集时间可增加光子数,但是降低了成像速度.采用极大似然估计(maximum likelihood estimate,MLE)算法拟合数据可一定程度上降低对光子数的要求,进而可一定程度地提升成像速度[25,26].近几年提出的相量分析法则无需拟合寿命曲线,而是通过将各像素点的荧光衰减信息直接变换到相量图(phasor plot)上对应的点来获取寿命信息.该方法不仅简化了数据分析,而且可以方便地实现单组分与多组分指数分布的区分,但目前测量精度还有待提升[5,11,27,28].Lakner等[29]在研究直肠癌3D细胞模型时对比分析了相量分析法及传统的多指数拟合方法,结果表明前者在量化分析时需要较少的初始假设,更加简便快速.Marois等[30]提出基于泊松统计的降噪主成因分析(noise-corrected principal component analysis,NCPCA)算法,用于校正时域FLIM数据存在的误差噪声,该方法可以更低的光子计数来检测微环境的分布,速度快,在确定组分数量时所需光子数比相量分析法还要少,且不需要事先知道组分数量或荧光分子的衰减动力学常数.
3.2 荧光寿命测量精度的提升
在保证快速FLIM成像的基础上,如何实现荧光寿命的准确测量也是关键问题.其中荧光寿命测量精度可从硬件与软件两方面进行改善.近年来,随着超快激光器、高灵敏度探测器的快速发展,硬件性能及光路质量得到了大幅提升,系统噪声可以更低,信号采集效率可以更高,图像信噪比提高,因此荧光寿命测量精度也有所提升.但是通过硬件提升寿命测量精度的效果始终有限,且成本较高[31].因而许多科研人员转而通过算法来加以改进,即解决在较低信噪比或较少光子数前提下如何保证寿命计算精度的问题.最简单的做法是运用图像处理算法对获得的信噪比较差的荧光寿命图像先进行预处理,如天津理工大学的邵永鑫[32]先采用小波变换算法去噪,再结合遗传算法(genetic algorithm,GA)、反向传播(back propagation,BP)算法进行小波神经网络学习,从而提高荧光寿命测量的准确性.中国科学院大学刘超[33]同时对双门控探测的快速寿命算法(rapid lifetime determination,RLD)及多门控探测的LS拟合算法进行了对比研究,结果表明前者成像速度快但测量精度差,后者则恰好相反,两者在生物医学应用中可适用于不同场合.此外他们还对基于列文伯格-马克夸特(Levenberg-Marquardt,L-M)的高精度荧光寿命算法展开了研究,发现该算法比RLD和普通的LS具有更好的拟合精度,且能适用不同的仪器响应函数(instrument response function,IRF)模型[34].
针对TCSPC-FLIM,前面提到的MLE算法拟合可以降低对拟合光子数的要求,在提升成像速度的同时保证了测量精度[25,26].华中科技大学曾绍群课题组[31]对一阶矩(the first moment,M1)法与传统的LS进行了比较,结果发现在寿命较短且光子数较少的情况下,M1法更具优势.牛津大学Rowley等[35]提出采用贝叶斯方法(Bayesian analysis,BA)来分析指数衰减数据,并以较高的精度对TCSPC系统进行建模,再对单指数与双指数模型进行数据分析,相比上述的LS与MLE算法,其准确度提升了两倍.韩国Yang等[36]还将压缩感知(compressed sensing,CS)算法用于荧光寿命数据分析,提高了对稀疏分布的多组分荧光寿命值估计的准确性.这几种适合低光子数情形的荧光寿命拟合算法的简单比较如表1所列.
改善解卷积算法也可以一定程度上提升寿命测量精度.如Zhang和Li[37]通过理论分析和模拟对最小方差拉盖尔算法(least-squares deconvolution with Laguerre expansion,LSD-LE)进行了修正,提出在评估解卷积的性能时应考虑泊松噪声而非高斯噪声.西安理工大学华灯鑫等[38]采用改进的向前迭代解卷积算法反演出叶绿素的荧光寿命,获得了比传统迭代解卷积算法更高的精度.但这些解卷积算法一般需要先确定准确的IRF,因此这又涉及到IRF的精确测量.华东师范大学潘海峰等[39]以饱和碘化钠溶液猝灭后的荧光素作为样品,发展了一种精确测量TCSPC系统IRF的方法,从而提高荧光寿命测量的准确性.Gao和Li[40]则采用扩展卡曼滤波(extended Kalman filter,EKF)算法,同时估计出TCSPC-FLIM系统测量的荧光寿命和IRF,避免了对IRF的直接测量,同时该方法还具有对测量时间窗不敏感、测量动态范围大的优势.
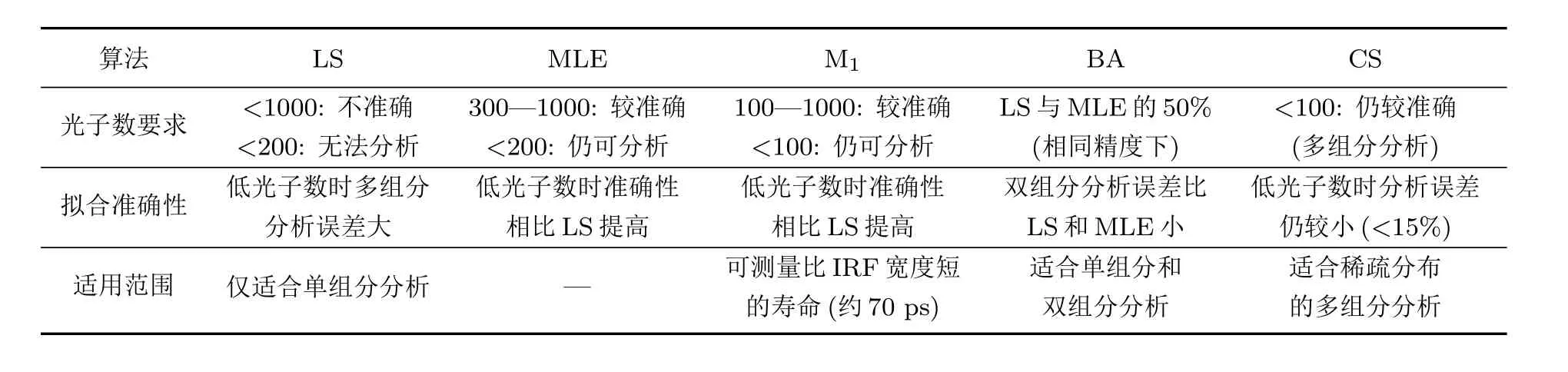
表1 低光子数情形下几种荧光寿命拟合算法的比较[25,26,31,35,36]Table 1.Comparison of several fluorescence lifetime fitting methods with low photon numbers[25,26,31,35,36].
3.3 成像质量和空间分辨率的提升
传统FLIM技术由于光学衍射极限的存在,其成像的空间分辨率被限制在横向250 nm左右、轴向500 nm左右.结合近几年来快速发展的超分辨成像等先进技术,FLIM的成像质量和空间分辨率得到了大幅提升.
通过引入自适应光学技术进行像差校正,可大幅提升FLIM的成像质量.例如,Feeks和Hunter[41]在利用双光子激发FLIM对小鼠视网膜细胞进行成像以研究视网膜退化过程的工作中,通过引入自适应光学技术校正小鼠眼球引起的像差,同时实现了横向与轴向的紧聚焦,抑制了背景噪声及散射光,实现了对单个细胞的分辨,进而将这种方法运用到临床医学的检眼镜检查法中,用于对视网膜细胞的健康状况进行评价.
此外,针对前面提到的宽场FLIM受离焦信号影响,轴向分辨率和成像深度均较差的问题,Hinsdale等[42]尝试将门控FLIM与结构光照明显微术(structured illumination microscopy,SIM)结合,Greger等[43]尝试将宽场频域FLIM与单面照明显微术(single plane illumination microscopy,SPIM)结合,从而使宽场FLIM也具备“光学层析”能力,实现了厚样品的FLIM成像.
FLIM空间分辨率的大幅提升则主要是通过将已有的FLIM成像方法与超分辨成像技术结合来实现的,其中目前研究较多的是利用受激辐射耗尽(stimulated emission depletion,STED)技术来实现超分辨FLIM成像.例如,英国伦敦帝国理工学院French等[44,45]将STED与TCSPC-FLIM技术结合,通过将扫描光斑大小控制在100 nm以内获得了超衍射极限的FLIM图像,结果如图3(a)所示.在该工作中,他们还利用基于空间光调制器(spatial light modulator)的数字全息术对STED光束进行相位调控,实现对其轮廓的整形和像差补偿,在提升横向分辨率的同时,大幅提升了轴向分辨率(由685 nm提升到362 nm)[46].浙江大学刘旭课题组采用连续光作为STED光,TCSPC技术测量荧光寿命,结合纳米定位台对样品进行扫描,实现了STED-FLIM成像,成像分辨率达到了70 nm(如图3(b)所示)[47].深圳大学屈军乐课题组将STED-FLIM技术与自适应光学技术相结合,用于改善STED光的成像质量并校正由厚样品散射引起的像差,进一步提升了成像分辨率[48,49].此外,French等[50]还将SIM与FLIM相结合,用于对胶原蛋白活化后COS细胞中DDR1受体低聚化的FRET过程进行研究.
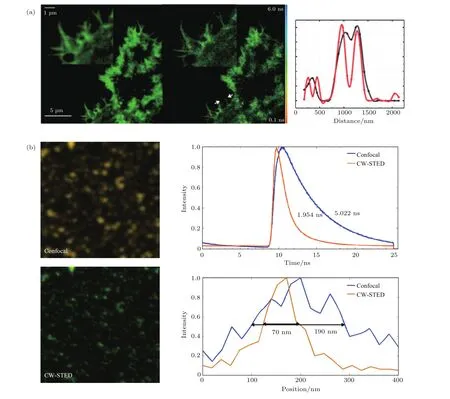
图3 结合STED超分辨技术实现FLIM空间分辨率的提升 (a)ATTO 647 N标记的NK细胞的STED-FLIM超分辨荧光寿命图像(分辨率60 nm)[44];(b)直径20 nm荧光珠的CW-STED与共聚焦荧光寿命图像的对比(分辨率70 nm)[47]Fig.3.Improvement in FLIM spatial resolution by combining with STED super resolution imaging:(a)STED-FLIM super resolution fluorescence lifetime image of ATTO 647 N labeled NK cells(resolution 60 nm)[44];(b)CW-STED vs.confocal fluorescence lifetime image of 20 nm diameter fluorescent beads(resolution 70 nm)[47].
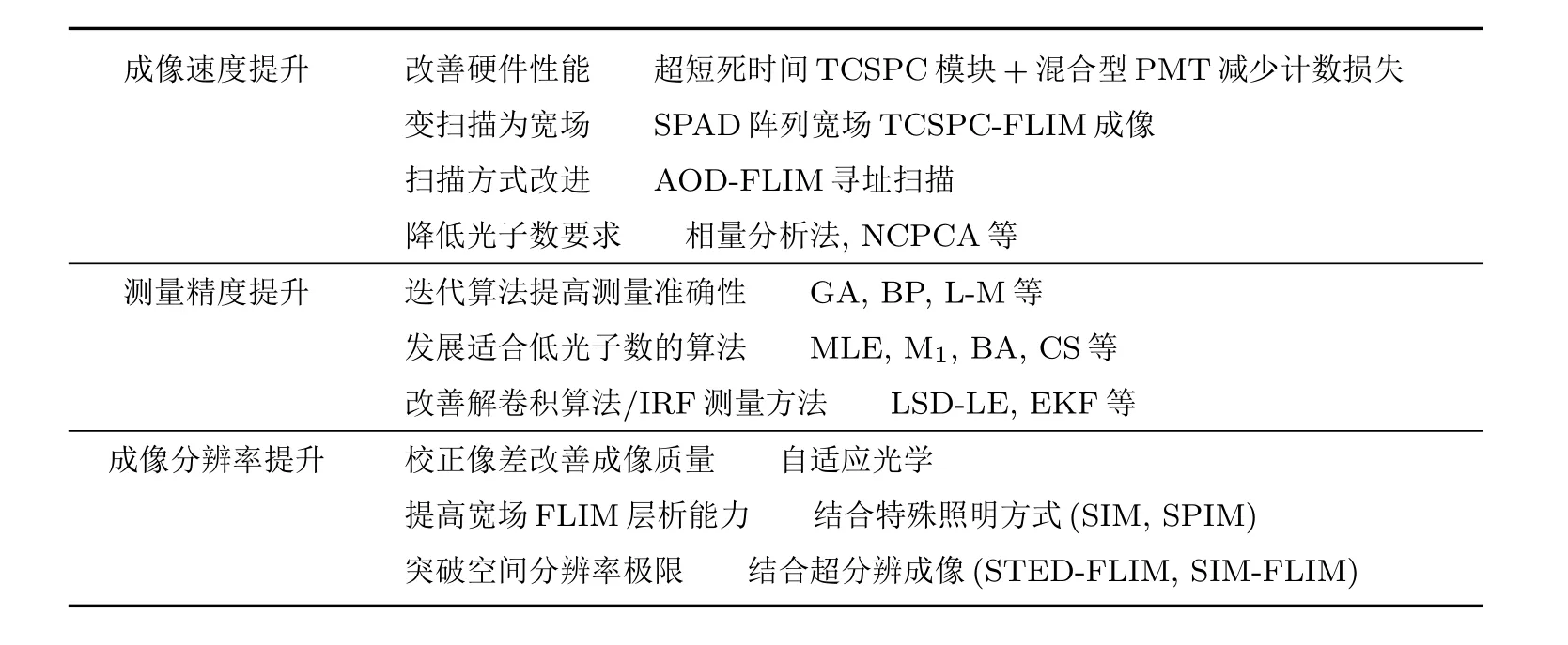
表2 FLIM成像性能提升的最新研究进展Table 2.Recent progress on improving FLIM imaging performance.
综上,FLIM成像性能提升的最新进展总结于表2.
4 FLIM技术在生物医学领域的应用研究
如前所述,FLIM除了具备一般荧光显微成像的高特异性、高灵敏度等特点,还具有对微环境变化敏感、可定量测量等独特的优势,因此近二十年来已在各领域得到较为广泛的应用,尤其是在生物医学基础研究、疾病诊断与治疗研究,以及纳米材料的生物医学应用研究等方面,近年来FLIM的应用已取得许多利用传统的研究手段无法获取的数据,从而为这些领域的快速发展助力.
4.1 FLIM在生物医学基础研究中的应用
尽管近几十年来生物医学研究已经取得了巨大的发展,人们对于细胞行为及其机理的研究已经越来越深入细致,但仍然有许多重要问题需要继续寻求答案,例如目前关于细胞生理代谢过程机理、信号转导通路和机理、植物细胞光合作用机理等的研究仍然是细胞生物学研究中的热点问题.FLIM可用于定量监测细胞中微环境变化的优势恰好为这些问题的研究提供了一种很好的手段.例如,最近美国Walsh等[51]利用一种寿命对钙离子浓度非常敏感的荧光探针(Oregon Green BAPTA-1)对小鼠海马体神经元进行FLIM成像,实时观察了神经元在光刺激前后钙离子浓度的变化,并发现利用近红外脉冲光照射时可引起神经元细胞内钙含量的显著增加,如图4(a)所示.French课题组[46]则运用FLIM技术研究了肌肉纤维的肌节分子结构及免疫突触信号的传导过程.为了便于对大量采集数据的分析与整理,他们还将FLIM技术与高内涵细胞成像分析技术(high content analysis,HCA)结合,实现了FLIM的全自动成像,并基于荧光共振能量转移( fluorescence resonance energy transfer,FRET)对蛋白质之间的相互作用进行分析[52,53].结合了HCA的FLIM成像设备使得我们可以从大量的FLIM图像中自动筛选出有价值的数据,这在发现化学药物、研究细胞分子相互作用中将发挥重要的作用.
在植物细胞生物学研究方面,2016年中国科学院田文明等[54]采用基于LSCM的FLIM技术,研究了光合系统的能量II传递机理,从而获取了光合色素在光合作用中传递能量的速率信息.荷兰Blilou等[55]在发表于《Nature》的工作中,利用FRET-FLIM技术实现了植物体内蛋白质相互作用的可视化研究,从而深入揭示了根尖细胞发育的分子机理(如图4(b)所示).日本Kodama[56]利用FLIM技术获得了荧光蛋白标记的向光素(一种位于叶绿体外围的蓝光感受器)的清晰图像.FLIM在植物细胞研究中的应用难点之一就是植物内叶绿体自发荧光的干扰,因为在传统FLIM成像条件下仅通过采用合适的发射波长与激发波长是很难完全消除叶绿体的自体荧光影响的.该课题组利用叶绿体自体荧光寿命较短(仅为ps量级)的特点,采用简单的时间延迟门控成像技术来消除它们的影响.Camborde等[57]采用具有高时间分辨率的条纹相机探测FLIM图像,并通过减小扫描视场缩短采集时间,从而结合FRET技术检测了植物叶片中核酸与蛋白质的相互作用.
4.2 FLIM在疾病诊断与治疗方面的应用
利用FLIM技术对临床上一些典型疾病进行诊断及治疗的研究也是近年来的一个前沿研究热点.研究者们通常采用动物自体荧光寿命来研究体内细胞的代谢状况,从而引导临床上的疾病诊断与治疗.Robert等[58]对患有黑色素瘤小鼠的单层上皮细胞进行多光子FLIM成像,通过细胞内的内源性荧光物质辅酶烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NADH)在游离态和结合态的含量比率来实现成像,从而监测肿瘤的动态发展进程.结果发现,在肿瘤成长过程中,该比率会显著增大,但NADH自身长/短寿命组分的比例则基本保持不变.该工作表明,FLIM技术可以非侵入式、高灵敏、快速地反映黑色素瘤的发展进程,将在诊断及治疗黑色素瘤中发挥重要作用.此外,由于NAD(P)H、黄素腺嘌呤二核苷酸( flavin adenine dinucleotide,FAD)、色氨酸(tryptophan,Trp)等内源性荧光物质及NAD(P)H与FAD的氧化还原比例能反映活细胞或组织内的代谢状况,利用FLIM技术监测这些生化参数的变化还能用于实时反映抗癌药物的治疗效果.Alam等[59,60]利用三通道多光子TCSPC-FLIM技术,获取了运用抗癌药物治疗前后前列腺癌细胞内这几种物质的荧光寿命,结果表明治疗后它们的平均荧光寿命增加,且NAD(P)H,FAD的氧化还原比例下降,从而反映了抗癌药物的治疗效果(如图5(a)所示).在此基础上,他们又运用FRET-FLIM技术研究了前列腺癌细胞内Trp的构造变化与Trp-NADH相互作用之间的关系.而Shirmanova等[61]则利用FLIM技术研究了培养的癌细胞或动物体内肿瘤在自然生长和化学治疗两种情况下的生物能量代谢及微观黏度变化,通过NADPH自体荧光寿命的测量发现了治疗后癌细胞的游离态NADPH相对含量减小,且质膜黏滞度显著增大.哥伦比亚大学Kaminski等[62]利用荧光染料的自猝灭效应可影响其自身荧光寿命从而反映淀粉状蛋白结构的性质(如图5(b)所示),发展了一种可反映淀粉状蛋白聚集状态的FLIM传感器,该传感器动态范围宽,测量时对蛋白质聚集过程不会产生干扰,且能高通量、定量地反映淀粉类蛋白的聚集状态.在此基础上他们采用SIM-FLIM技术对阿尔茨海默病(Alzheimer’s disease,AD)相关蛋白τ的K18蛋白片段及与亨廷顿氏病(Huntington’s disease,HD)相关的聚谷氨酰胺蛋白进行了研究,对诊断和治疗临床上的神经退化疾病具有较大意义.
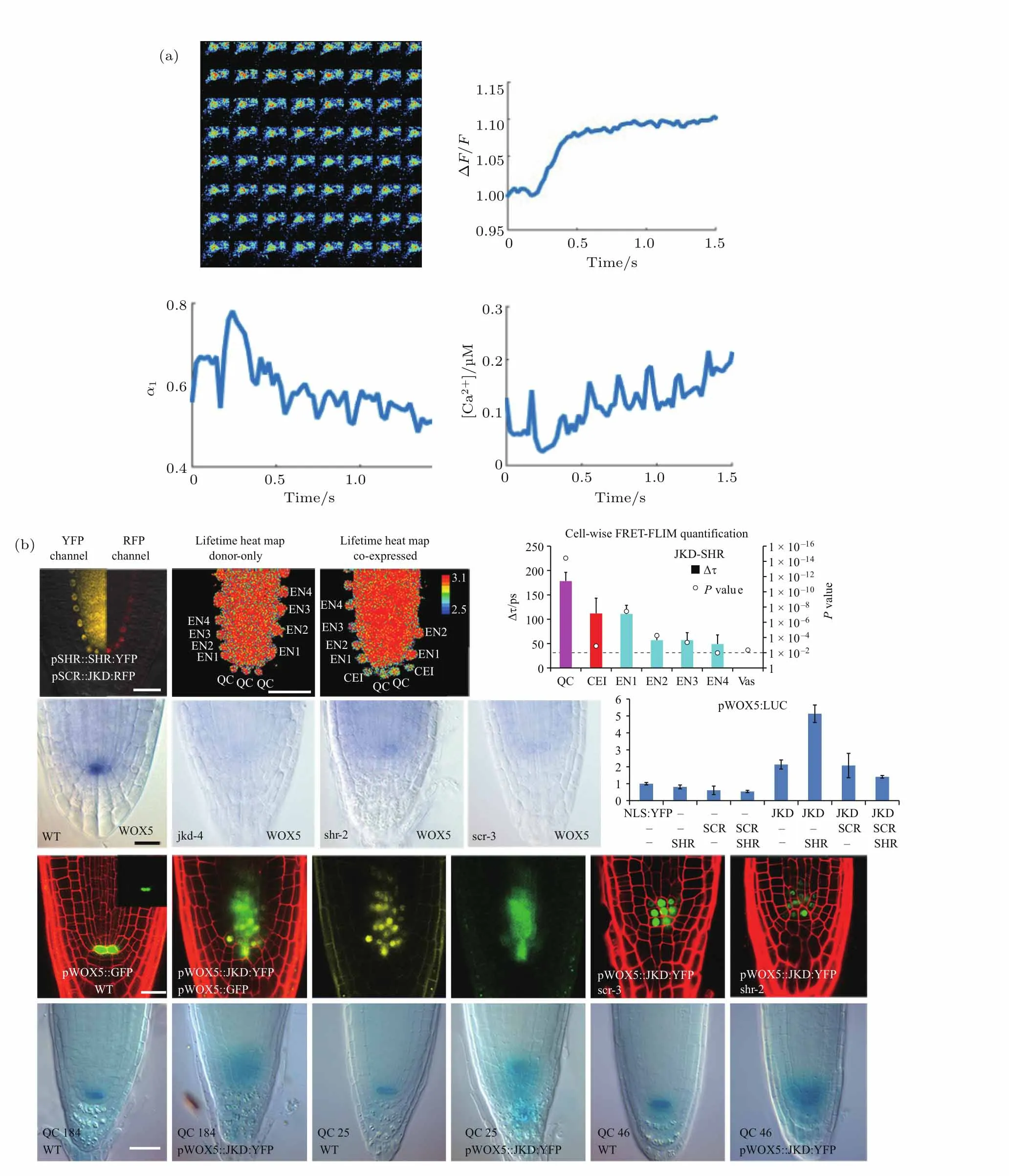
图4 FLIM在生物医学基础研究中的应用 (a)FLIM用于钙离子浓度变化的定量监测[51];(b)FLIM结合FRET用于分析拟南芥根尖细胞发育机理[55]Fig.4.Applications of FLIM in basic biomedical research:(a)FLIM applied for quantitative monitoring of calcium ion concentration[51];(b)FLIM combined with FRET for analyzing the development mechanism of Arabidopsis root tip cells[55].
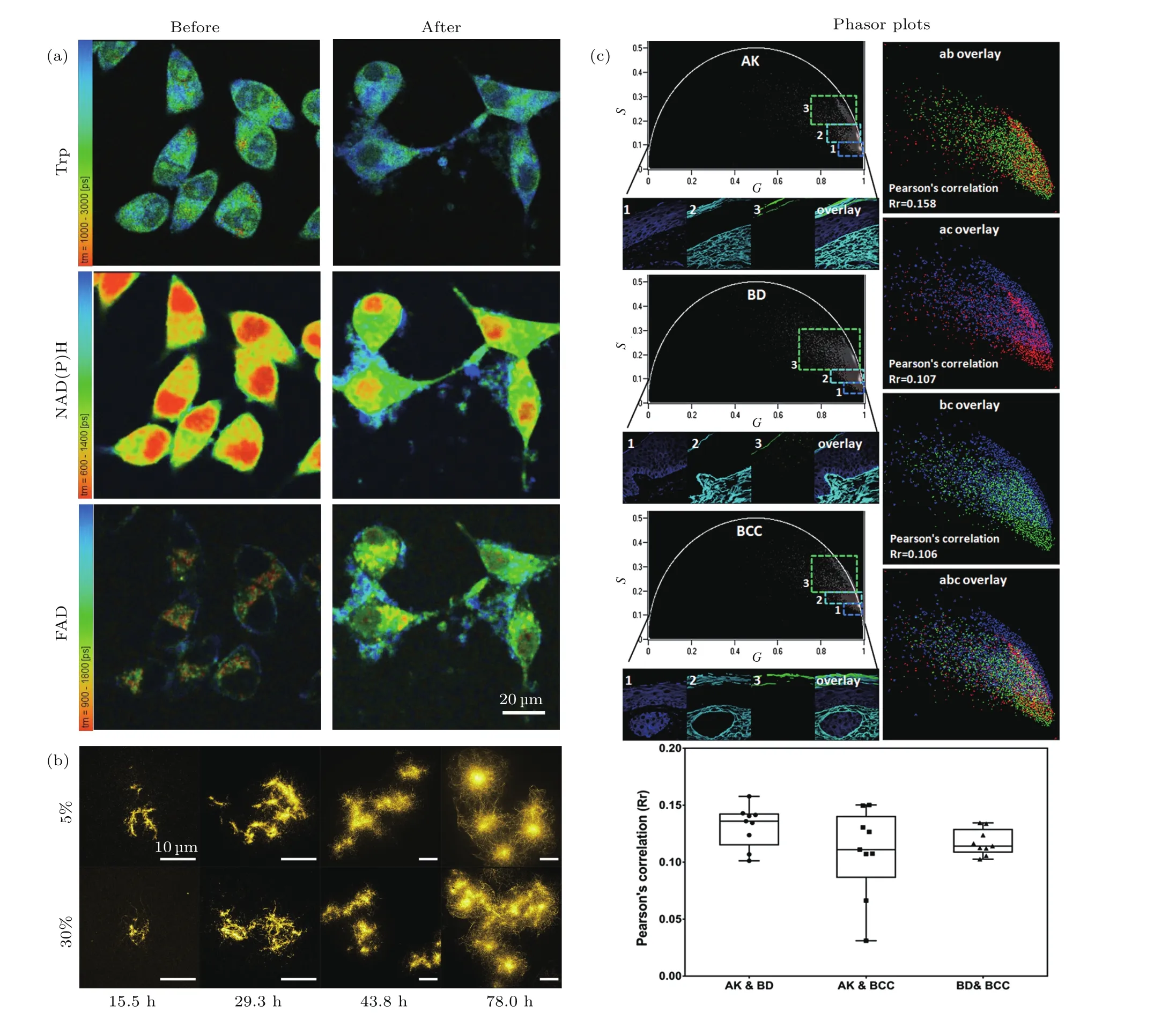
图5 FLIM在疾病诊断与治疗方面的应用 (a)前列腺癌细胞中Trp,NAD(P)H,FAD在治疗前后的平均寿命变化监测[60];(b)不同标记比例和孵育时间下K18-Atto532淀粉状蛋白在体内的聚集状态[62];(c)phasor-FLIM用于区分AK,BD,BCC等不同的皮肤疾病[66]Fig.5.Applications of FLIM in diagnosis and treatment of diseases:(a)Monitoring changes of the mean lifetime of Trp,NAD(P)H,and FAD in prostate cancer cells before and after treatment[60];(b)aggregation of K18-Atto532 amyloid in vivo at different labeling ratios and incubation times[62];(c)phasor-FLIM applied for differentiating different skin diseases such as AK,BD and BCC[66].
在国内也有多个课题组在开展FLIM技术的疾病诊疗研究.华东师范大学田阳等合成了一种具有高特异性、高双光子吸收截面和低毒性的新型锌离子荧光比率探针,并用于活细胞内锌离子的FLIM成像,结果发现相比正常小鼠,患AD的小鼠其海马组织中的锌离子浓度要更高[63].上海理工大学宋成利等[64]对比分析了正常鼻咽及癌变组织中自体荧光寿命,并研究了生理盐水及组织自身光学特性对荧光寿命测量的影响.南京中医药大学金路[65]运用多光子激发FLIM技术研究了大鼠病理状态下肝脏的形态学结构及代谢情况,对临床上脂肪肝的检测与治疗具有重要的参考意义.深圳大学Luo等[66]对苏木精伊红(hematoxylin and eosin)染色的病理切片进行双光子FLIM成像,并通过引入相量分析法对荧光寿命进行分区和筛选,发展了一种可区分基底细胞癌(basal cell carcinoma,BCC)、光化性角化病(actinic keratosis,AK)和博文病(Bowen disease,BD)等不同皮肤疾病的方法,显著提高了诊断的准确性,为组织病理学分析提供了一种简单可行的新方法(如图5(c)所示).
4.3 FLIM在纳米材料生物医学研究中的应用
随着纳米技术的快速发展,应用于生物医学成像的新型纳米材料也在不断涌现.目前常见的新型纳米材料有上转换材料、量子点(quantum dot,QD)、碳量子点、金纳米颗粒及其他纳米颗粒[67].纳米材料的制备和应用是一个非常活跃的研究领域,上述的纳米材料一般都具有较好的光学性质,但具体应用于生物医学成像和研究中则还有诸多问题和未知效应需要研究和探索.例如量子点的光稳定性较好,不易漂白,但由于具有微毒性,其生物安全性一直备受争议.基于这些纳米材料独特的光学性质,FLIM为纳米材料在生物医学中的应用研究提供了一种新的思路.例如,英国爱丁堡大学Giraud等[68]利用FLIM技术研究了QD标记在DNA杂交事件检测中的应用,并通过时间门控探测将QD的微阵列寿命图像对比度提高了1.8倍,从而达到飞摩尔的靶向灵敏度.澳大利亚昆士兰大学Lin等[69]与德国BH公司Becker合作,采用TCSPCFLIM技术对注射了氧化锌纳米颗粒的志愿者皮肤进行了FLIM成像并研究其代谢状态,从而为该纳米粒子在皮肤中的渗透和生物效应研究发展了一种非侵入性的成像和检测手段.德国Chen等[70]制备了两种类型的脱镁叶绿酸-HSA(Pheo-HSA)纳米颗粒,并利用LSCM-FLIM对它们在细胞内的药物释放过程进行研究,从而得出这种纳米粒子可作为光动力治疗(photodynamic therapy)药物载体的结论.深圳大学Luo等[71]利用基于相量分析的FLIM技术对合成的聚合物纳米粒子PAHCit/多柔比星(doxorubicin,DOX)的药物释放过程进行成像,通过监测细胞间质中DOX荧光寿命的动态变化来评估纳米载体的药物释放效率.吉林大学Zhang等[72,73]将双光子激发FRET-FLIM技术与表面等离子体激元共振技术结合,利用增强型的能量转移发展了一种可以监测金纳米颗粒在活细胞内的内吞过程的新方法,这对于研究体内和体外的生物成像传感及单分子追踪都有很大帮助.
5 总结与展望
荧光显微成像具有高特异性、高灵敏度等特点,在生物医学等领域有着广泛的应用,其中利用荧光分子的寿命进行成像的FLIM技术更是由于具有能定量反映微环境参数分布和变化的独特优势而成为一种重要的研究工具.FLIM技术分为频域法和时域法两类,其中时域法又有门控法、条纹相机法和TCSPC法等.TCSPC-FLIM因同时具有高时间分辨率、高信噪比、宽动态范围和不受激发光强度波动等因素影响等优点而成为目前应用最广泛的FLIM技术.近年来FLIM技术的发展主要侧重于成像性能的提升和应用范围的拓宽这两方面.TCSPC模块和PMT性能的进一步改善、AOD寻址扫描方式的应用一定程度上提升了FLIM的成像速度,而SPAD阵列的发展及其与TCSPC结合发展起来的宽场TCSPC-FLIM则有望大幅提升成像速度;寿命拟合算法和解卷积算法的改进有利于在快速FLIM成像的前提下进一步提升寿命测量的精度;基于自适应光学的像差校正技术使得FLIM的成像质量进一步提升,而超分辨显微成像技术与FLIM的结合则大幅提升了成像的空间分辨率,获得了超分辨FLIM图像.基于FLIM成像技术上的这些进步,目前FLIM在细胞生物学中一些重要科学问题的研究、临床医学上一些重大疾病的诊断与治疗研究,以及纳米材料的生物医学应用研究等方面均有广泛应用,并取得了许多利用传统的研究手段无法获取的数据.但是另一方面,目前FLIM的成像速度总体而言仍然不够快,或者说在进行快速FLIM成像时仍然不能够获得精度足够高的寿命数据,因此FLIM的成像性能还有待进一步提升.相信未来随着激光技术、探测器技术、超分辨成像等相关技术的快速发展,同时结合算法和荧光探针合成技术的进步,FLIM技术在成像速度、测量精度、成像空间分辨率等方面的性能还将得到进一步提升,从而可在更多领域发挥更重要的作用.

