选择性去迷走对心房纤颤犬心房肌易损性的干预效果
张银玲, 芦颜美, 张 玲, 布阿杰尔古丽·纳斯尔, 叶 坤, 周贤惠
(新疆医科大学第一附属医院心脏起搏与心电生理科, 乌鲁木齐 830054)
心房纤颤是临床上最常见的心律失常。心房纤颤伴随显著的发生率和死亡率。特别是在心力衰竭,房颤的发生率和病死率更加增高[1-2]。据统计,近半数的心力衰竭患者患有持续性房颤。研究证实,心衰合并房颤存在心房肌的重构,其中包含电重构、结构重构和自主神经重构,这导致房颤一旦发生,即进入恶性循环,如果早期给予重构干预可显现出良好的预防和治疗作用[3-4]。但最常见的抗心律失常药物又有致心律失常或者加重心衰的作用,而目前看来,基因治疗尚未有新的致心律失常或加重心衰的风险。故本实验采用干预迷走神经信号传导通路蛋白的基因治疗房颤,试图使用去迷走神经的方法监测代表心房肌易损性指标的变化从而探讨对心房肌重构的干预效果。
1 材料与方法
1.1实验动物健康、成年比格犬17只,雌雄不限,体质量(15.0±1.5)kg,由新疆医科大学第一附属医院动物中心提供。本实验通过新疆医科大学第一附属医院伦理委员会IACUC审核批准(审批号:IACUC-20121122005)。实验遵守《美国国立卫生研究院实验动物研究指南》指导实施,犬年龄、健康状况以及后期犬的营养饲养、监护等,均由新疆医科大学第一附属医院动物中心中级兽医师评定,饲养员专业负责。根据实验需要将犬分为假手术组、rAd-EGFP+房颤组、rAd-Gαi2ctp+房颤组,3组犬在年龄、体质量、性别、心脏大小等基线数据检测上无统计学差异。
1.2实验动物准备术前动物禁食水12 h。常规高温高压消毒手术器械、手术服及电子消毒手术环境。记录实验犬性别、年龄等基本信息。严格按照无菌技术要求操作。盐酸氯胺酮注射液(20 mg/kg)肌肉注射基础麻醉后,建立静脉通道,静脉滴注麻醉镇痛复合液[成份:0.9%氯化钠注射液250 mL,氯化琥珀胆碱注射液(司考林)300 mg+枸橼酸芬太尼注射液0.1 mg],维持肌松。待犬的状况稳定后行气管插管,呼吸机辅助呼吸,调节氧流量4~6 L/min,潮气量为20 mL/kg,所有犬均在空气流通的房间内给予呼吸机正压通气、呼吸压力0~2 Kpa。保温毯保持体温(36.5±0.5)℃上下。按照标准连接心电图导线,应用LEAD-7000多道电生理记录仪动态记录犬正常II导联心电图。犬右侧卧位,左侧胸部剪除犬毛,用碘酒、酒精消毒切口后,应用微创心脏外科技术作左腋下小切口,长约5~7 cm,以4~5肋的肋间隙为切口,逐层切开皮肤、皮下肌层,用合适的开胸器撑开切口,逐层开胸打开心包,局部暴露心房前壁,根据Aistrup等[5]、Lou等[6]的方法给予快速心房前壁注射空载基因rAd-EGFP和rAd-Gαi2ctp基因,采取多点注射(6~8个等距离的点,每点间相聚0.5~1 cm),500 μL重组腺病毒配制成 4 mL的液体,每部位注射0.5 mL。之后逐层缝合肌肉及皮下组织、皮肤关胸,苏醒后正常喂养。术后连续3 d以3 g头孢唑琳钠溶于0.9%氯化钠注射液100 mL中静脉滴注抗炎,预防切口感染。同时进行营养支持、伤口换药、拆线。
1.3房颤模型构建和生理指标检测7 d后麻醉首剂给予戊巴比妥钠(Na-pentobarbital)30 mg/kg,实验过程中每小时末给予追加2 mg/kg。静脉注射麻醉后,犬仰卧固定于手术台上,分别在双后肢、双前肢和胸前皮下置入自制银质针头。按照标准连接心电图导线,动态记录体表导联心电图。气管插管后,右侧颈部、胸前区及右腿内侧备皮。剪除犬毛。取右侧位,沿左侧第4肋间剪开皮肤,分离皮下和肌肉组织,开胸器顺肋间横向撑开胸廓,切开心包制作心包吊篮,暴露心脏左心房和心耳,10极电极缝制在左心耳,用于起搏。逐层关胸,持续静脉输液维持。分离犬颈部右侧迷走神经干,给予插入平行银针,用于刺激迷走神经干构建房颤模型。连接心电图持续记录Ⅱ导联、以及监测血氧饱和度、动脉血压等基础生命体征。
左心耳电极起搏频率1 200次/min,起搏电压为2倍起搏阈值(threshold,TH)2×TH。电极连接心脏多导电生理记录仪(Lead-7000 EP Control,Sichuan Jinjiang,China)。右侧颈部迷走交感神经干银丝针不能穿透神经干,通过Grass刺激仪(S88X,Astro-Med Inc.,Warwick,RI,USA)高频电刺激迷走神经干(high-frequency stimulation,HFS;20 Hz,间隔0.1 ms,方波)进行迷走神经刺激(vagal nerve stimulation,VNS)。能延缓窦性心率的VNS最低电压值即被定义为阈值(threshold,TH),选择高于阈值、引起窦性心率下降50%的电压为刺激电压。房颤被定义为刺激诱发停止后出现持续5 s以上的不规则500次/min的心房率伴有不规则的房室传导。
1.4超声检查采用GE 公司Vivid 7 型超声诊断仪,经胸短轴及四腔心切面测量犬双侧心房、双侧心室大小及左心室射血分数,观察心脏形态大小的变化。
1.5心房肌微阵列电极(MEA)检测微阵列电极检测主要溶液:Hepes 10 mmol/L;Dextrose 1 g;氯化钠140 mmol/L;氯化钾4 mmol/L;氯化镁1 mmol/L;氯化钙1 mmol/L;超纯水配置;使用NaOH滴定液体pH值至7.36。液体配置完成后给予37℃水恒温温浴,100%充氧饱和。
实验结束后,给予静脉注射3%戊巴比妥钠溶液大于标准麻醉剂量的3倍,然后采用无菌技术开胸,取出心脏置于高钾停搏液中冰浴保存;分别快速依次切取约5~8 mm2大小的全层、左心房和右心房前壁组织,将切片的组织置于4℃充氧Tyrode′s液中;按先后顺序逐一取出不同部位组织预置入MEA电极上:用银丝制成O形框架,尼龙丝粘附在O型框架上制成盖网,并用盖网将之前的组织标本固定于MEA电极上;缓慢注入2 mL、改良Tyrode’s液灌流切片的组织,并与TCO2温控仪、数据采集系统等相连接,待信号稳定后开始记录;从MEA的电极芯片多个通道、同步获取心电信号,通过1060-AMP放大(×1 200倍)。使用Mc-Rack软件对心电活动信号进行采样。信息实时显示,可储存在计算机上,以备离线进行数据分析。分析MEA场电位检测指标FPmin、FPmax、FPdur等,由于场电位类似细胞动作电位,场电位时限(Field action potential duration,FAPD)和动作电位、体表心电图的QT相对应,可以反映细胞的除极、复极时间。数个微电极接触心房组织,同一记录平面可记录到场电位信号的电压差异和时间差异,最早激动和激动的起源处在窗口上表现为信号电压最大和最早出现信号。利用此种原理使用MC-Rack,根据peakamplitude的变化绘制出场电位激动顺序图。根据图中显示的颜色不同、电压不同均可代表电激动出现的顺序。
1.6组织学心房肌PAS染色观察新鲜心房组织取材后立即固定,石蜡包埋切片常规给予脱蜡脱水; 0.5%高碘酸液氧化10 min,流水冲洗1 min;用蒸馏水冲洗3次,每次1 min;加入Schiff氏液(无色品红液)于低暗处、常温作用3 min左右,如果目测组织出现红色即终止反应;使用偏重亚硫酸钠液洗3次,每次1 min,流动水再冲洗2 min;最后Mayer苏木素浅染核1 min左右,流动水冲洗10 min;温水中30 s返蓝,流水冲洗1 min;最终常规方法脱水透明、中性树胶封固;若光学显微镜下观察片子中心房组织内糖原呈鲜紫红色,则视为糖原特异性染色阳性反应。
1.7实验路线实验动物犬17只,随机分为3组:(1)假手术组(n=5):经胸心房肌注射500 μL生理盐水;(2)rAd-EGFP+房颤组(n=6):经胸心房肌内注射500 μL携带EGFP(绿色荧光蛋白)基因的重组腺病毒溶液;(3)rAd-Gαi2ctp+房颤组(n=6):经胸心房肌内注射500 μL携带Gαi2ctp基因的重组腺病毒溶液。
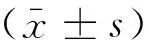
2 结果
在整个实验过程中,动物血氧饱和度持续维持在95%以上、血压平稳,未出现因快速起搏造成的心力衰竭征象;迷走神经持续保持湿润,每小时末重新测量迷走神经刺激电压阈值未见有明显改变,证实神经活性正常。
2.1急性房颤模型建立随着起搏时间的延长,rAd-EGFP+房颤组犬体表心电图出现无序电活动,P波消失,代之以大小不等间隔不均,形态不一的f波,频率450~600次/min,RR间期不等。在起搏停止后,房颤仍能持续5 s以上,犬房颤模型制作成功(图1)。

图1 诱发房颤图
2.2心房肌MEA检测左、右心房肌MEA检测电传导图显示:从同步记录心电信号中记录到从左下到右上的波形变化,明显可以看出左、右心房组织早、中、晚的场电位信号,这表明了电激动的传导先后顺序(图2A)。rAd-EGFP+房颤组的心房组织电激动场电位图可见:激动频率明显增加并紊乱,节律、率绝对不齐;信号在传导过程中电压明显发生改变,梯度样改变消失,出现高低不等、方向不一致的电压信号(图2B)。进一步电传导图分析可见不同种颜色、深浅不一、排列无序的图形(图2C)。
rAd-EGFP+房颤组左、右心房组织MEA检测场点位(FAPD)与假手术组和rAd-Gαi2ctp+房颤组比较,差异均有统计学意义(P<0.05),但假手术组和rAd-Gαi2ctp+房颤组比较,左、右心房组织FAPD差异无统计学意义(表1)。

表1 左、右心房组织MEA检测场电位(FAPD)数值对比
注:与rAd-EGFP+房颤组比较,*P<0.05。
2.3超声检查心脏B超所见:开胸手术前和术后7 d并未见心功能指标变化,证实开胸注射技术以及基因并未造成心脏结构和功能的改变(图3)。


图2 左、右心房肌MEA检测
A: rAd-EGFP+房颤组的左心房肌MEA检测显示;B: rAd-EGFP+房颤组的左心房肌MEA检测单个窗口记录形态图;C: rAd-EGFP+房颤组的左心房肌MEA电传导图分析。

图3 心脏解剖、功能B超检测
2.4左、右心房心肌组织PAS染色糖原PAS染色显示心房心肌细胞结构完整,排列整齐,被少量的间质组织包绕;细胞核大而清晰,rAd-EGFP+房颤组心肌细胞有糖原异常累积聚集,累积糖原显示为紫红色聚集,箭头所指为染色阳性细胞(图4)。
假手术组与rAd-Gαi2ctp+房颤组左、右心房肌PAS特染组间比较差异无统计学意义(P>0.05)。rAd-EGFP +房颤组与rAd-Gαi2ctp+房颤组和假手术组比较,左、右心房肌PAS特染差异有统计学意义(P<0.05)(表2)。

图4 左心房PAS染色示意图
表2 左、右心房PAS染色糖原累积半定量对比

表2 左、右心房PAS染色糖原累积半定量对比
部位假手术组rAd-EGFP+房颤组rAd-Gαi2ctp+房颤组左房21.33±3.25*31.62 ±4.4723.54±3.56*右房19.68±5.43*28.34±4.2224.55±4.65*
注:与rAd-EGFP+房颤组比较,*P<0.05。
3 讨论
心房颤动是临床心律失常领域中最为常见亦是最令医学界棘手的疾病之一。房颤主要易导致如下严重并发症:胸闷、心悸等症状、血栓栓塞和心力衰竭,使得房颤称为致残率高和死亡率高的一大元凶。为此,寻找有效的房颤治疗手段是当前迫切需要解决的科学问题。Yu等[7]对房颤犬模型的星状神经节、迷走神经采用神经放电记录,发现交感和迷走神经放电增强。Ng等[8]发现左房的交感和副交感神经生长均增加,神经生长在肺静脉和左心房前壁最为显著。这同样在人类房颤中也发现类似的结果,心力衰竭房颤模型中副交感神经生长增加。研究提示在房颤的发生和维持中,副交感神经系统明显对房颤的发生起重要促进作用[9-10]。G蛋白信号转导途径是神经系统信号传递过程中重要的信号转导途径。曾有Donahue研究小组利用Gαi在心肌G蛋白信号转导途径中的特殊作用,使用腺病毒载体过度表达Gαi蛋白,改变了心脏自主神经支配的信号转导效应。研究人员通过冠状动脉将Gαi2基因的腺病毒选择性的转染到猪的房室结区域细胞,观察到由于抑制性Gαi2蛋白的高表达调节了房室结的传导特性。在房室结细胞中,Gαi2的高表达抑制了基础房室传导,延长了房室结传导时间,在没有出现完全性心脏传导阻滞的情况下减慢了房颤时的心室率[11]。而Arora研究小组先后采用犬心脏心外膜涂染、以及心外膜心肌注射两种方法,配合超声穿孔、电脉冲穿孔等物理方法将Gαi肽段(Gαictp)转入左心房前壁心肌细胞,最终发现迷走神经介导的房颤诱发率明显降低。Gary L继续延续上述实验,使用心肌注射结合电穿孔技术将Gαictp基因转染至犬心肌细胞,发现实验3 d后迷走神经介导的房颤诱发明显减少。蒋华等[12]证实了外源性Gαi2ctp可作用于Gαi蛋白C末端肽结构,阻止Gαi介导的信号传导通路,从而选择性干扰迷走神经兴奋性,达到“药物去迷走神经”的作用,减少迷走神经介导的房颤发生。究其原因,M2R在迷走神经纤维中占有主导的地位,心房肌细胞内的乙酰胆碱可激活M2R,后者将迷走神经兴奋信号转导到细胞内的异源Gi蛋白三聚体,Gia激活后降低了腺苷酸环化酶/环腺苷酸/蛋白激酶的活性,Gβγ直接激活内向整流钾电流,Gαictp具有Gαi的相似结构,竞争性抑制Gαi与M2R结合,干扰Gαiβγ三聚体的解离,使得信号传导途径阻断、Gαi和Gβγ作用无法实现,心房有效不应期延长、离散度减少,房颤诱发降低[13]。
本研究将重组腺病毒rAd-Gαictp通过开胸局部注射的方法靶向转导至犬左心房,发现rAd-EGFP+房颤组左、右心房组织MEA检测场点位(FAPD)与假手术组和rAd-Gαi2ctp+房颤组比较,差异均有统计学意义(P<0.05)。3组犬左右心房离体MEA电传导图显示rAd-EGFP+房颤组传导紊乱,余2组传导未见明显异常。rAd-EGFP +房颤组与rAd-Gαi2ctp+房颤组和假手术组比较,左、右心房肌PAS特染差异有统计学意义(P<0.05),提示迷走神经介导的房颤的发生消失,代表心房易损性的心房组织场电位减小,组织糖原累积减少,证实迷走神经活性被干扰,进一步明确基因靶向干预治疗的有效性及可行性,为房颤的基因治疗提供新的思路和理论依据。
焦华琛等[14]根据Poincare散点图的形态,发现椭圆形、棒球杆形、不规则形房颤为迷走神经介导性房颤。针对房颤治疗,心脏去神经消融的手术策略会不可避免带来心肌损伤和其他相邻组织结构的损伤,使得近年出现以分子生物水平的靶向干预自主神经效应达到手术去神经消融的方法。其中调控抑制性G蛋白信号传导途径可达到预防和治疗房颤的目的,称为“分子水平的消融”。干扰G蛋白信号传导途径治疗心房纤颤,当然还有很多的调控靶点存在,除抑制性G蛋白调控以及RGS的干预,还可对G蛋白受体家族进行靶向调节。此途径虽然已经取得一定的成功,但仍需考虑:靶向干预自主神经的基因能否持续长效的表达;其次,基因治疗的途径是否安全,特别是G蛋白途径的干预,是否影响G蛋白介导的其他信号传导途径。期望将来回顾历史的发展,基因水平治疗能成为房颤治疗史上的里程碑。

