亚硝化模拟体系中油脂对N-亚硝胺形成的影响
熊凤娇,马俪珍,*,王 洋,梁丽雅,杨 华,4,李双燕
(1.天津农学院食品科学与生物工程学院,国家大宗淡水鱼加工技术研发分中心,天津市水产品加工及质量安全校企协同创新实验室,天津 300384;2.天津农学院水产学院,水产生态及养殖重点实验室,天津 300384;3.天津农学院食品科学与生物工程学院,天津市农副产品深加工技术工程中心,天津 300384;4.天津农学院动物科学与动物医学学院,天津 300384)
在肉制品的加工过程中加入亚硝酸盐不仅可以改善产品的风味、口感及色泽,对肉毒梭状芽孢杆菌的生长繁殖也能起到一定的抑制作用[1]。然而肉制品中存在的亚硝酸盐也能与胺类物质经过一系列反应生成致癌物N-亚硝胺[2-6]。Jakszyn等[7]研究表明,亚硝酸盐及N-亚硝胺摄入量与胃癌、食道癌之间呈现明显的正相关关系。影响N-亚硝胺形成的因素有很多,包括亚硝酸盐的含量、二级胺的种类和浓度、温度、pH值、反应时间等。亚硝酸盐作为N-亚硝胺形成的底物,能在亚硝化反应中为N-亚硝胺提供亚硝基,因此N-亚硝胺的生成量随着反应体系中亚硝酸盐浓度的增加有上升的趋势[8-9];且当亚硝酸盐与二级胺类底物浓度比为2∶1时,N-亚硝胺的生成量最大[10];因为N-亚硝胺的形成过程符合热反应动力学方程,故在一定范围内,温度越高,N-亚硝胺的生成量越多[11];酸性条件可促进亚硝酸盐的解离以及NOx的形成,故N-亚硝胺更易在酸性条件下形成[12];反应时间也影响着N-亚硝胺的形成,研究发现在反应开始3 h后,N-二甲基亚硝胺(N-nitrosodimethylamine,NDMA)的生成量明显增大[11]。研究发现,脂肪也是影响亚硝化反应的重要参数,如油炸培根的脂肪组织中N-亚硝胺的含量远高于瘦肉或全肉,分析其原因可能是非极性脂质为N-亚硝胺的形成提供了有利条件[13];Yurchenko等报道,含有脂肪的羊肉中N-亚硝胺含量高于纯瘦肉中N-亚硝胺的含量[14];另有研究表明,培根加热后流出的油脂具有亚硝化能力[15]。以上报道均表明脂肪在N-亚硝胺的形成过程中有可能起到促进作用。然而,关于脂肪的种类和比例对亚硝化反应的影响却鲜有报道。
N-亚硝胺的种类较多,本实验首先以肉制品中常检测到的2 种N-亚硝胺,即NDMA、N-二乙基亚硝胺(N-nitrosodiethylamine,NDEA)为研究对象,提前将二甲胺盐酸盐(di-methylamine hydrochlorid,DMA·HCl)、二乙胺盐酸盐(di-ethylamine hydrochloride,DEA·HCl)分别与亚硝酸盐作为反应底物加入到亚硝化反应体系中,再加入不同种类(花生油、葵花籽油、亚麻籽油)和比例(0%~40%)的油脂,研究脂肪的种类及比例对N-亚硝胺(NDMA、NDEA)生成量的影响。并进一步研究亚硝化反应体系中某一种油脂存在条件下,底物浓度比、pH值、反应温度、反应时间对NDMA、NDEA和N-亚硝基吡咯烷(N-nitrosopyrrolidine,NPYR)形成的影响,为肉制品加工过程中各种工艺参数的确定以及进一步研究抑制N-亚硝胺生成的方法提供理论基础。
1 材料与方法
1.1 材料、试剂与仪器
葵花籽油、花生油、亚麻籽油购于天津市红旗农贸市场,采用GB 5009.227—2016《食品中过氧化值的测定》[16]中的滴定法测定葵花籽油、花生油、亚麻籽油的过氧化值(peroxide value,POV)分别为(12.41±0.13)、(28.52±0.16)、(27.45±0.19) mmol/kg。
三氯甲烷、冰乙酸、碘化钾、可溶性淀粉、硫代硫酸钠、磷酸氢二钠、磷酸二氢钠、NaOH、DMA·HCl、DEA·HCl、吡咯烷(pyrolidine,PYR)、PEG8000、二氯甲烷(均为分析纯) 国药集团化学试剂有限公司;NDMA、NDEA、NPYR(均为色谱纯) 美国AccuStandard公司。
7890A气相色谱仪 美国Agilent公司;ST 40R离心机 美国Thermo公司;18Basic匀浆机 德国IKA公司;FA2004精密电子天平 上海精科仪器公司;STARTER3100酸度计 美国OHAUS公司;HH-S型数显恒温油浴锅 江苏科析仪器有限公司;XMTD-4000电热恒温水浴锅 上海科恒实业发展有限公司。
1.2 方法
1.2.1 油脂对体外模拟亚硝化反应体系中N-亚硝胺生成量的影响
参照Kuniyuki等[17]的方法,在50 mL离心管中依次加入50 mmol/L NaNO2和25 mmol/L DMA·HCl(DEA·HCl)(其中NaNO2和二级胺盐酸盐均由25 mmol/L、pH值为6.2的磷酸缓冲盐配制,模拟体系中NaNO2、二级胺盐酸盐的终浓度分别为15 mmol/L和7.5 mmol/L),再继续将不同种类(花生油、葵花籽油、亚麻籽油)及不同比例(体积分数0%~40%)的油脂加入离心管中,由于油脂和水不能互溶,因此需在离心管中加入适量的乳化剂(PEG8000),制成乳化体系。待所有试剂加完后,立即用匀浆机在B档(13 000 r/min)匀浆30 s,制备得到乳化体系,然后拧紧离心管,置于80 ℃的水浴锅中水浴1 h,随即用6 mmol/L NaOH溶液将反应体系的pH值调至13以终止亚硝化反应。然后向离心管中加入5 mL二氯甲烷溶液,充分振荡2 min,离心5 min(4 ℃,10 000×g),吸取下层清亮部分,过0.45 μm有机膜后装入气相色谱仪的样品瓶中,待上机测定。
1.2.2 亚硝化反应条件对2 种反应体系中N-亚硝胺生成量的影响
通过模拟反应体系1.2.1节的实验结果,确定将20%花生油应用到模拟反应体系中,形成乳化体系,以不加花生油的水相体系为对照,研究不同NaNO2与DMA·HCl、DEA·HCl、PYR的浓度比(1∶1、2∶1、1∶2)、pH值(5.4、5.8、6.2、6.6、7.0)、反应温度(20、50、80、100、120 ℃)、反应时间(1、1.5、2、2.5、3 h)对乳化体系以及水相体系中NDMA、NDEA及NPYR生成量的影响。
模拟体系制备过程:用25 mmol/L磷酸盐缓冲液分别配制100 mmol/L的NaNO2溶液以及50 mmol/L的DMA·HCl(DEA·HCl或PYR)溶液,然后各取4 mL于50 mL离心管中,继续向离心管中加入2 mL花生油(乳化体系)或缓冲盐溶液(水相体系)及乳化剂(PEG8000),立即匀浆、乳化。将反应体系置于水浴锅中加热一段时间后,取出置于冰中快速冷却,然后用6 mol/L NaOH溶液终止亚硝化反应,后续实验步骤同1.2.1节。
1.2.3 N-亚硝胺指标的测定
将前处理好的样品进行气相色谱测定。色谱条件:HP-INNOWAX毛细管色谱柱(30 m×320 μm,0.25 μm);进样口温度250 ℃;氮磷检测器温度330 ℃;载气为N2;流速6 mL/min;空气流速60 mL/min;H2流速3 mL/min。升温程序:初始温度50 ℃,保持4 min;以10 ℃/min升到180 ℃,保持2 min;后运行200 ℃,5 min。不分流进样;进样量1 μL。
利用安捷伦工作站对色谱图进行分析及数据处理,采用保留时间进行定性,外标法进行定量。
1.3 数据统计分析
采用Microsoft Excel 2016计算各个指标的平均值和标准差,结果用±s表示,实验均重复3次。SPSS Statistix 17.0软件进行数据分析,通过SNK法进行显著性分析,显著性差异(P<0.05)。使用Origin 9.0软件作图。
2 结果与分析
2.1 不同种类及比例油脂的添加对N-亚硝胺生成量的影响

图1 不同种类及比例的油脂对N-亚硝胺形成的影响Fig. 1 Effects of different types and proportions of oils on the formation of N-nitrosamines
由图1可以看出,在含有花生油、亚麻籽油和葵花籽油的亚硝化反应体系中,花生油和亚麻籽油的添加明显促进了NDMA和NDEA的形成,且随着添加比例的增加,NDMA和NDEA的生成量明显升高,当花生油的添加比例为30%时,NDMA和NDEA的生成量与未添加油脂(0.94、0.87 ng/μL)时相比分别增加了47%和42%;同样,当亚麻籽油的添加比例为30%时,NDMA和NDEA的生成量也分别增加了38%和29%;然而葵花籽油的添加几乎没有使体系中的NDMA和NDEA的生成量出现明显增加趋势。分析原因可能与油脂的脂肪氧化程度不同有关。本实验所使用的花生油和亚麻籽油的POV分别为(28.52±0.16) mmol/kg和(27.45±0.19) mmol/kg,显著高于葵花籽油((12.41±0.13) mmol/kg,P<0.05),花生油和亚麻籽油的脂肪氧化程度较高,势必会形成一定的脂肪氧化产物,而脂肪氧化产物对N-亚硝胺的形成会有一定的促进作用[18]。所以,添加葵花籽油的模拟体系中N-亚硝胺生成量相对其他2 种油脂来说较低。由此说明,某些油脂的添加确实会促进N-亚硝胺的形成,但与油脂的种类和比例有关。因为当油脂的添加比例高于30%时,不容易形成较好的乳化稳定体系,因此将20%花生油应用到后续模拟实验中。
2.2 底物浓度比对N-亚硝胺生成量的影响

图2 底物浓度比对N-亚硝胺生成量的影响Fig. 2 Influence of substrate concentration on the formation of N-nitrosamines
如图2所示,在其他亚硝化反应条件相同情况下,含有油脂(花生油)的乳化体系中3 种N-亚硝胺的生成量均显著高于水相体系(对照组)中N-亚硝胺的生成量(P<0.05),这说明体系中油脂的存在可能以某种形式促进N-亚硝胺的形成。且在相同反应条件下,NaNO2与相同浓度的DMA·HCl、DEA·HCl或PYR反应时,NDMA的生成量明显高于NDEA和NPYR的生成量。结果表明,当NaNO2与DMA·HCl、DEA·HCl底物浓度比为2∶1时,乳化体系和水相体系中NDMA和NDEA的生成量最高,显著高于其他2 个浓度比(1∶1或1∶2)。而当比较底物浓度为1∶1或1∶2之间的变化时,1∶2的NDMA和NDEA的生成量略高于1∶1。与NDMA和NDEA的变化不同,当底物浓度NaNO2与PYR浓度比为2∶1时,NPYR的生成量并不是最高,反而是1∶2相对较高,这说明NPYR的形成机制与NDMA和NDEA有很大不同。
2.3 pH值对N-亚硝胺生成量的影响

图3 pH值对N-亚硝胺生成量的影响Fig. 3 Effect of pH on the formation of N-nitrosamines
由图3可知,pH值在5.4~7.0范围内,随着pH值的升高,水相体系及乳化体系中NDMA和NDEA的生成量均有明显下降趋势(P<0.05),且水相体系及乳化体系之间逐渐趋于一致。当pH值升高到7时,水相体系和乳化体系中NDMA和NDEA生成量均降到很低的水平(0.30~0.76 ng/μL)。说明N-亚硝胺更易在酸性条件下形成,越接近中性条件,NDMA和NDEA生成量越少。图3表明在pH值变化初期(5.4~6.2)乳化体系中NPYR的生成量随着pH值上升显著下降,当pH值大于6.2时,NPYR的生成量基本保持不变,水相体系中NPYR的生成量受pH值的影响不大。并且,pH值在5.4~7.0范围内,乳化体系中NDMA(0.75~12.79 ng/μL)、NDEA(0.50~8.87 ng/μL)、NPYR(1.25~2.07 ng/μL)生成量始终高于水相体系中NDMA(0.60~8.89 ng/μL)、NDEA(0.30~8.06 ng/μL)、NPYR(0.50~0.82 ng/μL)的生成量。
2.4 反应温度对N-亚硝胺生成量的影响

图4 反应温度对N-亚硝胺生成量的影响Fig. 4 Effect of reaction temperature on the formation of N-nitrosamines
由图4可以看出,乳化体系中N-亚硝胺生成量始终高于水相体系,且温度越高,2 种体系中N-亚硝胺生成量之间的差异越明显。如反应温度50 ℃时,NDMA在乳化体系中的生成量是水相体系的1.15 倍,而当温度升高到120 ℃时,升至1.79 倍。反应温度对所有的化学反应速率均有一定的影响,据范霍夫近似规律,温度每升高10 K,反应速率近似增加2~4 倍。因此,高温对亚硝化反应速率起到明显的促进作用,特别是油脂存在条件下,高温更有利于N-亚硝胺的形成。
NDMA、NDEA、NPYR三者之间比较,在相同条件下,NDMA的生成量最高,其次是NDEA,而NPYR的生成量最低,但实验发现,温度超过100 ℃,NPYR才更容易形成,且温度越高,油脂的存在更容易促进NPYR的形成,如120 ℃时,乳化体系中NPYR的生成量比水相体系高出2.54 倍。
2.5 2 种亚硝化反应体系条件下反应时间对N-亚硝胺生成量的影响

图5 反应时间对N-亚硝胺生成量的影响Fig. 5 Effect of reaction time on the formation of N-nitrosamines
由图5可知,反应时间在1~2.5 h范围内,乳化体系和水相体系中NDMA、NDEA的生成量随着时间的延长呈现上升的趋势,当反应时间超过2.5 h后,NDMA和NDEA的生成量有略微下降的趋势,但差异不显著(P>0.05)。NPYR的变化趋势不同于NDMA和NDEA,反应时间在1~3 h范围内,水相体系中NPYR的生成量变化不明显,乳化体系只有当反应时间超过2.5 h后才有一个明显的上升趋势。
3 讨 论
脂肪氧化产物能促进N-亚硝胺的形成。Kurechi等[18]在二甲胺和亚硝酸盐的反应体系中,加入脂肪氧化产物丙二醛(0.05 mol),观察反应体系中NDMA的形成情况,同时做空白对照,结果表明pH值为6.0时丙二醛的反应体系中NDMA的生成量是对照体系中的8.64 倍。本实验结果表明,氧化程度较高的花生油和亚麻籽油,其参与的模拟体系中NDMA和NDEA生成量也较高。除了脂肪氧化程度外,油脂种类也影响N-亚硝胺的形成。另外为进一步验证实验结果,实验还将氧化程度较低的花生油通过在高温条件下加热不同时间,得到不同氧化程度的花生油(POV分别为(10.26±0.21)、(18.74±0.13)、(33.20±0.17) mmol/kg),然后将亚硝酸盐和二甲胺盐酸盐以及不同氧化程度的花生油添加到模拟体系中制备乳化体系(其中花生油的添加量为20%),测定不同体系中NDMA生成量(对应的NDMA生成量分别为(1.17±0.10)、(1.24±0.06)、(1.33±0.04) ng/μL),结果表明NDMA的生成量随着花生油过氧化值的升高有上升的趋势,说明氧化产物影响N-亚硝胺的形成。且由2.1节可知,葵花籽油过氧化值为(12.41±0.13) mmol/kg,高于氧化程度低的花生油的POV(10.26 mmol/kg),但在其他条件相同的情况下,添加20%葵花籽油的模拟体系中NDMA的生成量(0.87 ng/μL)却低于添加花生油的模拟体系中的NDMA生成量(1.27 ng/μL)。说明除了油脂氧化程度外,油脂的种类可能也会影响N-亚硝胺的形成,究其原因可能在于不同油脂的脂肪酸组成及脂肪酸饱和度均有一定的差异。
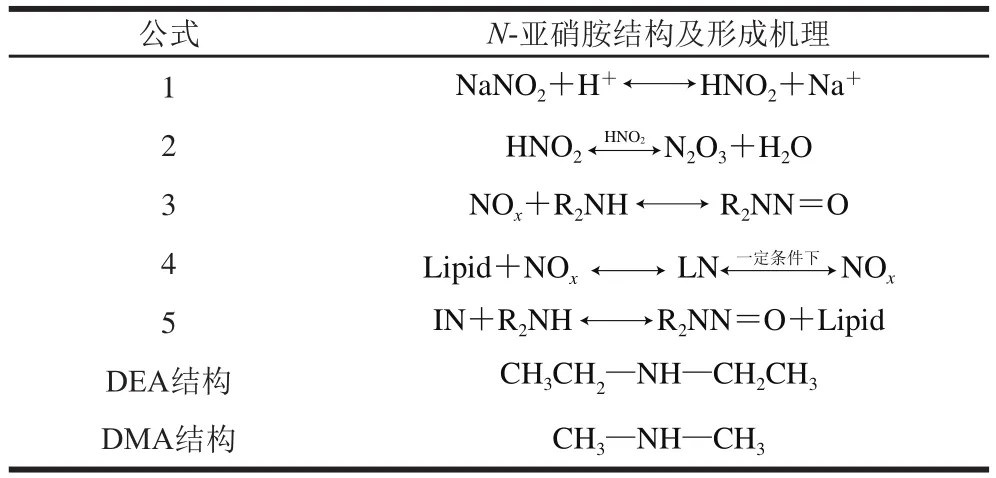
表1 N-亚硝胺结构及形成机理Table 1 Structure and formation mechanism of N-nitrosamines
底物浓度对N-亚硝胺的形成有明显的影响,杨华等[10]研究表明亚硝酸盐浓度越高,N-亚硝胺的生成量越大。本实验研究结果表明,当亚硝酸盐和二级胺盐酸盐的浓度比为2∶1时,生成的NDMA和NDEA的量最多。究其原因可能在于,N-亚硝胺的形成过程分为两步,第1步是两分子亚硝酸生成活性中间体NOx(N2O3),第2步是NOx(N2O3)将DMA(DEA)亚硝化为NDMA(NDEA),如表1中公式2、3所示。其中第1步的主要产物是N2O3,这1步的活化能约为114~118 kJ/moL,比第2步反应的活化能高103~108 kJ/moL,所以两分子亚硝酸生成N2O3是整个亚硝化反应的控速步骤,因此NDMA的生成速率与亚硝酸/亚硝酸盐的浓度密切相关[19],亚硝酸盐浓度越高,其生成量也就越大。但亚硝酸盐浓度对NPYR的形成影响较小,Drabik-markiewicz等[20]认为,NPYR的形成与温度及脯氨酸浓度有关,而与亚硝酸盐浓度的关系不大,与本实验得到的结果一致。
低pH值条件下有利于NDMA(NDEA)的形成。Mirvish[12]研究了水相中N-亚硝胺形成的动力学,结果表明pH值每下降1 个单位,N-亚硝胺形成的初始速率就会增加10 倍。本实验研究结果表明,pH值在5.4~7.0范围内,NDMA和NDEA生成量随着pH值的上升有下降的趋势。原因可能是亚硝酸钠不能直接与二级胺(DMA、DEA)反应生成N-亚硝胺,需先在酸性条件下转化为亚硝酸(表1公式1),亚硝酸进一步反应生成亚硝化试剂NOx(表1公式2),NOx再亚硝化胺类物质生成N-亚硝胺(表1公式3)。因此,当pH值较高时,亚硝酸盐转化为亚硝酸的量大大降低,从而导致N-亚硝胺的生成量出现明显下降的趋势。但pH值也并非越低越好,尹立辉等[11]认为当pH值过低时,会导致胺类化合物质子化,使其不能够和活性中间体氮氧化物发生反应,从而影响N-亚硝胺的形成。Rywotycki[21]认为对于仲胺来说,生成N-亚硝胺的最有效的pH值为4~4.5。
温度是影响N-亚硝胺形成的重要因素之一,杨华等[10]研究表明当温度高于80 ℃时,NDMA和NDEA的生成量随着温度的上升有明显增加的趋势。Bharucha等[22]研究表明,培根经过高温处理后NPYR含量显著高于生培根中NPYR的含量。本实验研究结果发现,当反应温度高于80 ℃时,随着温度的升高,3 种N-亚硝胺的生成量明显增加。另外本实验研究结果还表明,在高温条件下(大于80 ℃),乳化体系中NDMA和NDEA的生成速率高于水相体系。原因可能是脂肪可以与NOx反应生成一种中间产物(lipid-NOx,LN)(表1公式4),LN可能直接与胺类底物反应生成N-亚硝胺(表1公式5),LN也可能在适当条件下释放NOx(表1公式4),NOx与存在的自由胺类物质反应,形成N-亚硝胺(表1公式3)[14],而高温则会加速LN降解并释放氮氧化物[23]。因此高温条件下乳化体系中NDMA和NDEA形成速率明显高于水相体系中N-亚硝胺的形成速率。与NDMA、NDEA的变化趋势相同,乳化体系中NPYR的形成速率也高于水相体系。
本实验研究结果发现,NDMA和NDEA的生成量随着反应时间的延长有先上升后略微下降的趋势,原因可能是反应开始时,硝酸逐渐向NOx转化(表1公式2),随着体系中NOx的增加,N-亚硝胺的生成量随之增大。当反应时间达到2.5 h后,体系中的N-亚硝胺底物(亚硝酸钠或二级胺盐酸盐)基本耗尽,因此生成量并未出现上升的趋势。Bharucha等[22]研究发现,培根在油炸后期N-亚硝胺呈现出下降的趋势,原因是油炸后期部分N-亚硝胺随着蒸汽挥发至空气当中,因此本实验NDMA、NDEA生成量在3 h略微下降也很可能是由于随着反应时间的延长,少量N-亚硝胺随着水蒸气挥发至外界所致,但差异不显著。
本实验研究表明NaNO2与DMA·HCl、DEA·HCl、PYR浓度比为2∶1时,NDMA、NDEA的生成量最高,NPYR的生成量最低。这可能与DMA、DEA的结构有关(表1)。DMA和DEA的碳链长短不一样,碳链越长,分子间作用力越大,因此相对于DEA而言,DMA上的氢原子更易被亚硝基取代,从而生成相应的N-亚硝胺。NPYR生成量最低的原因可能是相对于NDMA、NDEA而言,NPYR的形成需要更高的温度,PYR是稳定的五元环,在低温条件下不容易发生取代反应,但高温有利于NPYR的形成。Drabik-markiewicz等[20]研究表明,将肉制品加热到85 ℃,NDMA的检出率较高,但NPYR的检出率基本为零,当温度升至200 ℃以后,NPYR检出率较高。
Mottram等[24]研究表明油炸培根的脂肪组织中N-亚硝胺的含量远高于瘦肉或全肉;熊凤娇等[25]研究发现,在鱼豆腐的加工过程中,在添加脂肪进行斩拌后,N-亚硝胺含量有明显上升的趋势。本实验研究结果发现,在不同因素的影响下,乳化体系中N-亚硝胺生成量高于水相体系中N-亚硝胺的生成量。关于脂肪参与N-亚硝胺形成的原因,除了上述提到的脂肪氧化产物促进N-亚硝胺的形成外,Hotchkiss等[15]推测脂肪可以与NOx反应生成一种未知的中间产物,这一中间产物可以在一定条件下(煎炸)降解成为亚硝化试剂,将胺类底物亚硝化成相应N-亚硝胺。学者们通过将氮氧化物与脂肪酸反应,发现形成的反应产物能亚硝化胺类物质[26-29]。Liu Ruihai等[30]研究证明了N2O3可加成到脂肪酸的碳碳双键位置,生成脂肪亚硝化试剂,该试剂可以在油炸过程中分解,并释放出可以亚硝化二级胺的氮氧化物。由此可以看出,脂肪确实能够参与N-亚硝胺的形成,但关于脂肪与氮氧化物的反应物结构及其合成机制亟待深入研究。
4 结 论
在含有油脂的亚硝化反应体系中,3 种油脂(花生油、亚麻籽油、葵花籽油)对NDMA和NDEA的形成均有一定的促进作用,但油脂的种类和比例影响N-亚硝胺的形成,且相对于添加葵花籽油而言,花生油和亚麻籽油的添加对N-亚硝胺形成的促进效果更好。
比较亚硝化反应的水相体系和乳化体系,整体上乳化体系中NDMA、NDEA和NPYR的生成量均显著高于水相体系中,且相同反应条件下,三者的生成量依次是NDMA>NDEA>NPYR,说明油脂确实起到促进N-亚硝胺形成的作用。
无论乳化体系还是水相体系,亚硝化反应条件(底物浓度、pH值、反应温度、反应时间)对N-亚硝胺的形成影响较大,NaNO2与DMA·HCl、DEA·HCl和PYR浓度比为2∶1时,NDMA和NDEA的生成量最大;pH值在5.4~7.0范围,NDMA和NDEA的生成量随着pH值的上升有下降的趋势。但pH值对NPYR生成量影响较小;反应温度越高,N-亚硝胺的生成量越大,当温度高于80 ℃时,NDMA和NDEA的生成量有明显上升的趋势,反应温度高于100 ℃时,NPYR才有明显的升高趋势;在1~2.5 h反应时间内,随着反应的进行,NDMA和NDEA的生成量有上升的趋势,当反应时间超过2.5 h后,NDMA和NDEA的生成量有略微下降的趋势。与NDMA和NDEA相比较,反应时间对NPYR生成量的影响较小。
在高温、低pH值、高亚硝酸钠浓度和一定量的油脂存在的条件下,NDMA、NDEA的生成量较大,而对NPYR形成影响最大的因素是反应温度,因此在肉制品实际生产中可以通过控制这些因素从而降低N-亚硝胺的形成。

