c-Jun氨基末端激酶对蛛网膜下腔出血大鼠海马区神经细胞自噬的调节及依达拉奉的影响
赵雅宁 郭向飞 李建民 赵 旭 徐继伟 薛承景
(华北理工大学, 1 康复医学院, 2 附属医院神经外科, 唐山 063000)
蛛网膜下腔出血(subarachnoid hemorrhage, SAH)在脑血管疾病中大概占10%~15%,其致残率和死亡率很高[1]。依达拉奉(Edaravone)是2000年上市的新型氧自由基清除剂,临床上主要用于治疗急性脑梗塞,可有效的防治脑水肿及脑梗塞的进展[2]。近年来有学者将依达拉奉应用于颅脑创伤的治疗中,取得了一定效果。自噬对细胞的转归、恢复、修复、损伤、加重或死亡起着重要作用[3]。SAH早期发生自噬的激活,抑制自噬可加重SAH神经功能[4]。前期研究发现,Edaravone治疗可提高 SAH后神经元自噬的激活,但其具体作用机制尚未阐明。自噬的激活涉及多种复杂的分子机制,其中c-Jun氨基末端激酶(c-Jun N-terminal kinase, JNK)通路与自噬联系最为密切[5]。JNK是有丝分裂原活化蛋白激酶(mitogen-activated protein kinases, MAPKs)家族重要成员之一,现已证实自噬和JNK信号活化在多种疾病如动脉粥样硬化、脑卒中、神经退行性疾病等病理过程中具有关键作用[6-7]。本研究建立SAH动物模型,采用依达拉奉、JNK抑制剂SP600125进行干预,观察海马区组织丙二醛(malondialdehyde, MDA)水平、活化状态JNK(磷酸化JNK)、自噬关键因子Beclin-1和微管相关蛋白1(轻链LC3)-Ⅱ表达变化及神经细胞丢失变化,探讨JNK对蛛网膜下腔出血大鼠海马区神经细胞自噬的调节及依达拉奉的影响。
1 材料和方法
1.1 动物分组与模型制作
清洁级雄性SD大鼠160只,体质量350~450g(购置于北京维通利华实验动物技术有限公司,合格证号SCXK(京)2009-003)。分为假手术组(Sham组)、蛛网膜下腔出血模型组(SAH组)、JNK抑制剂SP600125组、依达拉奉干预组。每组分为6、24、48h和72h 4个时间亚组。
采用经典的自体血2次枕大池注血法(间隔48h分别向枕大池注射自体动脉血0.3ml)制备大鼠SAH的模型[8]。Sham组向枕大池2次注入0.3ml生理盐水,余操作均与SAH组一致。
SP600125组: 模型制备前30min侧脑室注射SP600125试剂(美国SANTACRUZ公司,货号: HY-12041-04752-2013),10μg/μl,注射速度为1mm/min,留针10min后,以1mm/min速度取针。依达拉奉干预组: 在模型制备后即刻经尾静脉注射依达拉奉(国药准字H20110090,建天泉药业股份有限公司),10mg/kg,每24h注射给药1次,至72h结束。
模型成功判定标准: (1) 当行2次枕大池注血时,可见少量血性脑脊液在穿刺部位渗出,此现象充分说明穿刺针位置准确;(2) 剥离脑部时肉眼明显可见血性液体散在分布在脑底基底池部位。模型制作过程中,SAH组、SP600125组和依达拉奉组因死亡或不符合标准被剔除的动物分别为7、8、8只。上述被剔除动物依次补齐,最终各组40只动物纳入统计学分析。
1.2 脑组织海马区形态结构观察
每组各时间点取5只大鼠,常规麻醉后,处死动物,用4%多聚甲醛灌注固定后,取视交叉平面至大脑横裂脑组织。石蜡包埋、冠状切片,片厚5μm,H-E染色。光学显微镜下观察;在400×光镜下观察海马CA1区神经元形态变化,计数该视野下的存活神经元数量(有明显细胞膜、细胞核、核仁为存活神经细胞)。具体方法: 各组各时间点5只大鼠,每只大鼠取4张海马区切片,每张切片选取5个不重复的视野(共100个视野),选Motic-6.0图像采集以及系统分析,以每个视野下平均细胞百分率(400×)下CA1区存活细胞数量与总细胞数量比值%)表示。
1.3 免疫组织化学检测磷酸化JNK、Beclin-1和LC3-Ⅱ阳性表达
标本采集同H-E染色,切片常规脱蜡至去离子水、滴加复合消化液、加入37℃温箱孵育20min, PBS洗涤3次,每次5min,用3%H2O2封闭内源性过氧化物酶15min, PBS洗涤、滴加兔抗鼠磷酸化JNK、Beclin-1和LC3-Ⅱ多克隆抗体(1∶200,1∶200,1∶250),4℃过夜;37℃复温45min,PBS洗涤、滴加生物素化二抗,37℃孵育40min,PBS洗涤,DAB显色,苏木精轻度复染、脱水透明、封片。镜下观察并摄片。
1.4 实时荧光定量PCR法检测磷酸化JNK、 Beclin-1、LC3-Ⅱ表达
各组各时间点取5只大鼠,按照规定的时间点处死动物后,快速断头取脑,用冰箱中预冷的器械在冰上分离出双侧海马组织,称量0.6g,加入1 ml RNAiso Plus溶液后匀浆,室温静置5min后12000r/min 4℃离心5min,取上清移至新的1.5ml离心管内,加入1/5 RNAiso Plus溶液体积的氯仿,震荡混匀后室温静置5min,12000r/min 4℃离心15min,将上清液转移至新离心管中,加入0.5~1倍RNA iso Plus溶液体积的异丙醇,室温静置10min,12000r/min 4℃离心10min,弃掉上清液,用与RNAiso Plus溶液等量的75%乙醇清晰沉淀,7500r/min 4℃离心5min,弃上清保留沉淀,干燥(不可加热),溶解于30μl DEPC处理水中,测量OD260/280值,根据OD260计算RNA浓度,-80℃保存。
检测步骤: (1) 磷酸化JNK,上游引物AGGGAG CACACAATAGAGGAGTG,下游引物GAAGACGA CGGATGCTGAGAG;(2) Beclin-1,上游引物CTCT CGTCAAGGCGTCACTTC,下游引物CCTTAGAC CCCTCCATTCCTCA;(3) LC3,上游引物ACCCTCT ACGATGCTGGTGA,下游引物GCTGTCCTCAATG TCCTTCTG。进行实时荧光定量PCR反应: 42℃ 50min,95℃ 10s;(95℃ 15s、56℃ 20s)×45个循环。以GAPDH为内参基因,以Sham组磷酸化JNK mRNA、Beclin-1 mRNA 和LC3-Ⅱ mRNA表达为1,计算各组磷酸化JNK mRNA、Beclin-1 mRNA 和LC3-Ⅱ mRNA 的Ct值(公式(△△Ct=目的基因平均△Ct值-管家基因平均Ct值,△△Ct=实验组△Ct-对照组△Ct,相对表达量=2-△△Ct)。
1.5 MDA含量测定
取材方法同免疫印迹,大鼠致死后,迅速取双侧皮质及海马区组织,称量0.6g,匀浆,依次加入试剂,混匀器混匀,沸水浴40min,冷却,然后3500r/min,离心10min。取上清,532nm处,1cm光径,蒸馏水调零,比色测定各管吸光度值,按说明计算MDA含量。
1.6 统计学处理
2 结果
2.1 各组大鼠海马区神经元形态学变化
Sham组海马区神经细胞结构正常、排列整齐、胞核大而圆,核仁清晰;SAH组海马区可见神经细胞变性水肿、坏死神经细胞,表现为细胞出现核溶解、核碎裂或核消失结构不清。与Sham组比较,SAH组各时间点神经细胞存活率均明显减少(P<0.05);SP600125组神经细胞形态结构损伤进一步减轻,视野中存活神经细胞增多,与SAH组比较,各时间点神经元存活率均明显增加(P<0.05);依达拉奉组神经细胞形态结构均减轻,视野中死亡神经细胞减少,与SAH组比较,依达拉奉组各时间点神经元存活率均明显增多;依达拉奉组海马区神经细胞存活率高于SP600125组(P<0.05)(图1,表1)。

表1 各组海马CA1区神经细胞存活率比较(n=5,±s)
*P<0.05vssham;△P<0.05vsSAH
2.2 MDA检测
与 Sham组比较,SAH组各时间点MDA均明显增多(P<0.05);与SAH组比较,SP600125组各时间点MDA均降低(P<0.05);与SAH组比较,依达拉奉组各时间点MDA均降低(P<0.05);依达拉奉组MDA低于SP600125组(P<0.05)(表2)。

表2 各组大鼠海马区MDA水平比较(n=5,±s)
*P<0.05vssham;△P<0.05vsSAH
2.3 磷酸化JNK、Beclin-1和LC3-Ⅱ免疫组织化学显色
磷酸化JNK、Beclin-1和LC3-Ⅱ阳性表达主要位于细胞核。Sham组大鼠大脑海马区有极少量的阳性细胞,染色较淡。与Sham组比较,SAH 组各磷酸化JNK、Beclin-1和LC3-Ⅱ免疫阳性反应增强,染色棕黄;与SAH 组比较,SP600125组磷酸化JNK免疫阳性反应减弱,染色变浅,Beclin-1和LC3-Ⅱ免疫阳性反应增强。与SAH 组比较,依达拉奉组磷酸化JNK免疫阳性反应减弱,染色变浅,Beclin-1和LC3-Ⅱ免疫阳性反应增强(图2,表3~5)。

表3 各组大鼠海马区磷酸化JNK阳性细胞数比较(n=5,±s,个/高倍镜视野)
*P<0.05vssham;△P<0.05vsSAH

表4 各组大鼠海马区Beclin-1阳性细胞数比较(n=5,±s,个/高倍镜视野)
*P<0.05vssham;△P<0.05vsSAH

表5 各组大鼠海马区LC3-Ⅱ阳性细胞数比较(n=5,±s,个/高倍镜视野)
*P<0.05vssham;△P<0.05vsSAH
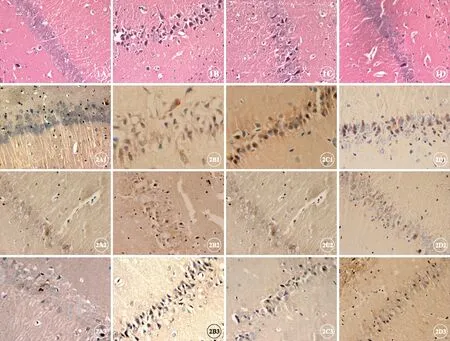
图1 各组大鼠海马区神经元形态的变化,H-E染色,×400。A: Sham组72h;B: SAH组72h;C: SAH组72h;D: 依达拉奉组72h.
图2 各组大鼠海马区JNK(A1~D1)、Beclin-1(A2~D2)和LC3-Ⅱ(A3~D3)表达情况,免疫组织化学,×400。A: 假手术组;B: SAH组;C: SP600125组;D: 依达拉奉组.
Fig 1 The morphological changes of neurons in hippocampus in each group, H-E staining, ×400. A: Sham group 72h; B: SAH group 72h; C: SP600125 group 72h; D: Edaravone group 72h.
Fig 2 The expression of JNK (A1-D1), Beclin-1 (A2-D2) and LC3-Ⅱ (A3-D3) in the hippocampal neurons among each group, Immunohistochemistry, ×400. A: Sham group; B: SAH group; C: SP600125 group; D: Edaravone group.
2.4 磷酸化JNK、Beclin-1和LC3-Ⅱ实时荧光定量PCR
与Sham组比较,SAH 组各磷酸化JNK mRNA、Beclin-1 mRNA和LC3-Ⅱ mRNA表达水平增加(P<0.05);与SAH 组比较,SP600125组磷酸化JNK mRNA表达水平降低,Beclin-1 mRNA和LC3-Ⅱ mRNA表达水平增强(P<0.05);与SAH 组比较,依达拉奉组磷酸化JNK mRNA表达水平降低,Beclin-1 mRNA和LC3-Ⅱ mRNA表达水平增强(P<0.05); 依达拉奉组和SP600125组间磷酸化JNK mRNA、Beclin-1 mRNA和LC3-Ⅱ mRNA表达,差异无统计学意义(P>0.05)(表6~8)。

表6 各组大鼠海马区神经元磷酸化JNK mRNA表达水平(n=5,±s)
*P<0.05vssham;△P<0.05vsSAH

表7 各组大鼠海马区神经元Beclin-1 mRNA相对表达水平(n=5,±s)
*P<0.05vssham;△P<0.05vsSAH

表8 各组大鼠海马区神经元LC3-Ⅱ mRNA相对表达水平(n=5,±s)
*P<0.05vssham;△P<0.05vsSAH
3 讨论
本研究结果显示依达拉奉可减轻SAH大鼠海马区神经细胞丢失,改善动物行为学障碍,说明依达拉奉对SAH大鼠有较好的保护作用。SAH后存在氧自由基连锁反应,这种氧自由基连锁反应不仅是SAH早期神经细胞损伤的关键[9],同时加重了SAH迟发性血管痉挛;氧化应激水平与SAH损伤程度呈正相关[10],因此给予具有较强抗氧化、清除自由基作用的依达拉奉对SAH诱导神经损伤有较好保护作用。
JNK信号被认为是介导细胞损伤的重要通路。研究显示SAH早期JNK即可激活,激活的JNK不仅介导SAH早期神经细胞凋亡线粒体通路,且与SAH后迟发性血管痉挛密切相关[11]。SAH模型中,应用JNK抑制剂可减少大鼠脑内caspase-3、caspase-8以及细胞色素C等凋亡因子的表达水平,且大鼠血脑屏障破坏和脑水肿有很大程度的缓解[12]。自噬是指细胞通过溶酶体途径对功能受损的白质和细胞器进行识别、降解和修复的现象,在细胞发生应激时的生存机制中起决定性作用。研究显示脑损伤状态下,自噬具有“双刃剑”作用,适度自噬激活能够清除细胞内异常蛋白质及受损细胞器,调节能量代谢,减轻细胞损伤程度,降低神经细胞死亡的发生率;但过度的自噬可以促进caspase-3裂解,加重神经细胞死亡[13]。Zhao等[14]通过改良的颅内动脉穿刺法建立蛛网膜下腔出血模型,应用自噬抑制剂3-甲基腺嘌呤进行预处理,显示脑组织含水量和血脑屏障渗透率进一步加剧及神经细胞凋亡,神经功能评分下降。本实验结果显示JNK抑制剂SP600125组,死亡神经细胞数量明显降低,Beclin-1和LC3-Ⅱ蛋白表达增高,说明JNK激活参与SAH后自噬的调节。Yan等[15]在糖尿病GK大鼠模型研究中表明,JNK信号通路可以通过介导P53的磷酸化而达到调控自噬的目的。Li等[16]研究显示硼替佐米可以通过促进自噬而起到对头颈部鳞癌的治疗作用。本研究依达拉奉组磷酸化JNK表达减少, Beclin-1和LC3-Ⅱ的表达增加,依达拉奉可抑制JNK通路激活,提高神经元自噬水平,对SAH具有神经保护作用。值得注意的是,本研究依达拉奉组海马区神经细胞存活率显著高于SP600125组,而两组间磷酸化JNK、Beclin-1和LC3-Ⅱ蛋白水平无明显差异,提示依达拉奉的神经保护作用不完全依赖JNK-自噬途径。依达拉奉是目前氧自由基清除能力最为强大的神经保护剂,研究证实依达拉奉可调整线粒体和内质网应激,有效拮抗脑损伤后神经细胞丢失,促进神经恢复[17]。
综上所述,本研究结果表明JNK的活化可降低SAH大鼠海马区神经细胞自噬水平,依达拉奉可抑制JNK活化,提高SAH大鼠海马区神经细胞自噬水平,减轻SAH大鼠海马区神经细胞损伤。本研究结果为依达拉奉在颅脑损伤救治的应用提供了一定的理论依据。