烟曲霉对人急性单核细胞白血病细胞系产生肿瘤坏死因子α、活化信号分子p38丝裂原活化蛋白激酶的影响
童建波 杜蕾蕾 曾荣 王丽玮 刘宇甄 段志敏 陈青 李岷
210042南京,中国医学科学院 北京协和医学院 皮肤病研究所 江苏省皮肤性病分子生物学重点实验室(童建波、杜蕾蕾、曾荣、王丽玮、刘宇甄、段志敏、李岷);江苏省血液中心(陈青)
由于广谱抗菌药物、糖皮质激素和免疫抑制剂的广泛使用,放疗和化疗、器官移植以及侵入性治疗措施的急剧增加,艾滋病等免疫缺陷性疾病的流行,近年来侵袭性曲霉病的发病率快速上升[1],致死率可高达50%~95%,而烟曲霉是最常见的致病菌[2]。宿主单核巨噬细胞作为固有免疫中重要的反应细胞,能识别并清除入侵的烟曲霉[3]。本研究旨在探讨烟曲霉能否激活人急性单核细胞白血病细胞系(THP⁃1)的信号分子p38丝裂原活化蛋白(MAPK)及诱导肿瘤坏死因子α(TNF⁃α)的分泌。
材料和方法
一、 菌株、细胞和主要试剂
烟曲霉Af293(ATCC MYA⁃4609,CBS 101355)、THP⁃1细胞株购自美国模式培养物集存库(ATCC)。兔抗人p38MAPK和磷酸化p38MAPK抗体(美国Cell Signaling Technology公司);iTaq通用型SYBR Green预混液(美国Bio⁃rad公司);PrimeScript RT Master Mix反转录酶试剂盒(日本TaKaRa公司);TNF⁃α酶联免疫吸附试剂盒(深圳欣博盛生物科技有限公司);丙二醇甲醚醋酸酯(PMA)、β-葡聚糖、p38MAPK抑制剂SB2035805(美国Sigma公司)。
二、 细胞培养
烟曲霉Af293在蛋白胨沙氏琼脂培养基(SDA)上37℃培养3d,收集烟曲霉孢子,经56℃60 min水浴灭活后,配制成不同浓度菌悬液待用。THP⁃1细胞用含10%胎牛血清、1%青链霉素的RPMI 1640培养基培养,于37℃、5%CO2细胞培养箱中培养、传代。将THP⁃1细胞制备成2×105个/ml细胞悬液,接种于6孔细胞培养板(每孔2ml)及12孔细胞培养板(每孔1ml),加入100 mg/L PMA刺激48h后,加入106和107CFU/ml灭活烟曲霉菌悬液共培养。
三、 实时荧光定量反转录PCR法检测烟曲霉与THP⁃1细胞共孵育不同时间点TNF⁃α mRNA表达水平
106和107CFU/ml烟曲霉与2 × 105/ml THP⁃1细胞共孵育(106和107CFU/ml烟曲霉组),并设空白对照组(不加任何刺激,仅用培养基处理THP⁃1细胞)和阳性对照β-葡聚糖组(采用阳性刺激物100 mg/L β-葡聚糖孵育THP⁃1细胞),分别培养1、3、6h。根据预实验,刺激6h后TNF⁃α mRNA表达水平达到最高,继续延长作用时间后其表达水平开始降低。
根据上述实验结果,选择刺激效果最强的6h作为观察时间,选择107CFU/ml烟曲霉作为刺激浓度。设置p38MAPK抑制剂SB203580阻断组,即20 μmol/L SB203580预先与THP⁃1细胞共培养2h后,再用107CFU/ml烟曲霉、β-葡聚糖或培养基作用6h。同时设立SB203580未阻断组,即仅采用107CFU/ml烟曲霉、β-葡聚糖或培养基作用THP⁃1细胞6h,检测各组TNF⁃α mRNA表达水平。
采用Trizol法抽提各组THP⁃1细胞总RNA,按PrimeScript RT Master Mix反转录酶试剂盒说明书将1 μg总RNA反转录为cDNA。使用实时定量PCR仪7300型(美国ABI公司),采用SYBR green法对目的基因进行扩增。以β肌动蛋白作为内参照,引物TNF⁃α及β肌动蛋白由生工生物工程(上海)股份有限公司合成。引物序列TNF⁃α上游5′⁃CGAGTGAC AAGCCTGTAGC⁃3′,下游5′⁃GGTGTGGGTGAGGAG CACAT⁃3′,β肌动蛋白上游5′⁃TCTGGCACCACACC TTCTA⁃3′,下游 5′⁃AGGCATACAGGGACAGCAC⁃3′。反应条件:预变性95℃10 min,变性95℃15 s,退火60℃ 30 s,延伸72℃ 30 s,循环数40。采用2⁃ΔΔCt法计算目的基因的变化水平。
四、 酶联免疫吸附试验(ELISA)检测培养上清液中TNF⁃α含量
107CFU/ml烟曲霉菌悬液(烟曲霉组)、β-葡聚糖(β-葡聚糖组)刺激THP⁃1细胞24h,同时设立仅培养基孵育THP⁃1细胞的空白对照组,按照试剂盒说明书检测培养上清液中TNF⁃α含量。
五、 Western印迹法检测p38MAPK和磷酸化p38MAPK的表达
107CFU/ml烟曲霉菌悬液分别作用THP⁃1细胞15、30、60 min,并设置仅培养基孵育THP⁃1细胞的空白对照组。收集各组THP⁃1细胞,裂解细胞,提取总蛋白。等量蛋白的不同样品梯度十二烷基硫酸钠(SDS)-聚丙烯酰胺凝胶电泳分离,电转至聚偏二氟乙烯膜上。5%牛血清蛋白(BSA)封闭2h,兔抗人单克隆抗体4℃孵育过夜。TBST液洗膜3次,辣根过氧化物酶标记的山羊抗兔IgG第二抗体反应2h,TBST液洗膜3次,增强型化学发光Supersignal®试剂显色发光,检测p38MAPK和磷酸化p38MAPK的水平。
六、 统计学处理
结 果
一、 烟曲霉对THP⁃1细胞TNF⁃α mRNA水平的影响
烟曲霉刺激THP⁃1细胞后3、6h,经双因素方差分析,106和107CFU/ml烟曲霉组、β-葡聚糖组、空白对照组TNF⁃α mRNA表达水平差异有统计学意义(F=110.983,P< 0.001,v=3)。见表1。106和107CFU/ml烟曲霉、β-葡聚糖作用THP⁃1细胞后,TNF⁃α mRNA水平在3h出现上升,6h上升更明显,即THP⁃1细胞TNF⁃α mRNA水平随培养时间延长而增高(F=701.680,P< 0.001,v=2)。LSD⁃t检验显示,刺激后3h,107CFU/ml烟曲霉组和β-葡聚糖组TNF⁃α mRNA水平显著高于空白对照组(均P<0.01),而刺激后 6h,106和 107CFU/ml烟曲霉组及β-葡聚糖组均显著高于空白对照组(均P<0.001)。刺激后1、3、6h,106CFU/ml烟曲霉组与β-葡聚糖组间TNF⁃α mRNA水平差异无统计学意义(P>0.05)。107CFU/ml烟曲霉作用THP⁃1细胞6h后,TNF⁃α mRNA表达水平明显高于106CFU/ml烟曲霉组及β-葡聚糖组(均P<0.01)。见表1。
表1 烟曲霉对THP⁃1细胞肿瘤坏死因子α mRNA表达水平的影响(2⁃ΔΔCt± s)
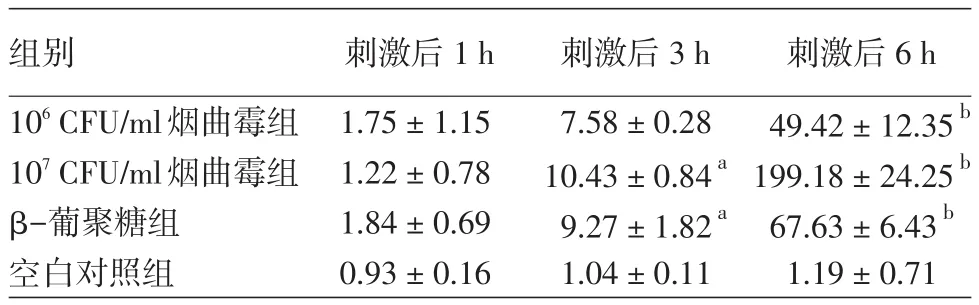
表1 烟曲霉对THP⁃1细胞肿瘤坏死因子α mRNA表达水平的影响(2⁃ΔΔCt± s)
注:n=3。与同时间点空白对照组比较,aP<0.01;bP<0.001
组别106CFU/ml烟曲霉组107CFU/ml烟曲霉组β-葡聚糖组空白对照组刺激后1h 1.75±1.15 1.22±0.78 1.84±0.69 0.93±0.16刺激后3h 7.58±0.28 10.43±0.84a 9.27±1.82a 1.04±0.11刺激后6h 49.42±12.35b 199.18±24.25b 67.63±6.43b 1.19±0.71
二、 烟曲霉对THP⁃1细胞TNF⁃α蛋白分泌的影响
107CFU/ml烟曲霉刺激THP⁃1细胞后24h,烟曲霉组、β-葡聚糖组、空白对照组上清液中TNF⁃α蛋白含量分别为(6 236.30±437.12)、(3 011.08±312.00)、(132.10± 0.61)ng/L。经单因素方差分析,3组间差异有统计学意义(n=9,F=71.25,P<0.01)。烟曲霉组和β-葡聚糖组均明显高于空白对照组(P<0.01、<0.05),烟曲霉组高于β-葡聚糖组(P< 0.01)。
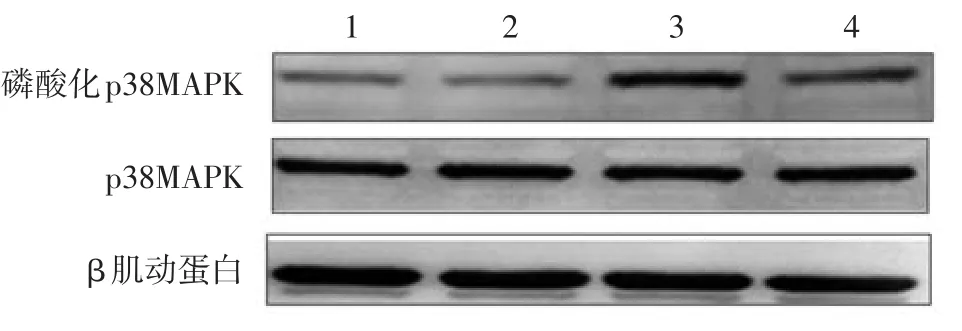
三、 烟曲霉对THP⁃1细胞p38MAPK激活的影响
107CFU/ml烟曲霉刺激后30 min,与空白对照组相比,磷酸化p38MAPK蛋白水平已明显升高,60 min时开始减弱;而p38MAPK蛋白水平在刺激后30 min、1h均无明显变化。见图1。
四、p38MAPK信号通路抑制剂SB203580对烟曲霉上调TNF⁃α mRNA水平的影响
使用SB203580后,烟曲霉组和β-葡聚糖组TNF⁃α mRNA表达水平均较使用前显著降低(P<0.01)。见表2。
表2 p38MAPK信号通路抑制剂SB203580对烟曲霉上调THP⁃1细胞TNF⁃α mRNA水平的影响(±s)

表2 p38MAPK信号通路抑制剂SB203580对烟曲霉上调THP⁃1细胞TNF⁃α mRNA水平的影响(±s)
注:n=3。a与空白对照组比较,P<0.001;b与未用SB203580阻断组比较,P<0.01
组别烟曲霉组β-葡聚糖组空白对照组未用SB203580 187.23±21.62a 62.14±2.36a 1.13±0.36加SB203580 3.83±0.62b 5.26±1.39b 1.08±0.25
讨 论
外来病原体入侵机体时,启动固有性和适应性免疫反应,形成稳固复杂的免疫网络,清除致病菌。巨噬细胞等固有免疫细胞通过细胞表面或内部的模式识别受体识别暴露于病原微生物表面的病原相关分子模式,启动快速的炎症信号转导通路,分泌大量炎症细胞因子和趋化因子,触发细胞的吞噬作用、呼吸爆发等功能,进而启动适应性免疫反应,促进机体对真菌病原体的清除。作为抗感染免疫反应的第一道防线,单核巨噬细胞对识别、清除入侵的烟曲霉起重要作用[4⁃5]。TNF⁃α主要由活化的单核巨噬细胞产生,是炎症起始阶段非常关键的炎性细胞因子。体外试验表明[6],TNF⁃α能增强肺泡巨噬细胞对分生孢子的特有吞噬作用以及中性粒细胞对真菌菌丝的破坏作用,拮抗TNF⁃α作用会导致感染烟曲霉的试验小鼠死亡率增高、肺部霉菌负荷增高,而TNF⁃α增效剂提高了其生存率。多项研究显示[7⁃8],接受抗TNF治疗的患者更加容易罹患念珠菌病、曲霉菌病、组织胞浆菌病等深部真菌感染。
本研究初步发现,两种浓度的烟曲霉作用THP⁃1细胞后,均上调TNF⁃α mRNA水平,并呈现时间依赖效应。在刺激3h后TNF⁃α mRNA水平上升,刺激6h后106CFU/ml烟曲霉组mRNA水平约为3h的6.5倍,而107CFU/ml组则升高将近20倍。本研究采用β-葡聚糖作为激活THP⁃1细胞的阳性对照物,发现其也能诱导出相同的时间依赖效应,刺激6h后TNF⁃α mRNA水平比3h组上升6.3倍。107CFU/ml烟曲霉作用THP⁃1细胞24h后,上清液中TNF⁃α含量明显升高,表明烟曲霉不仅在mRNA水平诱导THP⁃1细胞上调TNF⁃α的转录,而且在蛋白水平提高该因子的分泌量。
研究发现[9⁃10],在烟曲霉感染过程中,巨噬细胞可以通过其表面的C型凝集素受体1(Dectin⁃1)、Toll样受体2(TLR⁃2)和NOD样受体2(NOD2)促进TNF⁃α的释放。p38MAPK分子是细胞内的一类丝氨酸/苏氨酸蛋白激酶,存在于大多数细胞内,主要分布于细胞质中,是真核细胞转导细胞外信号到细胞内引起细胞反应的一类重要信号系统[11]。p38MAPK作为MAPK家族成员之一,当细胞接受适宜刺激后,p38MAPK被激活后可使一些转录因子,如转录活化因子1(ATF⁃1)、ATF⁃2、环磷腺苷效应元件结合蛋白及转录激活蛋白的丝氨酸和苏氨酸位点磷酸化,激活后可以转位到细胞核内,从而调节靶基因的表达。p38MAPK的激活可诱导多种基因的表达,共同调节炎症反应,是促进TNF⁃α产生的重要活化分子[12]。吡啶异咪哒唑化合物SB203580是p38MAPK激酶特异性抑制剂,能竞争性结合到p38α、p38β的ATP结合位点上,抑制其磷酸化,导致p38MAPK失去激酶活性,从而有效抑制p38MAPK信号通路的转导[13⁃14]。本实验结果显示,烟曲霉刺激后15 min即出现p38MAPK蛋白磷酸化,30 min时p38MAPK磷酸化水平显著升高。表明烟曲霉刺激人THP⁃1细胞后可出现p38MAPK蛋白磷酸化。进一步通过p38MAPK信号通路的特异性抑制剂SB203580阻断信号通路,发现TNF⁃α mRNA表达水平较未用SB203580组明显减低。实验中选择类似于人体内单核巨噬细胞系的THP⁃1细胞,可以在体外一定程度上模拟烟曲霉感染人体、侵犯机体固有免疫系统的过程。烟曲霉对人THP⁃1细胞刺激后可诱导p38MAPK途径出现活化,TNF⁃α在mRNA水平、蛋白水平表达量升高,并且在一定程度内呈现剂量依赖性、时间依赖性。表明单核细胞可能参与抗烟曲霉感染固有免疫反应。

