吡啶甲酸铬衍生物的合成、安全性及降糖活性
柴 杰 杨斌盛 刘 斌
(山西大学分子科学研究所,化学生物学与分子工程教育部重点实验室,太原 030006)
金属有机配合物由于其良好的生物活性常被应用于各种疾病的治疗并得到广泛的研究[1],如抗癌[2-4]、抗菌[5]及抗Ⅱ型糖尿病等[1]。上世纪五十年代,Crバ首次被发现能够有效地降低糖尿病小鼠血糖并改善糖尿病状况,因此被认为是一种必需微量元素[6]。本课题组也在21世纪初开始对Crバ化学的研究并初步取得进展[7-11]。此后很长的一段时间内Crバ被广泛应用于营养品及食品添加剂。以吡啶甲酸铬Cr(pic)3为主的Crバ配合物销售额达一亿多美元,在同类营养品添加剂中仅次于Caギ的销量[12]。近年来随着人们对Cr(pic)3配合物研究的深入,发现其可能存在潜在毒性:Cr(pic)3在还原剂存在下会导致质粒的损伤,同时Cr(pic)3给药会导致淋巴球细胞凋亡并使DNA断裂[13-16]。Peter认为该配合物对细胞的损伤可能归因于Crバ在氧化剂与还原剂共同存在下能够通过Fenton-like反应诱发生成·OH进而损伤DNA[17-18]。Rogers等认为Crバ与配体配位后,Crバ/Crギ的氧化还原电位发生改变使得Crバ能够参与到Fenton-like反应中,作为一个电子给体为该过程提供电子进而产生活性氧[17]。我们推测通过改变Cr(pic)3的取代基或结构有可能改变其氧化还原性进而降低其潜在毒性。
虽然在本世纪初Vencent提出Crバ的缺失不会直接导致任何疾病,得出了Crバ并不是人体必需微量元素的观点。但几乎所有的研究均表明Crバ可以有效控制糖尿病群体的血糖水平[19]、抑制平滑肌细胞非正常增殖且具有抗动脉粥样硬化的效果[20-22]。近期Vincient等研究又发现Crバ可以放大胰岛素信号,充当第二信使的作用[23],同时Raman等研究发现Cr(pic)3能够抑制糖尿病小鼠血小板反应蛋白(TSP-1)的表达,具有抗动脉粥样硬化的潜在应用价值[20]。因而高效低毒Cr(pic)3衍生物的合成及性质研究对于糖尿病及心脑血管病的辅助治疗仍具有重大意义。
基于以上研究,本文以Cr(pic)3为主体结构,选取了包含有不同取代基团的吡啶甲酸衍生物合成了4种Crバ配合物,通过单晶衍射、元素分析、电喷雾质谱 (ESI-MS)等手段对配合物的结构进行了表征;采用循环伏安法研究了配体对配合物的氧化还原活性的影响,采用Fenton-like反应及动物急毒性实验评估了配合物的潜在毒性,通过降糖活性实验研究了该类衍生物的抗糖尿病活性,分析了其构效关系。发现所合成的配合物中基于三氟甲基-吡啶-2-甲酸(5-CF3-pic)的配合物3与Cr(pic)3相比具有更高的安全性及更好的降血糖效果,即通过改变Cr(pic)3结构可以提高其降糖效果。
1 实验部分
1.1 试剂和仪器
5-氨基-吡啶-2-甲酸(5-NH2-pic)、2-萘硼酸频那醇酯、5-溴-吡啶-2-甲酸(5-Br-pic)、5-三氟甲基-吡啶-2-甲酸(5-CF3-pic)、3-甲基-吡 啶-2-甲 酸(3-CH3-pic)、九水合硝酸铬(Cr(NO3)3·9H2O)、三乙胺(TEA)、磷酸氢二钠(Na2HPO4)、柠檬酸及其他溶剂等试剂均为分析纯。
D8 Venture X射线单晶衍射仪(Bruker,Germany),Vario ELⅢ元素分析仪,Agilent 6520 Accurate-Mass QTOF LC/MS质谱分析仪,Bruker TENSOR 21傅里叶变换红外光谱仪,电热式恒温水浴锅(天津市泰新特仪器),CHI 660C电化学工作站(上海辰华),玻碳电极(直径 3.0mm)。
1.2 配合物合成
1.2.1 配合物1的合成
将5-NH2-pic(0.414 0 g,3.0 mmol)溶于蒸馏水(15 mL), 逐滴加入 Cr(NO3)3·9H2O(0.400 0 g,1.0 mmol),加热回流1.0 h,得紫色沉淀。冷却、过滤、洗涤得到配合物1。元素分析按C18H15CrN6O6计算的理论值(%):C 46.66,H 3.26,N 18.14;实测值(%):C 46.54,H 3.65,N 18.02。 ESI-MS(m/z):[M+H]+464.0517(图S1)。 IR(cm-1):3 437、3 332、1 589(-NH2),1 664(-C=O),1 358、1 296(-C-N)及 447(Cr-N)(图 S2)。
1.2.2 配合物2的合成
2-萘-硼酸频那醇酯(0.387 0 g,1.5mmol),5-Brpic(0.202 0 g,1mmol),K2CO3(0.276 0 g,2.0 mmol)及Pd(Ph3)4(40 mg)溶于 1,4-二氧六环(25 mL),在氮气保护下85℃回流12 h得到浅黄色固体。所得到的固体采用柱色谱 (V乙酸乙酯∶V石油醚=2∶1)分离得到配体L1,ESI-MS(m/z):[M+H]+250.086 4(图 S3)。 取配体L1(0.187 85 g,0.75 mmol)及 Cr(NO3)3·9H2O(0.100 0 g,0.25mmol)在乙醇溶液中加热回流1 h得到白色粉末。洗涤,烘干得到配合物2。元素分析按C48H30CrN3O6计算的理论值 (%):C 72.36,H 3.80,N 5.27;实测值(%):C 72.28,H 3.92,N 5.19。 ESI-MS(m/z):[M+H]+797.1612(图 S4)。IR(cm-1):3 055(=C-H),1 684(-C=O),1 325、1 160(C-F)与 478(Cr-N,Cr-O)(图 S5)。
1.2.3 配合物3的合成
向回流中的 5-CF3-pic(0.382 0 g,2.0 mmol)及三乙胺(TEA,40μL)蒸馏水混合溶液中逐滴加入Cr(NO3)3·9H2O(0.400 0 g,1.0 mmol)继续回流 1 h 得到紫色沉淀。所得到的紫色沉淀过滤、洗涤、干燥并用DMSO重结晶得到适合于X射线单晶衍射的晶体,其晶体结构如图1所示。元素分析按C38H46Cr2F12N4O16S5计 算 的 理 论 值 (%):C 34.92,H 3.55,N 4.29;实测值(%):C 34.83,H 3.68,N 4.34。 ESI-MS(m/z):[M+H]+898.442 6(图 S6)。 IR(cm-1):3 376(-OH),3 059(=C-H),1 684(-C=O),542、513、426(Cr-N,Cr-O)(图 S7)。 电导率:16.5 μS·cm-1(1mmol·L-1,DMSO)。
1.2.4 配合物4的合成
3-CH3-pic(0.274 0 g,2.0 mmol)与 NaOH(0.08 g,2.0mmol)混合溶液加热回流至完全溶解后逐滴加入 Cr(NO3)3·9H2O(0.400 0 g,1.0 mmol)得到紫色沉淀。过滤、洗涤、干燥得到紫色产物。元素分析按C28H26Cr2N4O10计算的理论值(%):C 49.27,H 3.84,N 8.21;实测值(%):C 48.88,H 4.02,N 8.24。 ESI-MS(m/z):[M+H]+683.051 1(图 S8);IR(cm-1):3 419(-OH),1 643(-C=O),1 332(C-N),547,453(Cr-N,Cr-O)(图S9)。电导率:18.5 μS·cm-1(1mmol·L-1,DMSO)。

路线1 配合物1~4的合成路线Scheme 1 Synthetic routes for complexes 1~4
1.3 晶体结构的测定
配合物3的单晶结构数据以Mo Kα射线(λ=0.071 073 nm)为光源采用Bruker D8 Venture X射线单晶衍射仪并采用Bruker SMART进行收集。所收集到的数据通过Lp因子和经验吸收校正并通过直接法及最小二乘法解出且利用SHELXL-97[24]解析结构并对数据进行精修。对所有非氢原子坐标及其各向异性温度因子进行了全矩阵最小二乘法精修,氢原子坐标通过理论加氢法给出。配合物的晶体数据在表1列出。
CCDC:1500277,3。

表1 配合物3的晶体结构数据Table 1 Crystal data and structure refinements of complex 3
1.4 电化学研究
配合物 1~4(1.0mmol·L-1)的循环伏安特性曲线在DMSO溶液中进行采集。循环伏安实验采用三电极电解池,工作电极:玻碳电极,参比电极:甘汞电极,辅助电极:铂网。实验在氮气保护下进行,支持电解质:四丁基过氯酸胺 (TBAP,0.10mol·L-1);扫描范围:-0.8~-2.3 V;扫描速度:50mV·s-1。
1.5 Fenton-like反应
配合物 1~4(100 μmol·L-1)羟基自由基(·OH)的产生通过Fenton-like反应进行测定。空白对照:缓冲;标准对照:Fe-EDTA;配合物对照:吡啶甲酸铬(Cr(pic)3)。 配合物在抗坏血酸(10mmol·L-1)及双氧水(100μmol·L-1)共同存在下生成·OH并对脱氧核糖(0.4mol·L-1)进行切割生成丙二醛。随后通过2-硫代巴比妥酸显色法测定反应溶液在532 nm处的吸光度,溶液的吸光度与所产生的羟基自由基成正比[25]。
1.6 急性毒性及降糖活性
该实验委托山西医科大学第一医院病理科完成。将体重为20~30 g的健康C57小鼠随机分配为4 组(空白组:DMSO,1%(V/V)),阳性对照组:Cr(pic)3,金属离子对照组:Cr(NO3)3,实验组:配合物3,保证每组小鼠中雌雄小鼠的数目相。急性毒性实验给药量为1.0 gCr·kgBW-1(BW表示小鼠体重),并在给药的1周时间内观察小鼠的进食状况、活动行为并记录体重。给药完成后对小鼠采用二氧化碳安乐死,取器脏切片染色观察。
降糖活性实验中采用链脲佐菌素(STZ,50 mg·kgBW-1)诱导与高脂饲料喂养来构建糖尿病模型小鼠并通过空腹血糖(FBG)含量确定所构建模型是否成功(FBG levels≥11.1mmol·L-1表示模型构建成功)。实验中共5组(正常组:非糖尿病小鼠,空白对照组:糖尿病小鼠(1%(V/V)DMSO),阳性对照组:Cr(pic)3,金属离子对照组:Cr(NO3)3及实验组:配合物3且配合物的给药量为1.0mgCr·kgBW-1,给药方式为灌胃给药。实验过程为期8周,期间小鼠均可自由进食及饮水。在实验初期、给药4周及给药8周分别记录小鼠的体重(BW)、空腹血糖(FBG)、空腹胰岛素(FINS)、总胆固醇(TC)、总甘油三酯(TG)、低密度脂蛋白(LDL)及高密度脂蛋白(HDL)等生理参数。
2 结果与讨论
2.1 结构描述与讨论
根据文献报道方法合成了4种全新的配合物1~4[26],获得了3号化合物的单晶结构。具体结构示意图见Scheme 1。由元素分析可知,配合物1与2中配体与金属离子的物质的量之比为1∶3,而配合物3与4的配体与金属离子的物质的量之比为1∶2;配合物 3和 4的电导率低于 20 μs·cm-1(1mmol·L-1,DMSO),均呈电中性结构;均通过电喷雾质谱确定了配合物的分子量。在3与4的IR光谱中不仅观察到了Cr-N及Cr-O的特征吸收,同时观察到-OH振动峰的存在。推断1和2为单核结构,与我们先前所合成吡啶甲酸铬配合物结构相似[27],即每个金属离子与3个吡啶甲酸配体以CrN3O3的配位模式形成一个六配位八面体结构;而3与4是由2个羟基桥联而成的双核结构。

图1 配合物3的分子结构椭球图(a)和结构式(b)Fig.1 ORTEP structure(a)and chemical structure(b)of complex 3
单晶结构分析结果表明配合物3是一个由羟基桥联的双核Crバ配合物。在配合物3的晶体结构中,内界由4个5-CF3-pic配位分子,2个金属Crバ及2个羟基组成羟基桥联结构,外界有5个DMSO溶剂分子和1个水分子,整个分子呈电中性。配合物的晶胞结构中每个金属离子与4个氧原子(2个来自5-CF3-pic,2个来自羟基氧原子)及2个氮原子(来自5-CF3-pic)配位形成一个畸变的六配位八面体,其中Cr-O键平均键长为0.195 4 nm,Cr-N键的平均键长为0.200 7 nm,2个Crバ离子间的距离为0.297 9 nm。配合物的晶体数据及部分键长、键角数据分别列于表1和表2中。

表2 配合物3的键长(nm)与键角数据(°)Table 2 Selected bond lengths(nm)and angles(°)of com plexes 3
2.2 配合物的循环伏安曲线
为探究取代基对配合物氧化还原性质的影响,我们记录了配合物1~4在-0.8~-2.3 V范围内的循环伏安特性曲线,实验结果如图2所示。循环伏安曲线中由高电位到低电位的氧化还原峰被依次定义为第1对、第2对和第3对氧化还原信号。从图中可以看出化合物1~4在所测定的电化学窗口范围内都表现出了良好的氧化还原特性:化合物1在所测定范围内出现了2对准可逆的氧化还原信号而配合物2、3和4出现了3对准可逆的氧化还原信号。化合物第1对氧化还原信号可归属为Crバ与Crギ的相互转化过程[28],ΔE 均大于 0.065 V(1,0.08 V;2,0.103 V;3,0.079 V;4,0.66 V), 因此该过程属于不完全可逆过程。配合物的第2对及第3对氧化还原信号被归属为金属离子存在下配体氧化还原的电位[28]。在三吡啶甲酸配位的配合物1与2中,1的氧化还原电位负于2;在羟基桥联的化合物3与4中,配合物3的电位正于4。同时,将配合物1和2的氧化还原电位与文献中所报道的Cr(pic)3(-1.26 V,-1.19 V)相比较[29],发现吡啶环上的吸电子基团(萘环)导致配合物氧化还原电位正移,而给电子基团(氨基)导致配合物氧化还原电位负移,该现象与先前所报道结论相一致[30]。除此以外,配合物1~4与吡啶甲酸铬相比表现出不同的氧化还原性质,因此可以用于进一步探究氧化还原性对于Crバ配合物生物毒性和活性的影响。

图2 配合物1~4在DMSO中的循环伏安特性曲线Fig.2 Cyclic voltammogram of 1~4 in DMSO

表3 配合物1~4的氧化还原电位Table 3 Redox potentials of comp lexes 1~4
2.4 配合物诱导自由基的产生
根据相关文献报道,生理条件下配合物诱发的自由基多少与配合物的氧化还原性质密切相关[17]。为初步探测配合物的潜在毒性,本文通过Fentonlike反应测定了配合物在PBS缓冲液中诱发产生的·OH。由图3a可知,配合物在发生Fenton-like反应并加入2-硫代巴比妥酸显色剂后在532 nm处产生特征峰。反应后样品在532 nm处的吸光度与样品中·OH的含量成正比,因此可用532 nm处的吸光度值代替表示样品生成自由基的量。由图可知不同实验组的溶液532 nm处的吸光度不同,即不同配合物诱发产生的·OH量不同:(1)所有配合物所产生的·OH均少于标准对照组;(2)配合物2~4产生的自由基略小于Cr(pic)3阳性对照组,其中配合物中3产生的·OH最少。由于·OH产生与Crバ/Crギ电位密切相关,随后以配合物Crバ/Crギ氧化还原电位平均值对·OH作图,研究了二者之间的相关性。由图3b可知,随着氧化还原电位的增大,样品产生的·OH量减小,即电位越正·OH的产生越少,这一现象与先前文献所报道相一致[32]。综上可知Crバ配合物的潜在毒性与其氧化还原电位密切相关:配合物的配位模式相同,即同样为单核或桥连时,吡啶环上取代基吸电子能力越强,配合物的氧化还原电位越正,所诱发出的自由基越少。

图3 (a)配合物在Fenton-like反应后在2-硫代巴比妥酸显色剂存在下的紫外-可见吸收光谱;(b)配合物的氧化还原电位平均值对样品在532 nm处的吸光度作图Fig.3 (a)UV-visible spectra of Crバcomplexes through Fenton-like reaction in PBS;(b)Plotof average potential againstabsorbance at532 nm
2.5 配合物的急性毒性评价
为进一步评估所得配合物的毒性,选取配合物3进行急性毒性实验研究(1.0 gCr·kgBW-1),Cr(NO3)3、Cr(pic)3为阳性对照。为期1周给药后取小鼠组织切片进行观察,在显微镜下所观察到的组织切片如图4所示。由图4可知,与未给药的空白组相比较,高剂量给药小鼠的肾脏、肝脏及胰腺等组织并未观察到明显的组织形态变化(注:图中所出现的一些外观差异是由于着色过程、切片选取或放大倍数不同导致的,配合物3的切片中出现的白色柱状物为暴露的胰腺导管),即小鼠的组织没有发生病理学意义上的变化,这种现象与文献报道相一致[33]。虽然发现配合物在体外试管实验中能诱发自由基的产生,但在生理条件下并没有表现出可观测到的毒性,说明即使配合物在体内局部产生一定量的自由基,也会被组织液中大量的还原性物质消耗掉[34],是在机体控制范围之内,因此不会对机体产生毒害作用。另外从试验期间小鼠体重变化发现,Cr(NO3)3、Cr(pic)3及配合物3给药后小鼠体重增长相对变缓,该现象表明高剂量Crバ在减肥方面可能发挥重要作用 (图5)。由此可知,Crバ在生物体内是低毒性或无毒性的,且具有减肥作用。

图4 急性毒性实验中Cr(NO3)3,Cr(pic)3以及配合物3给药后小鼠的肾脏,肝脏及胰腺组织切片Fig.4 Effects of Cr(NO3)3,Cr(pic)3 and complexes 3 on kidney,liver and pancreas tissue slices of themice in acute toxicity studies

图5 急性毒性实验中小鼠在0、3和7 d给药后小鼠的体重变化Fig.5 Bodymass alters ofmice after 0,3 and 7 d of treatment in acute toxicity study
2.6 配合物的降糖活性实验
选取潜在毒性较低的配合物3展开了配合物的降糖活性实验。分别在给药前、给药4周及给药8周时记录小鼠的与糖尿病相关的各项生理指标,包括空腹血糖(FBG)、空腹血清胰岛素(FINS)、总胆固醇(TC)、总甘油三酯(TG)、低密度脂蛋白(LDL)、高密度脂蛋白(HDL)及体重(BW)等数据,结果如图6、7所示。实验过程中所有小鼠均存活到最后阶段,行为正常。由图6a所示,相对于正常组而言,糖尿病小鼠的FBG指标明显升高。与糖尿病小鼠的空白组相比较,在Cr(NO3)3给药4周和配合物3给药8周后,均发现小鼠的FBG含量明显减低,而Cr(pic)3给药组小鼠FBG值变化不明显,由此可知配合物3的降糖活性优于市售的Cr(pic)3,但不及无机盐Cr(NO3)3。由图6b~6f可知,与正常小鼠相比,糖尿病小鼠的FINS、TC、TG及LDL值均明显升高,而HDL含量明显降低。在给药组中,发现仅有Cr(NO3)3组使小鼠的FINS、TC及LDL含量相对于空白组减小,其余配合物给药对除FBG含量以外其余各项生理指标影响甚微。除此而外,糖尿病小鼠与正常小鼠相比体重有明显的增长,但给药组并未对小鼠的体重造成明显的影响,或给药剂量不足以抑制小鼠的体重增长。需要说明的是,本次实验发现低剂量的Cr(pic)3降糖减肥的药效并不明显,与无机盐Cr(NO3)3相比,也并没有表现出明显的优势,一些文献此前也报道过类似的结果[35],该现象可能是由于灌胃给药后小鼠对Cr(NO3)3的生物利用率更高[36],毕竟Cr(pic)3的生物利用率不足2%,97%的Cr(pic)3随粪便排出体外[37]。

图6 Crバ配合物在为期8周的降糖实验中对糖尿病小鼠的空腹血糖 (a)、空腹血清胰岛素 (b)、总胆固醇(c)、总甘油三酯(d)、低密度脂蛋白 (e)及高密度脂蛋白(f)的影响Fig.6 Effectof Cr supplementation on fasting blood glucose(a),fasting serum insulin(b),Total cholesterol(c),Triglyceride(d),low density lipoprotein(e)and high density lipoprotein(f)ofmice
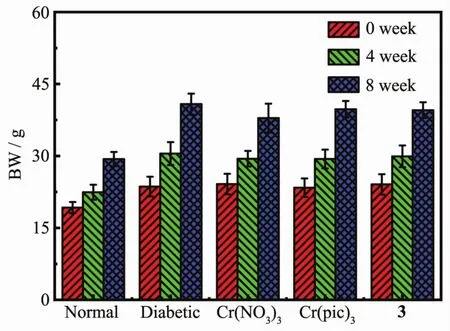
图7 降糖实验中实验组与对照组小鼠的体重变化Fig.7 Bodymass alters of the control and experimental groups after treatment in anti-hypoglycemic activity study
3 结 论
合成了4种吡啶甲酸铬衍生物并对其部分性质进行了研究,得到以下结论:(1)吡啶甲酸铬衍生物的氧化还原性与配体密切相关,吡啶环上的吸电子基团使Crバ/Crギ氧化还原峰位向高电位方向移动,而给电子基团使Crバ/Cギ氧化还原峰位向低电位方向移动;(2)配合物通过Fenton-like反应诱发产生自由基程度与配合物的氧化还原电位呈负相关,且本文制得的多数配合物所诱发的自由基量少于Cr(pic)3;(3)高剂量小鼠急性毒性实验表明吡啶甲酸铬衍生物安全性高,低剂量给药组中配合物3能够降低糖尿病小鼠空腹血糖含量及低密度脂蛋白,其效果比Cr(pic)3更为显著。因此,可以通过向Cr(pic)3的吡啶环上引入取代基团来实现改善Cr(pic)3的降糖及降脂的性能,吡啶甲酸结构的修饰对与吡啶甲酸铬降糖及降脂性能的改善具有重大影响。
Supporting information isavailable athttp://www.wjhxxb.cn

