串珠镰孢菌来源的角质酶基因的克隆表达及其酶学性质
陈志琳,林青君,王 鹏,叶秀云,李仁宽
(福州大学福建省海洋酶工程重点实验室,福建福州 350116)
角质层是控制植物与环境之间的屏障,它调节植物体温、水分交换、抵御病菌侵害和防止机械损伤[1]。角质是角质层的主要成分,可被角质酶高效降解;角质是一种不溶性的生物聚合物,主要有脂类单体组成,大部分存在于植物中[2]。不同物种角质的成分并不相同,如在一些高等植物叶片表面区域中,角质含量为20~600 μg/cm2,而在发育良好的某些果实表皮上,角质的含量能达到1.5 mg/cm2[3]。
角质酶是一种能降解角质的酶,角质酶来源很广,存在于真菌和细菌等微生物中[4-5]。天然角质酶主要有两个来源途径:一是真菌植物病原体霉菌,细菌以及放线菌;二是从花粉中分离纯化得到[6-8]。角质酶的分子量普遍较小[9],目前对真菌角质酶的研究最多,其相对分子量一般较小,为20~25 kDa左右,最适酶活温度一般为30~40 ℃,最适pH偏碱,通常为8~10。角质酶在食品也有着广泛的运用,可用于奶牛脂肪的水解;水果外层角质层降解加快脱水;可与蛋白酶复合使用去除烟草中的蛋白。目前国内外研究对真菌角质酶虽然得到了深入的研究,但仍存在基因工程异源表达时表达量较低和稳定性较差的问题,并且生产成本较高,至今为止没有实现工业化生产,同时真菌角质酶本身存在热稳定性差的缺点,不能适合高温处理环境,限制了角质酶的开发应用[10]。
本文通过筛选酶活较高的角质酶菌株,对该菌株进行克隆表达,并对其进行分离纯化和酶学性质研究,为角质酶的生产和应用打下基础。
1 材料与方法
1.1 材料与仪器
串珠镰孢菌(FusariummoniliformeSheld)从福建地区采集土壤样品筛选获得;大肠杆菌(E.coliDH5α)、毕赤酵母菌株(P.pastorisGS115) Invitrogen 公司。pMD-18 T TAKARA公司;pPIC9K Invitrogen公司;限制性内切酶(EcoR Ⅰ,NotⅠ)、T4 DNA 连接酶、DNA聚合酶 TaKaRa公司;MMLV第一链cDNA合成试剂盒,胶回收试剂盒,质粒抽提试剂盒 Sangon Biotech公司;D-半乳糖 国药集团化学试剂有限公司;DNS试剂参照文献[11]配制;Trizol试剂 Invitrogen公司。
T6新世纪紫外可见分光光度计 北京普析通用仪器有限责任公司;HWS24电热恒温水浴锅 上海一恒科技有限公司;THZ-82恒温振荡器 国华企业;BC/BD-320HCN卧式冷藏冷冻转换柜 海尔集团;TP-114分析天平。
1.2 实验方法
1.2.1 培养基的配制 LB 培养基:酵母膏5 g/L,蛋白胨10 g/L,NaCl 10 g/L,固体培养基再添加琼脂20 g/L;
BMMY培养基:酵母粉:1.0 g,蛋白胨:2.0 g,YNB:1.34 g,0.1 mol/L磷酸缓冲液,甘油:1.0 mL,蒸馏水定容至100 mL,pH为7.0;
RD培养基:1 M山梨醇,2%葡萄糖,1.34% YNB,4×10-5%生物素,0.005%氨基酸;
YPD培养基:1% 酵母膏,2% 蛋白胨,2%葡萄糖,若制固体培养基,加入2%琼脂。
1.2.2 高产角质酶菌株的筛选 从福建地区采集土壤样品,用无菌袋装好,-20 ℃保藏备用,初筛[12-13]:取10 g土样加入90 mL带有小玻璃珠的无菌生理盐水中,充分振荡后用无菌生理盐水进行梯度稀释。用移液枪分别吸取合适稀释度的稀释液0.1 mL涂布于筛选平板,于30 ℃培养数天,挑取单菌落进行平板划线分离纯化。将单菌落接种到角质酶筛选培养基上,30 ℃培养数天,观察菌落周围是否出现水解透明圈,并记录H/C值(透明圈直径/菌落直径)。
复筛[14-15]:将初筛得到的产角质酶菌株接种于种子培养基(装液量25 mL/100 mL)中,30 ℃,200 r/min培养12 h后,按1%(v/v)的接种量接入液体发酵培养基(装液量50 mL/250 mL),30 ℃,200 r/min培养,定期取样测定发酵上清液酶活力。
采用细菌16S rDNA通用引物从菌株的基因组DNA中扩增得到16S rDNA序列(PCR扩增条件:94 ℃ 5 min;94 ℃ 30 s,48 ℃ 30 s,72 ℃ 90 s,25个循环;72 ℃ 10 min),将PCR扩增得到的DNA片段在1%琼脂糖凝胶中进行电泳分离,用试剂盒回收纯化DNA直接送测。测序结果通过在NCBI中进行序列同源性比对分析,选取同源性较高的菌株利用Mega5.2构建系统进化树[16-18]。
1.2.3 产角质酶基因的克隆 按照Trizol试剂说明书,取串珠镰孢菌50 mg用液氮进行研磨,再加入0.5 mL的Trizol进行研磨使得样品裂解;加入0.2 mL的氯仿进行RNA提取;提取物经吸附柱进行纯化,最终获得纯的RNA。
参照第一链cDNA合成试剂盒产品说明将mRNA反转录成第一链cDNA。在20 μL体系中,加入1 μg总RNA、1μL Oligo dT18(500 μg/mL)和Rnase-free水,在70 ℃水浴温育10 min后,立即置于冰浴冷却;继续向冷却的管中加入4μL 5×Buffer、2 μL 0.1 M的DTT和1 μL 10 mmol/L的dNTPs,混匀后于42 ℃水浴保温2 min;再加入1 μL(200 U)反转录酶,42 ℃继续保温50 min;最后,置于70 ℃水浴保温15 min,灭活反转录酶,获得第一链cDNA。
根据NCBI检索获得串珠镰孢菌来源的角质酶基因并进行比对,设计角质酶基因的特异性引物。引物由上海生工合成。
上游引物1:ATGAAGTTCTCCATCATCTCTACTC
上游引物2:AAGGAATTCCTTCCCGCTGGTC AGGATG(下划线为EcoR I酶切位点)
下游引物3:AATTGCGGCCGCTCAAGCGGCTCC AGCAGCAT(下划线为Not I酶切位点)
以第一链cDNA为模板,用上游引物1和下游引物进行PCR扩增。扩增程序如下:95 ℃,3 min;95 ℃,30 s,60 ℃,30 s,72 ℃,1 min,30个循环;72 ℃延伸7 min。获得PCR扩增产物1,再以产物1为模板,用上游引物2和下游引物,按上述程序进行扩增,PCR产物用1.2%的琼胶糖电泳进行检测,回收与理论大小相同的基因片段。将纯化的目的基因进行TA克隆,选取阳性克隆子进行测序。
1.2.4 角质酶工程菌的构建及其在毕赤酵母中的表达 将测序正确的阳性克隆子质粒和pPIC9K质粒分别用EcoR Ⅰ和Not Ⅰ进行双酶切,回收目的基因和线性载体。用T4 DNA链接酶将角质酶目的片段和pPIC9K进行连接,获得重组质粒pPIC9K-Cut。用碱裂解法大量提取和纯化pPIC9K-cut质粒,并用限制性内切酶进行37 ℃保温,使质粒单限制性内切酶酶切线性化;参照毕赤酵母表达试剂盒操作说明,线性化后的质粒用电转化的方法转入pichia pastoris GS115细胞中;涂布在RD培养基中,置于28 ℃培养箱进行培养2~4 d。挑取平板上生长出来的菌落于液体YPD培养基中28 ℃培养过夜,按1%比例将菌液转入100 mL的小摇瓶,并将培养基替换成BMMY诱导培养基,并用1%甲醇进行诱导表达,诱导后收集表达上清,上清样品用15% SDS-PAGE电泳检测。挑遗嘱表达量较高的菌株在最优条件下进行诱导表达,每24 h取样,样品用于酶活力检测和蛋白浓度测定。
蛋白浓度的定量:利用BCA 蛋白质定量检测试剂盒测定蛋白浓度。
酶活力的测定:用连续分光光度计法,在30 ℃条件下,20 μL酶液加入980 μL 含50 mM对硝基苯丁酸脂(pNPB)、0.2%的Triton X-00、0.43 M的四氢呋喃,50 mmol/L的Tris-Hcl缓冲液中(pH8.0),在405 nm处,记录对硝基酚的生成速率。酶活定义:在30 ℃和pH8.0条件下,每分钟催化对硝基苯丁酸脂水解生成1 μmol对硝基酚的酶量即为一个酶活力单位。
1.2.5 重组角质酶的分离纯化 收集重组菌株发酵液上清100 mL,用55%硫酸铵进行盐析。10000×g,离10 min,去上清,取沉淀,用5 mL的25 mml/L pH7.4的磷酸盐缓冲液进行重悬。重悬后12000×g,离心15 min,取上清液用于下一步的纯化。
将盐析获得的样品用脱盐柱HiTrapTMDesalting,替换成25 mmol/L pH7.4磷酸缓冲液。将脱盐的收集样品用高效离子交换色谱(CM)进一步分离。分离纯化的条件如下:用平衡液平衡柱子后进行上样,并用平衡冲平上样柱,0~100%洗脱液梯度洗脱30 min,收集洗脱峰。平衡液:25 mmol/L pH7.4磷酸缓冲液;洗脱液:25 mmol/L pH7.4含1 mol/L NaCl的磷酸盐缓冲液;流速为1 mL/min;检测波长为280 nm。
经CM离子交换柱纯化收集的样品,用凝胶过滤注进行进一步分离纯化,并把收集的样品SDS-PAGE电泳检测。
1.2.6 重组角质酶的酶学性质研究
1.2.6.1 最适反应pH和pH稳定性 在37 ℃条件下,测定重组角质酶在不同pH5.0~11.0缓冲液体系中的酶活力:pH3.0~7.0的McIlvaine缓冲液(0.2 mol/L磷酸氢二钠/0.1 mol/L柠檬酸),pH7.0~9.0的0.1 mol/L的Tris-HCl缓冲液,以及pH9.0~11.0的0.1 mol/L的Gly-NaOH缓冲液。以测定的最高酶活力为100%,计算不同pH下的相对酶活力,确定最适反应pH。
将重组酶放在不同pH缓冲液中37 ℃水浴中保温1 h,在最适反应条件下测定酶活力。以未经保温的酶液为100%,计算各pH下的残余酶活力,确定该酶的pH稳定性。
1.2.6.2 最适反应温度和温度稳定性 在最适pH的条件下,测定酶液在不同温度(20、30、40、45、50、55、60 ℃)下的酶活力,以测定的最高酶活力为100%,计算不同温度下的相对酶活力,确定最适反应温度。
将酶液分别于不同温度水浴中保温,并在相应的时间点取样,测定该酶在最适反应条件下的酶活力。将未处理的酶液作为100%对照,计算各温度条件下重组酶的残余酶活力,确定该酶的温度稳定性。
1.2.6.3 金属离子和表面活性剂及抑制剂对角质酶活性的影响 在重组酶的最适反应条件下,在酶促反应体系中分别加入9种金属离子及5种表面活性剂及抑制剂(终浓度分别为10 mmol/L),包括:NaCl、KCl、MgSO4、BaCl2、CuSO4、FeSO4、ZnSO4、MnCl2、NiCl2,测定酶活力,以同样条件下未加金属离子和表面活性剂,抑制剂的酶促反应作为对照组,分析不同金属离子及表面活性剂及抑制剂对重组酶活性的影响。
1.3 统计分析
实验中每个处理重复3次,采用SPSS 17.0软件进行数据的显著性分析,应用Origin 7.0软件作图。
2 结果与分析
2.1 高产角质酶菌株的筛选
由表1可见,10株能产生透明圈的细菌中有4株菌具有角质酶活力,其中菌株K35酶活力最高,选取菌株K35进行菌种鉴定、酶学性质研究。

表1 产角质酶菌株的筛选结果Table 1 Screening of strains producing cutinase
2.2 串珠镰孢菌角质酶基因的克隆
提取串珠镰孢菌RNA,经反转录得到第一链cDNA,以cDNA为模板,用角质酶特异性引物进行PCR扩增。PCR产物经1.2%琼脂糖电泳检测,从图1中可以看到,一条清晰的、大小约为700 bp的特异性条带,角质酶基因的理论大小为693 bp左右,电泳图与理论值相近,初步确定为所需的目的条带。基因测序结果(图2)表明,该基因全长693 bp,编码231个氨基酸的成熟蛋白,经NCBI序列比对可确定为来源于串珠镰孢菌(FusariummoniliformeSheld)的角质酶蛋白。

图1 PCR扩增产物电泳图Fig.1 PCR product in cutinase gel

图2 角质酶基因核酸序Fig.2 Nucleic acid sequence of cutinase gene
2.3 重组角质酶的构建与表达
所获得的角质酶基因,经过酶切、连接和鉴定获得重组质粒,重组质粒被转入毕赤酵母GS115细胞中进行表达。摇瓶诱导筛选的表达上清经SDS-PAGE检测,在20.1 kDa附近有一表达条带,这与角质酶蛋白的理论大小21 kDa相近。一株高表达量的角质酶重组菌株用1%甲醇进行诱导表达,在表达过程中收集样品用于酶活测定和蛋白含量测定,表明在甲醇诱导96 h时,角质酶的活性为71.68 U/mL,蛋白表达量达到0.25 mg/mL。毕赤酵母表达系统是一个高效、稳定的表达系统,可以实现蛋白的分泌表达,易于实现产业化生产。角质酶基因在毕赤酵母中GS115实现了高效表达,这将解决角质酶工业化应用中产量不足的问题。
2.4 重组角质酶的分离纯化
表达的重组角质酶发酵液,经过硫酸铵沉淀、脱盐、离子交换色谱和分子筛纯化,图3为纯化过程中收集样品的SDS-PAGE电泳检测图谱,可见最终获得了电泳纯的重组角质酶蛋白,其大小约为20 kDa。表2为重组角质酶纯化过程,重组角质酶发酵液的比活力为286.6 U/mg,经过纯化得到比活为2490.1 U/mg的纯蛋白,纯化倍数为8.69。由毕赤酵母表达所得到的重组角质酶,易于分离纯化,步骤简单,能够获得高纯度的角质酶蛋白。
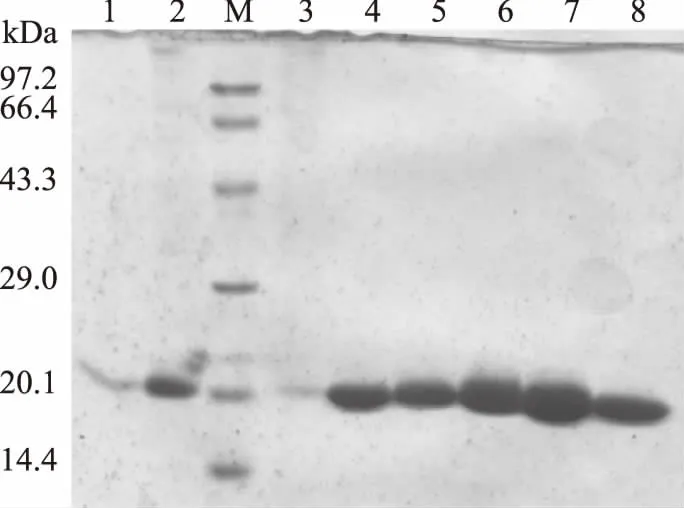
图3 重组角质酶rAgaLJ-2 SDS-PAGE分析Fig.3 SDS-PAGE analyses of recombinant cutinase注:1:粗酶液;2:脱盐;3:穿透峰;4~8:洗脱样品。

表2 角质酶纯化表Table 2 Cutinase purification table
2.5 重组角质酶的酶学特性
2.5.1 最适反应pH和pH稳定性 酶的活力受到所处缓冲体系pH的影响,过酸或过碱都会破坏酶的空间构象,以及有关基团的解离,影响酶活部位的构象,导致酶活的丧失;同时pH也影响底物的解离状态,使底物和酶无法结合或催化,导致酶活力低。不同的缓冲体系中测定重组酶的酶活结果,由图4可知,pH范围在5.0~9.0之间重组角质酶的酶活相对稳定;图5可知,重组酶的最适反应pH为9.0。
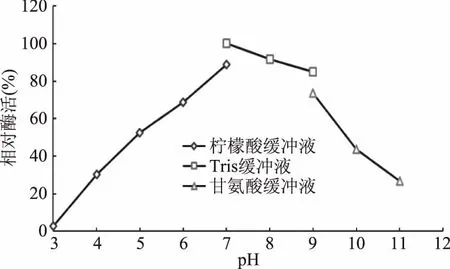
图4 重组角质酶的pH稳定性Fig.4 pH stability of recombinant cutinase
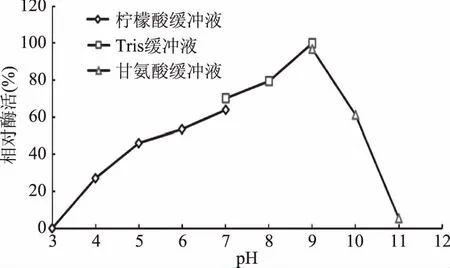
图5 重组角质酶的最适pHFig.5 Optimal pH of recombinant cutinase
2.5.2 最适反应温度和热稳定性 酶的反应在某一低温范围内,反应速率随温度升高而增大。目前大部分的真菌角质酶的最适反应温度也在32~40 ℃之间。从图6可以看出,重组角质酶在20~35 ℃之间随着温度升高,相对酶活也逐渐升高,从35~50 ℃之间随着温度升高,相对酶活逐渐降低,当温度高于50 ℃时,酶活快要降到0,重组角质酶的最适反应温度为35 ℃。从图7中可知,重组酶在40 ℃稳定性好,保温一个小时65%以上的酶活,45 ℃保温1 h能保持40%左右的活性,55 ℃保温30 min能保持20%左右的活性。
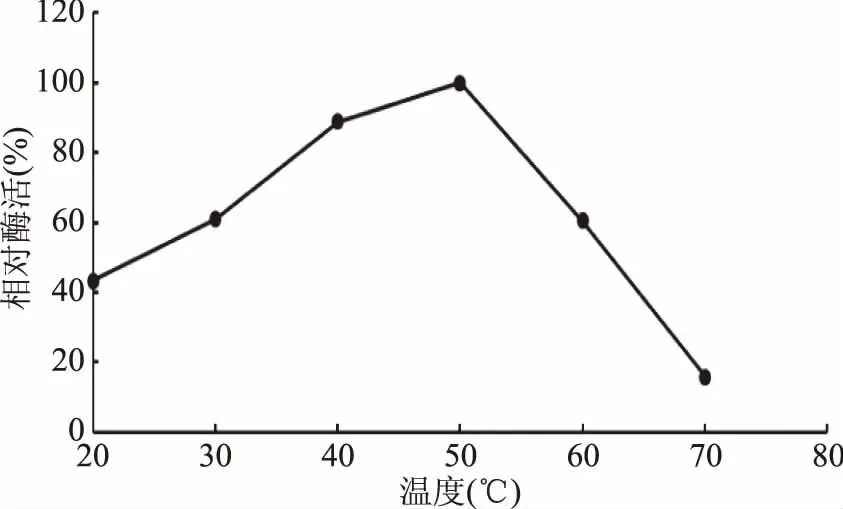
图6 重组角质酶的最适反应温度Fig.6 Optimal temperature of recombinant cutinase
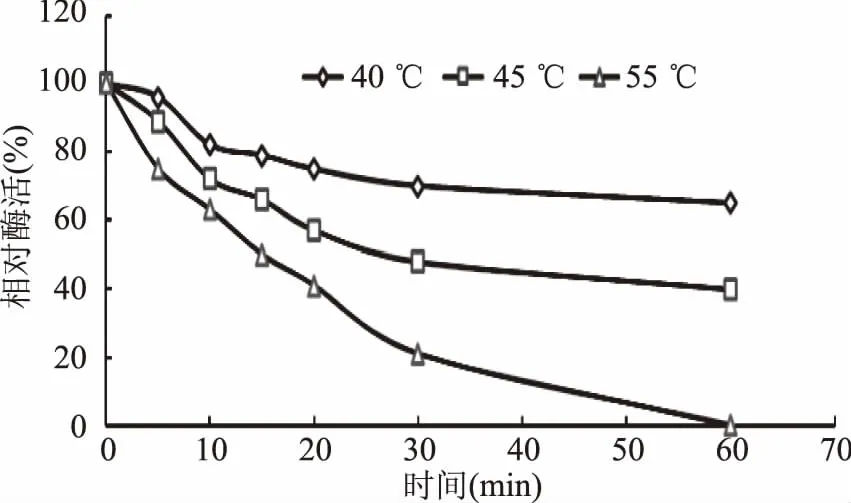
图7 重组角质酶的热稳定性Fig.7 Temperature stability of recombinant cutinase
2.5.3 金属离子和表面活性剂及抑制剂对角质酶活性的影响 不同金属离子及表面活性剂及抑制剂会破坏角质酶结构进而影响角质酶活力。不同金属离子及表面活性剂及抑制剂对重组酶活力的影响如表3所示:KCl、Triton X-100、MnCl2、SDS对该酶活有促进作用,NaCl、BaCl2、CuSO4、Tween-20、FeSO4、ZnSO4、NiCl2、EDTA、Tween-80对该酶活有抑制作用。

表3 金属离子和表面活性剂及抑制剂对角质酶酶活的影响(%)Table 3 Effects of metal ions,surfactants and inhibitors on the activity of cutinase(%)
3 结论
角质酶在工业上具有广泛的应用前景,如在除草剂中加入角质酶,能提高除草剂的效果;在洗衣液中加入角质酶,能提高洗液的去污能力等[19]。本文通过大通量的筛选,获取产角质酶的菌株,选取其中酶活力较高的菌株进行种属鉴定,通过形态学观察以及16S/18S rDNA序列分析,确定该菌株的种属为Fusariummoniliforme。再通过克隆角质酶基因,运用pPIC9K质粒及选取毕赤酵母工程菌,成功构建重组角质酶。重组后的工程菌纯化的酶学性质研究表明:其最适反应pH为9.0,在pH5.0~9.0范围内重组角质酶的酶活相对稳定;最适反应温度为35 ℃,温度低于40 ℃时重组角质酶的酶活相对稳定,比活为2490.1 U/mg,纯化倍数为8.70;KCl、Triton X-100、MnCl2、SDS对该酶活有促进作用,NaCl、BaCl2、CuSO4、Tween-20、FeSO4、ZnSO4、NiCl2、EDTA、Tween-80对该酶活有抑制作用。据报道,陈晟[20]等一种嗜热细菌的研究中纯化后的比活为400.75 U/mg,纯化倍数为8.11;麻莹等[21]在桃褐腐菌角质酶的克隆与表达中纯化后的比活为102.00 U/mg。目前报道的角质酶只有少数比活能达到2000 U/mg,说明在毕赤酵母表达纯化方面有了较大的提高,具有良好的开发价值。

