110例成人型胆管扩张症的临床诊治分析
王辉 王坚
胆管扩张症(biliary dilatation,BD),又称胆管囊状扩张症,以往多以先天性胆总管囊肿命名,是胆管原发性病变中较少见的一种疾病,多见于婴幼儿时期和儿童期,约20%发病于成年期,女性的发病率为男性的3~4倍[1-2]。胆管扩张症容易继发胆道结石、胆道感染、胆源性胰腺炎等并发症,且具有较高的癌变风险,因此早期诊断及尽早手术是目前一致的观点。但是关于胆管扩张症的临床分型以及手术方式的选择等问题仍存在一些争论,是目前临床治疗中的焦点与难点所在。本研究通过回顾性分析2005年6月至2017年9月上海交通大学医学院附属仁济医院收治并手术的110例成人型胆管扩张症病人的临床资料,进一步探讨临床诊治中的相关问题。
资料与方法
一、基本资料
本组110例成人型胆管扩张症病人中,男性35例,女性75例,年龄17~86岁,平均年龄为40.9岁。临床表现有黄疸症状者19例(17.3%),有腹痛症状者70例(63.6%),有发热症状者12例(10.9%),无症状者27例(24.6%)。合并肝内胆管结石4例,合并胆总管结石32例,合并胆囊结石30例,合并胆管癌1例。既往有胆总管囊肿手术史8例,其中因孕期胆管炎行胆总管T管外引流术1例,行胆管囊肿切除+胆管十二指肠吻合术2例,行胆管囊肿切除+胆管空肠吻合术5例,上述8例病人中7例曾行一次胆管囊肿切除,1例曾行两次胆管囊肿切除,再次手术原因为胆管囊肿残留。
二、临床分型与手术方式
胆管扩张症的分型较多,日本学者Todani[3]于1977年提出的胆总管囊肿分型是应用最广泛的,分为Ⅰ~Ⅴ型,但Todani分型对肝内胆管扩张的分型不够详细,而对肝外胆管扩张的分型又过于繁琐。2017年中华医学会外科学分会胆道外科学组根据董家鸿教授提出的新分型进行修改形成了胆道学组最新分型[4],即董氏分型,分为A、B、C、D四型。董氏A型与B型对应TodaniⅤ型,董氏C型对应TodaniⅠ、Ⅱ、ⅣB型,董氏D型对应TodaniⅣA型。董氏分型具体的病变受累范围与相应的手术方式详见《胆管扩张症诊断与治疗指南(2017版)》[4]。
110例病人按Todani分型分类,Ⅰ型91例(82.7%),Ⅱ型1例(0.9%),Ⅲ型0例,Ⅳ型17例(15.5%),均为ⅣA型,Ⅴ型1例(0.9%)。按董氏分型分类,B型1例(0.9%),C型92例(83.6%),其中C1型68例(61.8%),C2型24例(21.8%),D型17例(15.5%),其中D1型10例(9.1%),D2型7例(6.4%)。
三、随访与统计学处理
结 果
一、分型与手术方式的关系
按Todani分型,本组TodaniⅠ型91例,均行胆管囊肿切除术;TodaniⅡ型1例,行胆管囊肿切除术;Todani ⅣA型17例,行肝移植术1例,行肝切除术6例,行胆管囊肿切除术10例;Todani Ⅴ型1例,行半肝切除术。按董氏分型,B型1例,行半肝切除术;C型92例(C1型68例,C2型24例),均行胆管囊肿切除术;D型17例,其中D1型主要以胆管囊肿切除术为主,D2型主要以肝切除术为主,在10例D1型病人中行胆管囊肿切除术9例,行肝切除术1例,在7例D2型病人中行肝切除术5例,行肝移植术1例,行胆管囊肿切除术1例。根据不同分型与实际对应的手术方式详见表1。
本组110例病人中,开腹手术100例(90.9%),腹腔镜手术5例,达芬奇机器人手术5例,10例微创手术病人均为Todani Ⅰ型,按董氏分型,该10例病人均为C型,其中C1型7例,C2型3例,手术方式均为胆管囊肿切除+胆肠Roux-en-Y吻合术。将10例微创手术病人的手术情况与同时期22例开腹手术的C型病人进行比较,发现机器人手术的术中出血量明显少于腹腔镜手术和开放手术(P<0.05),机器人手术和腹腔镜手术的住院时间明显短于开放手术(P<0.05),机器人手术和腹腔镜手术的术后疼痛评分明显低于开放手术(P<0.05),机器人手术的住院费用明显高于腹腔镜手术与开放手术,腹腔镜手术的手术时间明显长于开放手术(P<0.05),三组在术后恢复进食时间、术中输血及胆胰漏等并发症发生率方面差异无统计学意义(P>0.05),详见表2。
二、治疗结果
110例病人的并发症情况详见表3。本组23例病人术后出现并发症,其中胆漏7例次、胰漏18例次、腹腔内出血1例次、胃排空障碍12例次,并发症发生率为20.9%。胆漏发生率为6.4%,其中董氏D型的胆漏发生率为23.5%(4/17),明显高于C型的3.3%(3/92,P<0.05);胰漏发生率为16.4%,18例次胰漏中,12例次为A级胰漏,6例次为B级胰漏,其中董氏C2型的胰漏发生率为54.2%(13/24),明显高于C1型的4.4%(3/68,P<0.01);胃排空障碍发生率为10.9%,12例次胃排空障碍均为术后有胆漏或胰漏者,胃排空障碍与术后胆胰漏之间存在正相关(P<0.01),Spearman相关系数为0.681。胃排空障碍与胆胰漏之间的关系见表4。
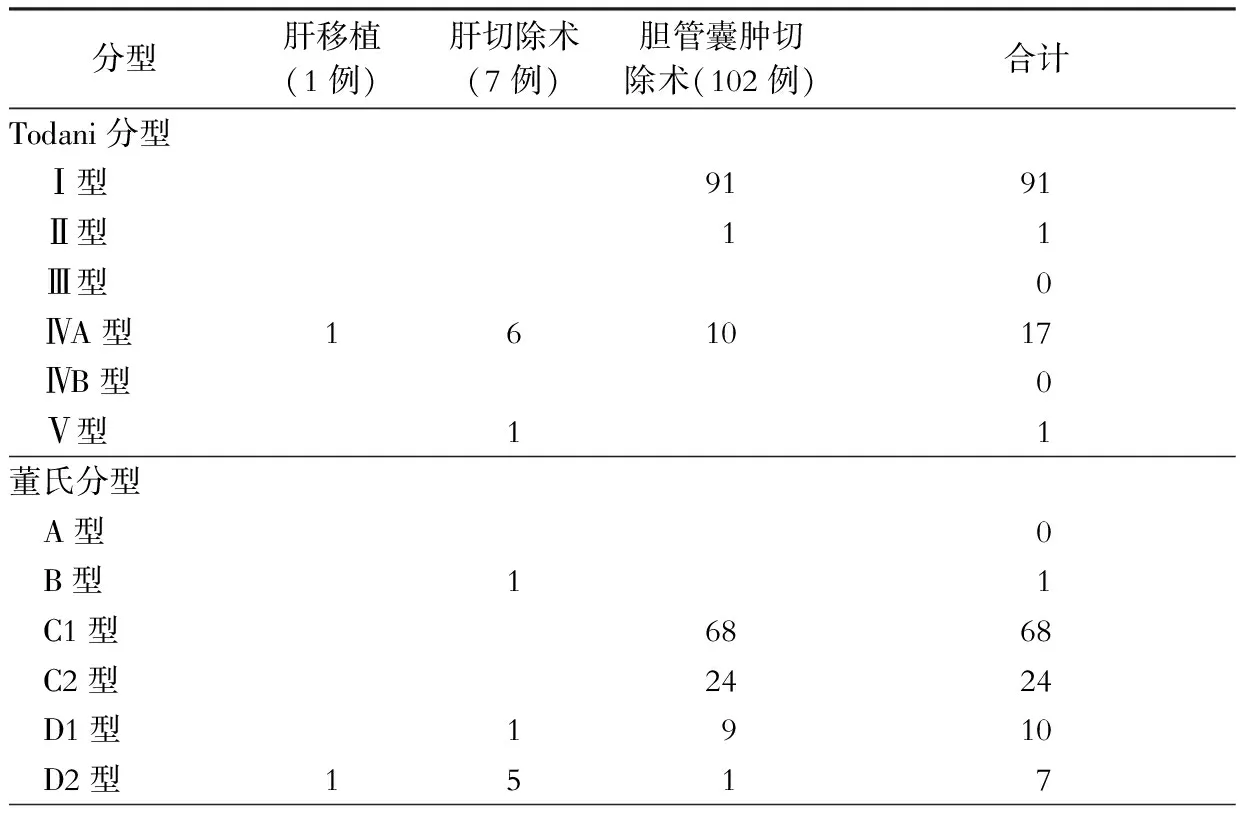
表1 110例BD病人根据不同分型相对应的手术方式(例)
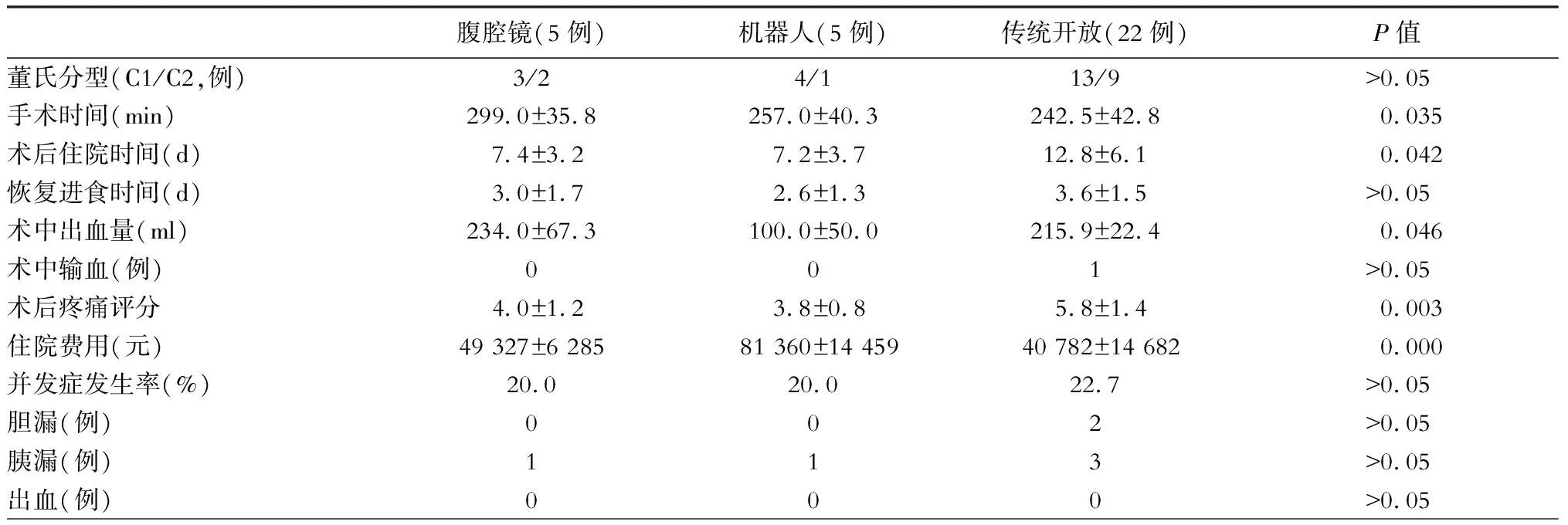
表2 董氏C型病人开腹与微创手术的比较
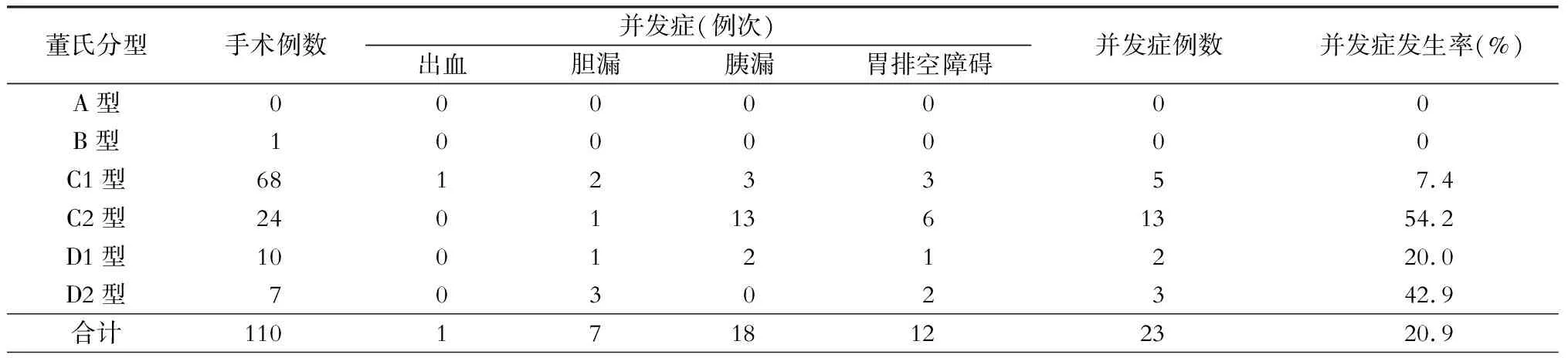
表3 不同董氏分型的手术相关并发症情况
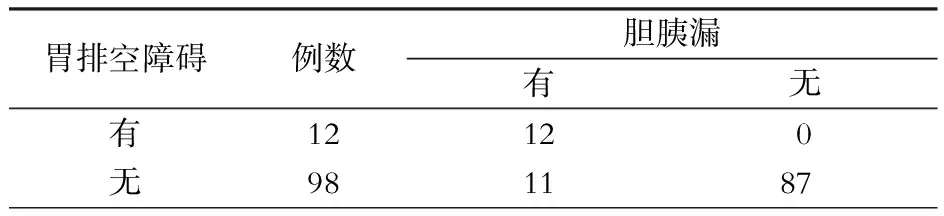
表4 胃排空障碍与胆胰漏之间的关系 (例)
三、远期随访情况
110例病人中有98例得到完整随访资料,失访12例,随访率为89%,随访时间长度为9~155个月,中位随访时间为60个月。5例病人已死亡,具体死亡原因详见表5。此外,3例病人术后半年内复查磁共振胰胆管造影(MRCP)发现肝内胆管囊肿残留,8例病人术后出现胆管结石(其中3例伴胆管空肠吻合口狭窄),12例病人术后出现不同程度的胆管炎症状。2例病人因复发性胆管炎伴有吻合口狭窄或结石而实施二次手术。董氏D型胆管扩张症病人不同手术方式的远期疗效见表6。
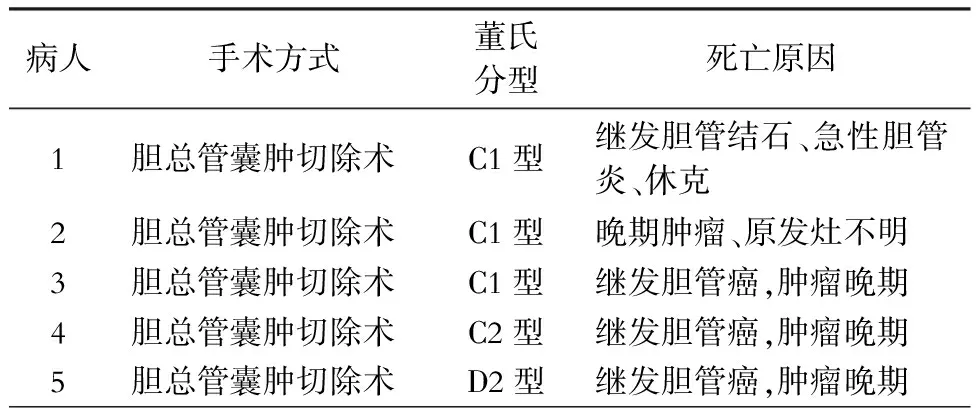
表5 5例死亡病人的具体死亡原因
讨 论
一、董氏分型与手术方案的选择
彻底切除病变扩张的胆管是胆管扩张症治疗的关键,手术的彻底性和尽可能保留脏器之间的平衡是胆管扩张症治疗的难点。因此通过细化临床分型来指导手术方式的选择就显得尤为重要。胆管扩张症的手术难点主要集中在“两头”,即肝门部中央型肝管扩张与远端胰腺段胆管扩张。Todani分型中的ⅣA型将肝外胆管扩张合并肝内胆管扩张归为一类,分型过粗,没有明确肝内胆管胆管扩张累及几级胆管和累及的肝内范围,导致一种分型内需要根据术中实际情况选择不同的手术方式。如本组17例Todani ⅣA型病人的主要术式为三种,6例行肝切除术,10例行胆管囊肿切除术,1例行肝移植术。而董氏分型将Todani ⅣA型按肝门胆管扩张的累及范围又细分为D1(病变累及2级及2级以下中央肝管,需行肝门部扩张胆管及病变肝外胆管切除)和D2型(病变累及3级及3级以上中央肝管,需行受累肝段切除+病变肝外胆管切除),本组10例D1型病人中的9例,7例D2型病人中的5例,其手术方式均符合董氏分型所推荐的术式,由此可见,相对于Todani分型,董氏分型对中央肝管型胆管扩张症累及胆管的范围与部位的分型更精准,对于手术切除范围具有更精确的指导价值。

表6 董氏D型不同手术方式的远期疗效(例)
中央肝管型胆管扩张症治疗的难点是既要切除病变胆管,又要保留足够的正常肝脏,遇到肝门汇合部扩张胆管累及单侧或双侧2级胆管的董氏D1型病人,用传统手术路径如果不切除肝脏,病灶不易切除干净,若行半肝切除或者肝移植则对病人的创伤大;以往手术方法只能保留部分病灶,行病变胆管空肠吻合,但这又不符合胆管扩张症的治疗原则,残留的病变胆管有继发结石和癌变的风险。如本组9例行胆管囊肿切除的董氏D1型病人中,3例病人术后囊肿残留,1例病人术后继发胆管结石。董家鸿教授对94例手术治疗的D型胆管扩张症病人的长期随访后发现[5],有5例(5.3%)病人术后继发胆管癌变,有20例(21.3%)病人术后出现胆管狭窄或结石,这与残留肝内病变胆管密切相关。对于这类病人,最近我们应用围肝门外科技术[6-8],以肝门充分显露为前提,通过由肝内向肝外和由肝外向肝内顺逆结合的肝门解剖路径,在不离断任何一支入肝血管的前提下,用超声吸引刀(CUSA刀)劈开肝正中裂,完全敞开肝门后充分显露病灶与肝动脉、门静脉关系,直视下游离足够长的2级胆管,将病变的2级胆管与肝外胆管一同完整切除,大大提高了病变胆管切除的彻底性,又保留了肝脏。对于董氏D2型病人,如果病变局限于一侧肝脏,行一侧肝叶切除术即可彻底切除病变胆管,如果病变累及双侧肝内胆管,累及3级胆管的一侧行肝叶切除术,累及1、2级胆管的一侧同样需要应用围肝门技术将肝内扩张胆管彻底切除,否则仍会有远期残留病变胆管癌变和成石的风险,若双侧均累及3级胆管,则需要行肝移植术,本组1例肝移植病人就属于这种情况。
胆管扩张症治疗中的另一个难点在胰腺段扩张胆管的处理。董氏分型将C型分为病变不累及胰腺段胆管的C1型和累及胰腺段胆管的C2型,对于C2型病人,既要尽可能切除扩张胆管又要保护胰管避免损伤,手术难度更大,而且C2型胆管扩张症的术后胰漏发生率明显高于C1型,因此将肝外胆管扩张细分为C1与C2也有利于评估手术难度,预估与管控术后并发症。虽然Todani将Ⅰ型进一步细分为Ⅰa、Ⅰb、Ⅰc三型,由于分型未涉及关键的胰腺段扩张胆管情况,对于具体手术缺乏指导价值。本组C2型病人共24例,有13例术后出现胰漏,胰漏发生率高达54.2%,明显高于C1型的4.4%,虽然切除胰腺段扩张胆管存在较高的胰漏发生率,但主要是A级胰漏,经引流均能治愈,相比于为减少胰漏而保留胰腺段扩张胆管,后者的危害更大。如本组有1例C2型病人行胆管囊肿切除+胆肠吻合术,术后病理显示低级别上皮内瘤变,由于胰腺段囊肿残留导致病人于术后18个月因“阻塞性黄疸、肿瘤腹膜广泛转移”死亡。要安全、彻底切除胰腺段扩张胆管,首先尽量通过MRCP等影像学检查明确胆胰汇合是C-P型还是P-C型,然后通过笔者提出的“胰门板降低技术”,循胆管深入胰腺实质,完整切除病变胆管。在完成大Kocher氏切口后,结扎离断十二指肠球部与胆管、胰腺之间的小血管,将十二指肠球部与胰腺上缘胆管分离,显露胆管入胰腺的“胰门”,然后循胆管走向沿胆管与胰腺之间的解剖间隙环周电灼离断胆管与胰腺之间的小分支血管,逐次进入胰腺实质,向胆胰肠结合部方向解剖。存在胰腺段胆管扩张时,胰腺段胆管表面的胰实质常常菲薄,容易切开,从而显露胰腺段胆管全长,充分暴露胰腺段胆管前壁及左右两侧,游离出扩张胆管与远端正常胆管间狭窄平面后离断,如为P-C型胆胰管合流异常,于胰管汇入水平以上离断病变胆管,保留汇入点远端的胆管。
二、关于术后并发症的分析
从本组病例的统计结果可以看出,胆管扩张症的主要术后并发症为胆漏、胰漏与胃排空障碍,本组胆漏的发生率为6.4%,胰漏的发生率为16.4%,胃排空障碍的发生率为10.9%。董氏D型病人的胆漏发生率明显高于C型病人,董氏D型胆管扩张症手术需要在病灶切除后行高位胆肠Roux-en-Y吻合,存在一定的技术难度,这可能是术后胆漏发生率高的原因。应用围肝门技术敞开肝门后,进行肝门胆管整形,可以提高胆肠吻合的精度,减少胆漏与吻合口狭窄的发生率[9-10]。肝门胆管整形应尽量拼合成1个吻合口,注意避免遗漏右后肝管和尾状叶胆管的开口,吻合时遵循黏膜对黏膜的原则,多采用5-0 PDSⅡ缝线进行连续外翻缝合,注意保持吻合无张力,保证吻合口血供良好。
董氏C2型病人的胰漏发生率明显高于C1型病人,所以对C2型胆管扩张症病人术后并发症如胰漏的管控要做出预估,术中引流管的放置要尽量保证通畅引流,术后早期使用生长抑素类药物,一旦有胰漏,及时检查腹部CT,明确有无腹腔积液,必要时穿刺引流,避免形成腹腔感染灶。
本组12例术后胃排空障碍病人均为术后有胆漏或胰漏的病人,经统计分析发现两者之间存在正相关性,说明胰漏、胆漏是术后发生胃排空障碍的主要原因,这与胆漏或胰漏所致的腹腔积液、腹腔感染等局部炎症刺激胃壁而导致胃动力下降、排空延迟有关,而胰漏的发生主要以C2型胆管扩张症的病人为主,所以对于一些高龄、术前营养状况差的C2型病人,我们建议术中常规放置空肠营养管,这样术后一旦出现胰漏导致的胃排空障碍,可以及时采取肠内营养支持治疗。
三、微创手术在成人型胆管扩张症中的运用
自1995年Farello等[11]首次报道完成小儿腹腔镜下胆管囊肿切除术以来,至2017年底,文献报道腹腔镜成人型胆管扩张症的手术例数共约400例[12-16],单中心最大宗报道例数是82例[14],机器人成人型胆管扩张症手术的报道例数共30余例[17-19],单中心最大宗报道例数是18例[17]。比较本组微创手术与开腹手术对胆管扩张症病人的疗效发现,机器人组的术中出血量明显少于开放组,机器人组与腹腔镜组在住院时间明显短于开放组且术后疼痛评分明显低于开放组,机器人组与腹腔镜组在术后恢复进食时间及术后并发症发生率方面与开腹手术组相比无明显差异,与文献报道相似[20],可见微创手术应用于董氏C型胆管扩张症病人是安全可行的,并且能减轻病人术后疼痛,缩短住院时间,同时达到了病人对美容的需求。目前胆管扩张症的微创手术主要应用于董氏C型即TodaniⅠ型病人,但由于腔镜视野的限制,董氏C2型病人腔镜下要彻底切除胰腺段扩张胆管有一定难度,并且C2型病人在开腹手术时处理胰腺段扩张胆管也很困难,术后胰漏发生率高,所以微创手术更适用于董氏C1型胆管扩张症病人。机器人手术具有特有的三维视野及灵活的“内腕”功能,能使操作更加精细,有助于提高胆肠吻合的精确度,缩短胆肠吻合的学习曲线。
——记董氏膏方微商爱心团队

